هیدروژن
هیدروژن یا آبزا (به انگلیسی: Hydrogen)، با نماد شیمیایی H نام یک عنصر شیمیایی در جدول تناوبی با عدد اتمی ۱ است.[7] جرم اتمی این عنصر ۱٫۰۰۷۹۴ u است. هیدروژن سبکترین عنصر در جهان است و بیش از دیگر عنصرها میتوان آن را به صورت آزاد در طبیعت پیدا کرد. میتوان گفت نزدیک به ۷۵٪ از جرم جهان از هیدروژن ساخته شدهاست.[8] برخی جرمهای آسمانی مانند کوتولهٔ سفید یا ستارههای نوترونی از حالت پلاسمای هیدروژن ساخته شدهاند؛ ولی در طبیعت روی زمین به سختی میتوان تک اتم هیدروژن را پیدا کرد.
 درخشش بنفش در حالت پلاسما | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| هیدروژن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ظاهر | درخشش بنفش در حالت پلاسما | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد Ar, استاندارد(H) | [۱٫۰۰۷۸۴, ۱٫۰۰۸۱۱] قراردادی: ۱٫۰۰۸ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| هیدروژن در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | فلزهای قلیایی: H and alkali metals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Reactive nonmetal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | 1s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| لایه الکترونی | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | گاز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | (H2) 13.99 کلوین (−259.16 سانتیگراد ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | (H2) 20.271 کلوین (−252.879 سانتیگراد ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (در STP) | 0.08988 گرم/لیتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (در m.p.) | 0.07 گرم بر سانتیمتر مکعب (solid: 0.0763 g/cm3)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (در b.p.) | 0.07099 گرم بر سانتیمتر مکعب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه سهگانه | 13.8033 کلوین • 7.041 کیلوپاسکال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه بحرانی | 32.938 کلوین • 1.2858 مگاپاسکال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی ذوب | (H2) 0.117 ژول بر مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | (H2) 0.904 کیلوژول بر مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | (H2) 28.836 ژول بر (مول در کلوین) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −1, +1 (یک اکسید آمفوتر) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 2.20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
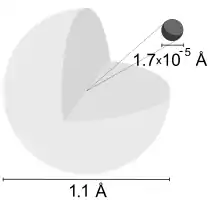
| شعاع کووالانسی | 31±5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | 120 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Color lines in a spectral range | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگیها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | ششگوشه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت | 1310 متر بر ثانیه (gas, 27 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 0.1805 وات بر (کلوین در متر) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مغناطیس | دیامغناطیس[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پذیرفتاری مغناطیسی | −3.98·10−6 سانتیمتر مکعب بر مول (298 K)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 12385-13-6 1333-74-0 (H2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تاریخچه | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کشف | هنری کاوندیش[4][5] (1766) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نامگذاری | آنتوان لاووازیه[6] (1783) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای اصلی هیدروژن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ایزوتوپی از هیدروژن که بیشتر دیده میشود، پروتیوم نام دارد (بیشتر از نماد آن ۱H یاد میشود تا نام آن) این ایزوتوپ، یک پروتون دارد و نوترون ندارد و در ترکیبهای یونی میتواند بار منفی (آنیون هیدرید با نماد -H) به خود بگیرد. همچنین بار مثبت آن نیز به صورت +H یافت میشود که در این صورت تنها از یک پروتون ساده ساخته شدهاست. البته در حقیقت بدست آوردن کاتیون هیدروژن در ترکیبهای پیچیده تری ممکن میشود.
عنصر هیدروژن با بیشتر عنصرها میتواند ترکیب شود و میتوان آن را در آب، تمامی ترکیبهای آلی و موجودات زنده پیدا کرد. این عنصر در واکنشهای اسید و قلیایی در بسیاری واکنشها با داد و ستد پروتون میان مادهٔ حل شدنی و حلال نقش مهمی از خود نشان میدهد. هیدروژن به عنوان سادهترین عنصر شناخته شده در دانش نظری بسیار کمککار بودهاست، برای نمونه از آن در حل معادلهٔ شرودینگر یا در مطالعهٔ انرژی و پیوند و در نهایت پیشرفت دانش مکانیک کوانتوم نقش کلیدی داشتهاست.
گاز هیدروژن (با نماد H۲) نخستین بار در سدهٔ ۱۸ میلادی به صورت آزمایشگاهی از واکنش اسیدهای قوی با فلزهایی مانند روی بدست آمد (۱۷۶۶ تا ۱۷۸۱). هنری کاوندیش نخستین کسی بود که دریافت گاز هیدروژن برای خود، یک مادهٔ جداگانهاست.[9] و از سوختن آن آب پدید میآید. دلیل نامگذاری هیدروژن هم همین ویژگی آن است به معنی آبساز در زبان یونانی. در شرایط استاندارد دما و فشار هیدروژن عنصری است بیرنگ، بیبو، بیمزه، نافلز، غیرسمّی یک ظرفیتی، گازی دو اتمی، بسیار آتشگیر و با فرمول شیمیایی H۲.
در صنعت برای تولید هیدروژن از گاز طبیعی بهره میبرند و کمتر به الکترولیز آب روی میآورند.[10] بیشتر هیدروژن تولیدی در نزدیکی محل تولید، در فرایند سوخت سنگوارهای (مانند کراکینگ) و تولید آمونیاک برای ساخت کود شیمیایی، مورد بهرهبرداری قرار میگیرد. امروزه دانشمندان در تلاش اند تا جلبکهای سبز را در تولید هیدروژن بکار ببندند.
در دانش فلزشناسی، تردی هیدروژنی بسیاری فلزها مورد بررسی است[11] تا با کمک آن در طراحی لولهها و مخزنها دگرگونیهایی پدیدآورند.[12]
ویژگیها
سوختن
_Test_Firing_-_GPN-2000-000055.jpg.webp)
گاز هیدروژن (دیهیدروژن یا مولکول هیدروژن)[13] بسیار آتشگیر است و میتواند در هوا و در بازهٔ گستردهای از غلظت، میان ۴٪ تا ۷۵٪ حجمی، بسوزد.[14] آنتالپی استاندارد سوختن برای هیدروژن ۲۸۶ کیلوژول بر مول است:[15]
2 H۲(g) + O۲(g) → 2 H۲O(l) + 572 kJ (286 kJ/mol)
اگر هیدروژن با هوا آمیخته شود و غلظت آن میان ۴ تا ۷۴ درصد باشد یا آمیزهای از هیدروژن و کلر با درصد ۵ تا ۹۵ درصد میتواند مادهای انفجاری را پدیدآورد. این آمیزههای گازی با یک جرقه، کمی گرما یا نور خورشید بیدرنگ منفجر میشود. دمای خودآتشگیری هیدروژن، دمایی که هیدروژن در آن خود به خود در هوا آتش میگیرد، ۵۰۰ درجهٔ سانتیگراد یا ۹۳۲ فارنهایت است.[16] از شعلهٔ سوختن هیدروژن-اکسیژن خالص پرتوهای فرابنفش تابیده میشود که برای چشم ناپیدایند. مانند شعلهای که در موتور اصلی شاتل فضایی در اثر سوختن هیدروژن-اکسیژن پدید میآید. برای ردیابی نشتی در هیدروژن در حال سوختن نیاز به ابزارهای ردیابی شعله داریم، چنین نشتیهایی میتوانند بسیار خطرناک باشند. فاجعهٔ آتشگیری کشتی هوایی هیندنبرگ و سقوط آن یک نمونهٔ مصیبتبار از سوختن هیدروژن است دلیل این آتشسوزی مورد بررسی است اما شعله و آتشی که از بیرون دیده شد به دلیل سوختن دیگر مواد روی این کشتی هوایی بود.[17] چون هیدروژن سبک است و در هوا شناور میشود شعلهٔ آتش هیدروژن خیلی زود بالا رفت و نسبت به سوختهای هیدروکربنی خرابی کمتری به بار آورد. دو-سوم سرنشینان این فضاپیما از آتشسوزی جان سالم به در بردند. بیشتر کشتهها به دلیل سقوط یا آتشگیری سوخت دیزل بود.[18]
H۲ میتواند با هر عنصر اکسید شدهای وارد واکنش شود همچنین میتواند در دمای اتاق به صورت خود به خودی و البته خطرآفرین با کلر و فلوئور واکنش دهد و هالیدهای هیدروژن، هیدروژن کلرید و هیدروژن فلوئورید را پدیدآورد. این هالیدها خود اسیدهای خطرناکیاند.[19]
تراز انرژی الکترونی
تراز انرژی الکترون در اتم هیدروژن در پایینترین سطح خود یا حالت صفر، ۱۳٫۶- الکترونولت است؛ که برابر است با یک فوتون فرابنفش با طول موجی نزدیک به ۹۲ نانومتر.[20]
تراز انرژی هیدروژن را میتوان با کمک مدل اتمی بور، نزدیک به دقیق بدست آورد. در مدل بور فرض بر این است که الکترونها در اتم مانند زمین که به گِرد خورشید میگردد، به گِرد پروتون (هستهٔ اتم) میچرخند. البته نیروی الکترومغناطیسی میان الکترونها و پروتونها ربایش پدیدمیآورد مانند سیارهها که به خاطر نیروی گرانش سوی ستارهها رباییده میشوند. در دوران آغازین مکانیک کوانتوم، چنین انگار شده بود که تکانهٔ زاویهای کمیتی گسستهاست در نتیجه الکترون در مدل بور اجازه داشت در فاصلههای مشخصی از پروتون جای گیرد و در نتیجه انرژی آن هم با مقدارهای مشخصی برابر میشد.[21]
برای دریافت توضیح دقیق تری دربارهٔ اتم هیدروژن باید به رفتار آن در مکانیک کوانتوم نگاه کرد. با توجه به معادلهٔ شرودینگر و فرمول انتگرالی فاینمن میتوان رفتار احتمالاتی الکترون به گِرد پروتون را محاسبه کرد.[22] برپایهٔ مکانیک کوانتوم، الکترون در یک اتم هیدروژن در حالت تراز صفر، هیچگونه تکانهٔ زاویهای ندارد، تفاوت میان همانندسازی گردش الکترونها به منظومهٔ خورشیدی و آنچه در عمل رخ میدهد اینجا است.
ساختار مولکولی

دو اسپین متفاوت برای همپارهای مولکول دو اتمی هیدروژن وجود دارد که در آن، تفاوت در اسپین هستهها نسبت به یکدیگر است.[23] در ساختار راستهیدروژن (اورتوهیدروژن) اسپین دو پروتون همسو است و با عدد کوانتومی اسپین مولکول ۱ (½+½) یک حالت سهگانه میسازد. در پاراهیدروژن اسپینها ناهمسو است در نتیجه با عدد کوانتومی اسپین ۰ (½–½) یک یگانه را میسازد. در دما و فشار استاندارد، ساختار ۲۵٪ از گاز هیدروژن به صورت پارا و ۷۵٪ آن به صورت راست یا اورتو است که به آن «ساختار معمولی» هم گفته میشود.[24] نسبت تعادلی هیدروژن پارا به راست (اورتو) به دمای آن بستگی دارد اما چون ساختار راست یک حالت برانگیخته است و تراز انرژی بالاتری نسبت به پارا دارد، ناپایدار است و نمیتوان آن را پالایید. در دمای بسیار پایین میتوان گفت حالت تعادل تنها از پارا ساخته شدهاست. ویژگیهای گرمایی پاراهیدروژن پالاییده در حالتهای گازی و مایع، با ساختار معمولی بسیار متفاوت است و این از آنجا است که ظرفیت گرمایی گردشی آنها متفاوت است.[25] تفاوتهای پارا و راست در مولکولهای دیگری که هیدروژن دارند یا در گروههای عاملی نیز دیده میشود. برای نمونه آب و متیلن چنین اند اما این تفاوت در ویژگیهای گرمایی آنها بسیار ناچیز است.[26] برای نمونه نقطهٔ ذوب و جوش پاراهیدروژن ۰٫۱ کلوین از هیدروژن راست (اورتو) پایینتر است.
با افزایش دما، تغییر ویژگیهای هیدروژن از پارا به راست (اورتو) افزایش مییابد و پس از اندکی H۲ فشرده سرشار از ساختار پُرانرژی اورتو میشود، ساختاری که با کندی بسیار به ساختار پارا بازمیگردد.[27] نسبت اورتو/پارا در هیدروژن فشرده، نکتهٔ کلیدی در آمادهسازی و ذخیرهٔ هیدروژن مایع است که باید آن را در نظر داشت. فرایند دگرگونی هیدروژن از راست (اورتو) به پارا گرمازا است و آنقدر گرما تولید میکند که باعث بخار شدن بخشی از هیدروژن مایع شود. در این فرایند از آسانگرهایی مانند زغال فعال، اکسید آهن(III)، آزبست پلاتینی، برخی فلزهای کمیاب، ترکیبهای اورانیوم، اکسید کروم(III) و برخی ترکیبهای نیکل کمک گرفته میشود.[28] این آسانگرها هنگام خنکسازی هیدروژن افزوده میشوند.[29]
حالتهای گوناگون
هیدروژن در فاز فلزی، یک ماده تباهیده است، در این فاز، هیدروژن به شکل یک رسانای الکتریکی رفتار میکند. این فاز به صورت نظری در سال ۱۹۳۵ پیشبینی شد،[30] اما هنوز به روشنی دیده نشدهاست و همچنان این احتمال وجود دارد که فازهای جدیدی از هیدروژن جامد، در شرایط استاتیک، پیدا شود.[31][32]
ترکیبها
- نگاه کنید به: رده:ترکیبهای هیدروژن
کووالانت و ترکیبهای آلی
هیدروژن از سبکترین گازها است و میتواند با بیشتر عنصرها وارد واکنش شود در حالی که در حالت مولکولی، H۲ در شرایط استاندارد چندان واکنش پذیر نیست. هیدروژن الکترونگاتیوی ۲٫۲ دارد و میتواند با عنصرهایی که الکترونگاتیوی بیشتری دارند مانند هالوژنها (مانند F، Ca، Br و I) یا اکسیژن وارد واکنش شود. در تمامی این واکنشها هیدروژن بار مثبت به خود میگیرد.[33] هیدروژن در ترکیب با فلوئور، اکسیژن یا نیتروژن پیوندی غیرکووالانسی با توانمندی میانگین به نام پیوند هیدروژنی برقرار میکند. این پیوند در پایداری بسیاری از مولکولهای زیستی نقش اساسی دارد.[34][35] همچنین هیدروژن این توان را دارد که با عنصرهایی با الکترونگاتیوی کمتر مانند فلزها و شبهفلزها وارد واکنش شود. در این صورت هیدروژن بار منفی به خود میگیرد. این گونه ترکیبها بیشتر با نام هیدرید شناخته میشوند.[36]
هیدروژن میتواند رشتههای ترکیبهای گستردهای را با کربن پدیدآورد. این ترکیبها، هیدروکربن نام دارند. بیش از این، رشته ترکیبهای هیدروژن با ناجوراتمها هم وجود دارد که از هیدروکربنها هم گستردهتر است و به دلیل ارتباطی که میان آنها و اندامهای زنده وجود دارد به آنها ترکیبهای آلی گفته میشود.[37] و دانش بررسی ویژگیهای چنین ترکیبهایی شیمی آلی نام دارد.[38] و چنانکه این بررسی در زمینهٔ سازوکار اندامکهای زنده باشد زیستشیمی خوانده میشود.[39] البته تعریف دیگری هم وجود دارد: برخی بر این باور اند که هر ترکیبی که کربن داشته باشد ترکیب آلی نام دارد، هرچند، بیشتر این ترکیبهای کربنی دارای هیدروژناند.[37] امروزه میلیونها هیدروکربن در جهان شناخته شدهاست که برای ساخت بسیاری از آنها از فرایندهای پیچیدهای بهره برده شدهاست.
هیدریدها
بیشتر ترکیبهای هیدروژن، هیدرید نام دارند. عبارت هیدرید نشان میدهد که در آن ترکیب اتم هیدروژن بار منفی یا آنیون به خود گرفته و به صورت -H نمایش داده میشود. این حالت زمانی پیش میآید که هیدروژن با عنصرهایی که دوست دارند الکترون از دست دهند، ترکیب شود. این مطلب نخستین بار توسط گیلبرت لوویس در سال ۱۹۱۶ برای هیدریدهای گروه یک و دو پیشنهاد شد؛ پس از آن مورئر، در سال ۱۹۲۰ با کمک الکترولیز لیتیم هیدرید مذاب، درستی این پدیده را نشان داد. همچنین مقدار هیدروژن در آنُد با کمک معادلات استوکیومتری قابل شمارش بود.[40] برای هیدرید عنصرهایی غیر از فلزهای گروه یک و دو، با در نظر گرفتن الکتروندوستی پایین هیدروژن، وضعیت کمی متفاوت است. همچنین ترکیب BeH۲ در گروه دو، یک پلیمری و استثنا است. در لیتیم آلومینیوم هیدرید، آنیون AlH−
۴ مرکزهای هیدریدی را با خود میبرد در حالی که به سختی با Al(III) در پیونداند.
هیدریدها تقریباً با همهٔ عنصرهای گروه اصلی ساخته میشوند ولی شمار و آمیزش آنها متفاوت است. برای نمونه بیش از ۱۰۰ هیدرید بور دوتایی شناخته شدهاست درحالی که تنها یک هیدرید آلومینیم دوتایی داریم[41] و هیدرید ایندیم دوتایی هنوز شناخته نشدهاست هرچند که ترکیبهای پیچیدهتر وجود دارند.[42]
در شیمی معدنی، هیدریدها به عنوان یک پل لیگاندی یا لیگاند واسطه هم کاربرد دارند؛ به این ترتیب که میان دو مرکز فلزی در ترکیبهای کمپلس ارتباط برقرار میکنند. این کاربرد هیبرید بیشتر در میان عنصرهای گروه ۱۳ به ویژه در هیدریدهای بور، کمپلکسهای آلومینیم و کربورانهای خوشهدار دیده میشود.[43]
پروتونها و اسیدها
- آگاهی بیشتر در واکنش اسید و باز
هیدروژن با اکسید شدن الکترون خود را از دست میدهد در نتیجه H+ بدست میآید که تنها دارای یک هستهاست که خود آن هسته تنها یک پروتون دارد. به همین دلیل H+ را پروتون نیز مینامند. این ویژگی در بحث واکنشهای اسیدها در خور توجهاست. برپایهٔ نظریهٔ اسید و باز برونستد-لاری اسیدها دهندهٔ پروتون و قلیاها گیرندهٔ پروتوناند.
پروتون یا H+ را نمیتوان به صورت تکی در یک محلول یا بلور یونی پیدا کرد، این به دلیل ربایش بسیار بالای آن به الکترون اتمها یا مولکولهای دیگر است. مگر در دماهای بسیار بالای مرتبط با حالت پلاسما. چنین پروتونهایی را نمیتوان از ابر الکترونی اتم یا مولکول جدا کرد بلکه چسبیده به آنها باقی میماند. البته گاهی از عبارت «پروتون» برای اشاره به هیدروژن با بار مثبت یا کاتیون که در پیوند با دیگر مواد است هم استفاده میشود.
ایزوتوپها
پروتیوم، معمولیترین ایزوتوپ هیدروژن فاقد نوترون است گرچه دو ایزوتوپ دیگر به نام دوتریوم دارای یک نوترون و تریتیوم رادیو اکتیو دارای دو نوترون، وجود دارند. دو ایزوتوپ پایدار هیدروژن پروتیوم(H-1) و دیتریوم(D, H-۲) هستند. دیتریوم شامل ۰٫۰۱۸۴–۰٫۰۰۸۲٪ درصد کل هیدروژن است (آیوپاک)؛ نسبتهای دیتریوم به پروتیوم با توجه به استاندارد مرجع آب VSMOW اعلام میگردد. تریتیوم(T یا H-3)، یک ایزوتوپ پرتوزا (رادیواکتیو) دارای یک پرتون و دو نوترون است. هیدروژن تنها عنصری است که ایزوتوپهای آن اسمی مختلفی دارند.[44]
پیشینه
شناسایی هیدروژن و دستآوردهای پس از آن
در سال ۱۶۷۱، رابرت بویل دریافت و توضیح داد که از واکنش میان آهن و یک اسید رقیق باعث تولید گاز هیدروژن میشود.[45][46] پس از او در سال ۱۷۶۶ هنری کاوندیش نخستین کسی بود که گاز هیدروژن را به عنوان یک مادهٔ جداگانه شناخت. مادهای که نتیجهٔ واکنش شیمیایی میان فلز و اسید بوده و البته آتشگیر نیز بودهاست برای همین وی نام «هوای آتشگیر» را بر آن نهاد. او گمان برد «هوای آتشگیر» در حقیقت همان مادهٔ افسانهای «آتشدوست» یا phlogiston است.[47][48] آزمایشهای پس از آن در سال ۱۷۸۱ نشان داد که از سوختن این گاز، آب پدید میآید. کاوندیش به عنوان کسی که برای نخستین بار هیدروژن را به عنوان یک عنصر دانست، شناخته میشود.[4][5] در سال ۱۷۸۳ لاوازیه و لاپلاس هنگامی که یافتههای کاوندیش را آزمودند و دیدند که از سوختن این گاز، آب پدید میآید به پیشنهاد لاوازیه نام هیدروژن را برای آن برگزیدند.[5] هیدروژن به معنی سازندهٔ آب یا آبزا، از واژهٔ یونانی ὕδρω یا hydro به معنی «آب» و γενῆς یا genes به معنی «سازنده» ساخته شدهاست.[6]
لاوازیه در آزمایشهای سرشناس خود دربارهٔ بقای ماده، از واکنش میان بخار آب با فلز آهنی که در آتش به شدت داغ و دچار تابش شده بود، به تولید هیدروژن دست یافت. اکسید کردن آهن در یک فرایند بدون هوا با کمک پروتونهای آب در دمای بسیار بالا از واکنشهای زیر پیروی میکند:
- Fe + H۲O → FeO + H۲
- 2 Fe + 3 H۲O → Fe۲O۳ + 3 H۲
- 3 Fe + 4 H۲O → Fe۳O۴ + 4 H۲
زیرکونیم و بسیاری دیگر از فلزها اگر همین فرایند را با آب داشته باشند باز به تولید هیدروژن میرسند.
نخستین بار در سال ۱۸۹۸ جیمز دیوئر توانست هیدروژن را در فرایند سرمایش بازیابی و با کمک چندی از ابتکارهای خودش مانند فلاسک خلاء مایع کند.[5] او یک سال بعد توانست هیدروژن را جامد کند.[5] در دسامبر ۱۹۳۱، هارولد یوری توانست دوتریوم و پس از او در ۱۹۳۴ ارنست رادرفورد، مارک اولیفانت و پاول هارتک توانستند تریتیوم را بدست آورند.[4] در ادامه، آب سنگین که به جای هیدروژن معمولی از دوتریوم ساخته شده را گروه هارولد یوری در ۱۹۳۲ بدست آوردند.[5] در سال ۱۸۰۶ فرانسوآ ایزاک دو ریواز نخستین ماشین درونسوز با سوخت آمیزهای از هیدروژن و اکسیژن را ساخت و ادوارد دانیل کلارک لولههای دم دهندهٔ هیدروژن را در سال ۱۸۱۹ درست کرد. روشنایی کلسیم و لامپ دوبراینر هم نخستین بار در سال ۱۸۲۳ درست شدند.[5]

نخستین بادکنک هیدروژنی را ژاک شارل در ۱۷۸۳ پدیدآورد،[5] اما آنری ژیفار نخستین کسی بود که توانست از این بادکنکهای هیدروژنی یک وسیلهٔ جابجایی در آسمان بسازد و به اندازهٔ کافی در هوا بالا رود. او در سال ۱۸۵۲ به این کامیابی دست یافت.[5] پس از آن فردیناند زپلین آلمانی پیشنهاد ساخت یک کشتی پرنده را داد و در سال ۱۹۰۰ نخستین زپلین در آسمان به پرواز درآمد.[5] با آمدن این ابزار مسافرتهای هوایی ممکن شد تا آنجا که از سال ۱۹۱۰ تا ۱۹۱۴ که جنگ جهانی اول آغاز شد، ۳۵٬۰۰۰ مسافر بدون هیچ حادثهٔ جدی در آسمان جابجا شدند. در طول جنگ هم این ابزار به عنوان دیدهبان یا بمب افکن کاربرد داشت.
کشتیهای هوایی بریتانیایی آر۳۴ که در سال ۱۹۱۹ ساخته شد میتوانست عرض اقیانوس اطلس را بدون توقف طی کند. پس از آن در دههٔ ۱۹۲۰ پروازهای مرتب برای مسافرین فراهم شد. با شناسایی گاز هلیم توسط آمریکاییها امید آن بود که این مسافرتها از امنیت بیشتری برخوردار شوند. اما دولت آمریکا نپذیرفت که هلیوم را برای این هدف بفروشد. برای همین به ناچار این کشتیهای فضایی همچنان با هیدروژن کار میکردند. کشتی هوایی هیندنبورگ که در ۶ مه ۱۹۳۷ در آسمان نیوجرسی آتش گرفت هم با گاز H۲ پرواز میکرد.[5] این رویداد به صورت زنده از رادیو پخش میشد و از آن فیلم گرفته میشد. گمان آن میرفت که آتشسوزی به دلیل نشت گاز هیدروژن رخ دادهاست اما چندی بعد بررسیها نشان داد که از جرقهٔ میان تارهای آلومینیمی در اثر الکتریسیتهٔ ساکن آتشسوزی روی دادهاست اما هر چه بود این رویداد باعث از بین رفتن اعتماد عمومی نسبت به ابزارهای پروازی به کمک گاز هیدروژن شد.
در سال ۱۹۷۷ برای نخستین بار از پیلهای نیکلهیدروژن در سامانهٔ ردیابی ماهوارهای نیروی دریایی بهره برده شد.[49] برای نمونه در ایستگاه فضایی بینالمللی،[50] اودیسهٔ مریخ[51] و نقشهبردار سراسر مریخ،[52] پیلهای نیکلهیدروژن بکار رفتهاست. تلسکوپ فضایی هابل هم در بخشهایی از گردشش که فضا تاریک است از نیرو پیلهای نیکلهیدروژن بهره میبرد. اما این پیلها در مه سال ۲۰۰۹ جایگزین شدند.
نقش هیدروژن در گسترش نظریهٔ کوانتوم

ساختار اتمی نسبتاً سادهٔ هیدروژن یعنی اینکه تنها دارای یک پروتون و یک الکترون بود و افزون بر آن، طیف نوری که از هیدروژن تابیده میشد یا توسط هیدروژن دریافت میشد، همگی در گسترش نظریهٔ ساختار اتم بسیار کمککار بودند.[53] سادگی ساختار مولکول هیدروژن و کاتیون H۲+ کمک کرد تا شناخت بهتری از پیوندهای شیمیایی بدست آید. این دستاورد اندکی پس از بیان نظریهٔ رفتار مکانیک کوانتوم اتم هیدروژن در میانهٔ دههٔ ۱۹۲۰، بدست آمد.
یکی از اثرها و ویژگیهای کوانتومی که به خوبی دیده شد (اما در آن هنگامه فهمیده نشد) مشاهدات ماکسول در زمینهٔ هیدروژن بود که نیم قرن پیش از رسیدن به نظریهٔ مکانیک کوانتوم روی داد. ماکسول مشاهده کرد که ظرفیت گرمایی H۲ در دماهای زیر دمای اتاق به سرعت از انرژی گرمایی گازهای دو اتمی دور و به تک اتمیها نزدیک میشود. برپایهٔ نظریهٔ کوانتوم این رفتار به فاصلهٔ میان ترازهای انرژی دورانی بازمیگردد که به ویژه در H۲ به دلیل جرم کوچک آن، با هم فاصلهٔ زیادی دارند این ترازهای بافاصله، از پخش شدن یکنواخت انرژی گرمایی در حرکت دورانی هیدروژن در دمای پایین پیشگیری میکند. گازهای دو اتمی که از اتمهای سنگین تری ساخته شدهاند دارای چنین ترازهای با فاصلهٔ انرژی نیستند و نمیتوانند چنین رفتاری را از خود نشان دهند.[54]
پیدایش

هیدروژن فراوانترین عنصر در جهان است تا آنجا که ۷۵٪ جرم مواد طبیعی از این عنصر ساخته شده و بیش از ۹۰٪ اتمهای سازندهٔ آنها اتم هیدروژن است و البته گمان آن میرود که جرمهای ناشناخته مانند مادهٔ تاریک و انرژی تاریک هم چنین ساختاری داشته باشند.[55] هیدروژن و ایزوتوپهای آن به فراوانی در ستارهها و سیارههای غولهای گازی یافت میشوند. هیدروژن از راه واکنشهای پروتون-پروتون و چرخهٔ سیاناو در همجوشی هستهای نقشی کلیدی در زاییده شدن، درخشان شدن و پُرتوان شدن یک ستاره بازی میکند چون ابرهای مولکول هیدروژن رابطهای مستقیم با زایش یک ستاره دارند.[56]
در سراسر کیهان، هیدروژن بیشتر در حالت اتمی یا پلاسمایی دیده میشود. در حالت پلاسما ویژگیهای ماده کاملاً متفاوت از ویژگیهای آن در حالت مولکولی است چرا که در این وضعیت الکترون و پروتون دیگر در بند یکدیگر نیستند در نتیجه رسانش الکتریکی و تابش بسیار بالایی در ماده رخ میدهد (نوری که از خورشید و دیگر ستارگان تابیده میشود) و ذرههای باردار به شدت زیر تأثیر میدانهای مغناطیسی و الکتریکی قرار دارند. برای نمونه بادهای خورشیدی که با مغناطکرهٔ زمین در اندرکنش قرار میگیرد و باعث بهوجود آمدن شفق قطبی و جریانهای بیرکلند در زمین میشوند، چنیناند.
برخلاف فراوانی زیاد هیدروژن در کیهان، غلظت این عنصر در هواکرهٔ زمین بسیار کم است (۱ ppm برحسب حجم) و این بیشتر به دلیل سبکی این گاز نسبت به دیگر گازها است که میتواند آسانتر از میدان گرانش زمین بگریزد هیدروژن گازی هم که در زمین یافت میشود بیشتر به صورت مولکول دو اتمی H۲ دیده میشود. با وجود تمام این توضیحها، از دیدگاه فراوانی، هیدروژن سومین عنصر فراوان در سطح زمین است[57] و این به دلیل حضور آن در بیشتر ترکیبهای شیمیایی مانند هیدروکربنها و آب است.[43] آب در دسترسترین سرچشمهٔ هیدروژن در زمین است که از دو بخش هیدروژن و یک بخش اکسیژن (H۲O) ساخته شدهاست.
همچنین هیدروژن در بیشتر گونههای مواد آلی که در اندامهای زنده کاربرد دارند پیدا میشود، زغال، سوخت فسیلی و گاز طبیعی. متان (CH۴)، که یکی از محصولات فرعی فساد ترکیبات آلی است همگی دارای هیدروژناند. گاز هیدروژن توسط باکتریها و جلبکها ساخته میشود و البته یکی از سازندگان طبیعی باد شکم است.[58]
هیدروژن از راههای گوناگون بدست میآید، گذر بخار از روی کربن داغ، تجزیه هیدروکربن بوسیلهٔ حرارت، واکنش هیدروکسید سدیم یا پتاسیم بر آلومینیوم، الکترولیز آب یا از جابجایی آن در اسیدها توسط فلزات خاص.
تولید
در آزمایشگاههای زیستشناسی و شیمی میتوان گاز هیدروژن را تولید کرد. این گاز معمولاً محصول کناری دیگر واکنشها است.
در آزمایشگاه
در آزمایشگاه با کمک دستگاه کیپ میتوان از واکنش اسیدها با فلزهایی مانند روی، هیدروژن بدست آورد:
- Zn + 2 H+
→ Zn
۲+ + H
۲
از واکنش آلومینیم با قلیاها هم میتوان به نتیجه رسید:
- ۲ Al + 6 H
۲O + 2 OH−
→ ۲ Al(OH)−
۴ + ۳ H
۲
الکترولیز آب هم یک روش آسان برای تولید هیدروژن است. با گذر یک جریان کم ولتاژ از آب میتوان گاز اکسیژن را در آنُد و گاز هیدروژن را در کاتُد جمع کرد. برای جمعآوری هیدروژن معمولاً کاتد از پلاتین یا یک فلز واسطهٔ دیگر برگزیده میشود. البته چون امکان آتش گرفتن وجود دارد و اکسیژن هم به این سوختن کمک میکند برای همین فلز کاتد و آند هر دو واسطه در نظر گرفته میشود (آهن اکسید میشود و مقدار اکسیژن بدست آمده را کاهش میدهد). بیشترین بازده نظری این واکنش یعنی نسبت جریان الکتریسیته به هیدروژن تولیدی میان ۸۰ تا ۹۴ درصد است.[59]
- ۲ H
۲O(l) → ۲ H
۲(g) + O
۲(g)
شیمیدانان در سال ۲۰۰۷ دریافتند که اگر آلیاژی از گالیم و آلومینیم را به صورت گلولهای درآورند و در آب بیندازند میتواند هیدروژن تولید کند. همچنین این فرایند آلومینا هم پدیدمیآورد. در این میان گالیم نمیگذارد که لایهای از اکسیژن بر روی گلوله ساخته شود و البته گالیم پس از واکنش دوباره قابل استفادهاست و این به دلیل گرانی این فلز نکتهٔ مهمی است. این روش از نظر کاهش هزینه هم درخور توجهاست چرا که هیدروژن در همانجا تولید میشود و دیگر نیازی به جابجایی ندارد.[60]
در صنعت
راههای گوناگونی برای تولید صنعتی هیدروژن پیدا شدهاست. اما بهترین آنها از نظر اقتصادی، برداشتن هیدروژن از هیدروکربنها است. در این روش بخار آب در دمای بالا با سوختهای سنگوارهای مانند متان موجود در گاز طبیعی[61] واکنش میدهد و مخلوط مونوکسید کربن و H
۲ پدیدمیآورد که به آن گاز آب یا گاز سنتز میگویند. منظور از دمای بالا در این واکنش ۱۰۰۰ تا ۱۴۰۰ کلوین، ۷۰۰ تا ۱۱۰۰ سانتیگراد، ۱۳۰۰ تا ۲۰۰۰ فارنهایت است.
- CH
۴ + H
۲O → CO + 3 H
۲
تمایل بر این است که این واکنش در فشار پایین انجام گیرد ولی چنین نمیشود و در فشارهای بالا (۲ مگاپاسکال، ۲۰ اتمسفر یا ۶۰۰ اینچ جیوه) رخ میدهد چون هیدروژن با فشار بالا کالای تجاری تری است و فرایند پالایش آن و جداسازی اش از دیگر گازها (PSA) در فشار بالا بهتر صورت میگیرد. مخلوط گاز سنتز جهت تولید متانول و ترکیبهای مرتبط دیگر بکار میرود. جدای از متان، هیدروکربنهای پیچیدهتر هم میتوانند در تولید گاز سنتز بکار روند تنها نسبت محصولات تولیدی متفاوت است. یکی از بزرگترین پیچیدگیها در این فرایندهای بهینهسازی پدیداری کُک یا کربن است.
- CH
۴ → C + 2 H۲
برای پالایش گاز هیدروژن از بخار آب زیادی که در آغاز واکنش افزودیم، از مونوکسید کربن استفاده میشود و اکسید آهن در این میان نقش آسانگر را بازی میکند. این واکنش از واکنشهای مهم صنعتی در تولید کربن دیاکسید است.[61]
- CO + H
۲O → CO
۲ + H
۲
یک روش صنعتی و مهم دیگر در تولید هیدروژن، اکسید کردن جزئی هیدروکربنها است:[62]
- ۲ CH
۴ + O
۲ → ۲ CO + 4 H
۲
و البته واکنش زغال سنگ که به عنوان پیشدرآمدی بر واکنش بالایی است:[61]
- C + H
۲O → CO + H
۲
هیدروژن مورد نیاز در فرایند هابر برای تولید آمونیاک هم از گاز طبیعی بدست میآید.[63] برقکافت آبنمک هم علاوه بر تولید سدیم هیدروکسید و آزادسازی کلر، هیدروژن نیز آزاد میکند.[64]
به علت خورندگی و اشتعالپذیری گاز هیدروژن، جابجایی آن با دشواری روبروست. از این رو در بسیاری از این فرایندهای صنعتی، هیدروژن تولید شده در همانجا مصرف میشود بدون آنکه پالایش یا جداسازی انجام گیرد.
چرخهٔ گرماشیمی
بیش از ۲۰۰ چرخهٔ گرماشیمی (ترموشی) برای شکستن مولکول آب به اتمهای سازنده اش وجود دارد. دانشمندان بر روی نزدیک به دو جین از این چرخهها مانند چرخهٔ اکسید آهن، چرخهٔ اکسید سریم (IV)-اکسید سریم (III)، چرخهٔ روی-اکسید روی، چرخهٔ گوگرد-ید، چرخهٔ مس-کلر، چرخهٔ هیبرید گوگرد پژوهش و آزمایش میکنند و در تلاش اند تا از آب و گرما، به هیدروژن و اکسیژن برسند بدون اینکه از جریان برق کمک بگیرند.[65] شماری از آزمایشگاهها (از جمله در فرانسه، آلمان، یونان، ژاپن و آمریکا) در حال گسترش روشهای ترموشیمی یا گرماشیمی اند تا بتوانند با کمک انرژی خورشیدی و آب، هیدروژن تولید کنند.[66]
خوردگی بدون هوا
در شرایط بدون هوا، آهن و فولاد به آرامی با پروتونهای آب، اکسید میشوند و مولکول هیدروژن (H۲) آزاد میشود. در این فرایند نخستین چیزی که ساخته میشود هیدروکسید آهن(II) (زنگارهای سبز) است و واکنش آن به صورت زیر است:
- Fe + 2 H۲O → Fe(OH)۲ + H۲
در شرایط بی هوا، هیدروکسید آهن(II) آزاد شده میتواند با پروتونهای آب اکسید شود و مگنتیت و هیدروژن را پدیدمیآورد. فرایندی که توضیح داده شد، واکنش شیکور نام دارد.
- ۳ Fe(OH)۲ → Fe۳O۴ + ۲ H۲O + H۲
- هیدروژن + آب + مگنتیت → هیدروکسید آهن
بلور مگنتیت (Fe۳O۴)، اگر به خوبی ساخته شده باشد از دید ترمودینامیکی پایدارتر از هیدروکسید آهن (Fe(OH)۲) است.
آنچه گفته شد فرایند خوردگی بدون هوای آهن و فولاد است که در آبهای زیرزمینی بدون اکسیژن یا در خاکهای کاهندهٔ زیر سفرههای آب روی میدهد.
درون زمین
در نبود اکسیژن هوا (O۲)، در شرایط ویژهٔ درون زمین و در فاصلهای بسیار دور از هواکره، در فرایندی به نام سرپانتینی کردن، گاز هیدروژن یا H۲ پدید میآید. در این فرایند: اکسیدکردن بدون هوا، توسط پروتونهای (H+) آب موجود در یون آهن Fe۲+ سیلیکات در شبکهٔ بلوری فایالیت (Fe۲SiO۴، الیوین سرشار از آهن) دیده میشود. در پایان، این واکنش به ساخت مگنتیت (Fe۳O۴)، کوارتز (SiO۲) و هیدروژن (H۲) میرسد:
- ۳ Fe۲SiO۴ + ۲ H۲O → ۲ Fe۳O۴ + ۳ SiO۲ + ۳ H۲
- هیدروژن + کوارتز + مگنتیت → آب + فایالیت
این واکنش به واکنش شیکور که در خوردگی بدون هوا گفته شد، بسیار نزدیک است.
کاربردها
کاربرد در فرایندها
هیدروژن یا H۲ به فراوانی در صنایع شیمیایی و پتروشیمی کاربرد دارد. بزرگترین کاربرد آن در فراوری سوختهای سنگوارهای و تولید آمونیاک است. مصرفکنندگان کلیدی H۲ در کارخانههای پتروشیمی عبارتند از هیدرودآلکیلاسیون، هیدرودسولفوریزاسیون و کراکینگ. البته هیدروژن چندین کاربرد مهم دیگر هم دارد. هیدروژن در هیدروژنه کردن به ویژه در افزایش سطح اشباع چربیهای غیر اشباع و تولید روغن جامد، دانههای روغنی و تولید متانول کاربرد دارد. کاربرد دیگر آن به عنوان منبع هیدروژن در تولید هیدروکلریک اسید است. همچنین هیدروژن به عنوان عامل کاهنده در احیای سنگ معدنهای فلزی کار میکند.[67]
هیدروژن به خوبی در بسیاری از عنصرهای خاکی کمیاب و فلزهای واسطه[68] حل میشود. همچنین در فلزهای آمورفی و بلورهای نانو حل شدنی است.[69]
جدا از واکنشهای شیمیایی که هیدروژن میتواند در آنها شرکت کند، این ماده کاربرد فراوانی در مهندسی و فیزیک دارد. برای نمونه به عنوان گاز پوششی (محافظ) در روشهای گوناگون جوشکاری مانند جوشکاری اتمی هیدروژن مورد نیاز است.[70][71] کاربرد دیگر هیدروژن در خنک کردن مولد الکتریکی نیروگاههای برق است. این کاربرد به این دلیل است که هیدروژن دارای بالاترین رسانش گرمایی در میان گازها است. در پژوهشهای سرماشناسی مانند مطالعهٔ ابررسانایی هم بر روی هیدروژن مایع کار میشود.[72] چگالی گاز هیدروژن نزدیک به ۱/۱۵ هوا است. به همین دلیل در گذشته به عنوان گاز بالابر در بالونها و کشتیهای هوایی کاربرد داشت.[73]
به تازگی از هیدروژن خالص یا آمیختهای از هیدروژن و نیتروژن برای شناسایی نشتیهای ریز و سوراخهای بسیار کوچک در نیروگاهها، صنعتهای شیمیایی، هوافضا، خودروسازی و مخابرات بهره برده میشود.[74] هیدروژن یک افزودنی مجاز به مواد خوراکی است (E 949) با کمک آن میتوان بستهبندی مواد خوراکی را از نظر نشتی و سوراخ آزمود همچنین از اکسید شدن مواد خوراکی هم پیشگیری میکند.[75] دمای هیدروژن در نقطهٔ سهگانه اش به عنوان یکی از نقطههای ثابت در ITS-90 (مقیاس بینالمللی دما در ۱۹۹۰) نشانهگذاری شده که برابر با ۱۳٫۸۰۳۳ کلوین است.[76]
- ایزوتوپهای کمیاب هیدروژن هر یک کاربرد ویژهای دارند.
- دوتریوم (هیدروژن-۲) در واکنشهای شکافت هستهای به عنوان کُندکننده در کاهش حرکت نوترونها کار میکند و در واکنشهای همجوشی هستهای کاربرد دارد.[5]
- ترکیبهای دوتره (حاوی دوتریوم) در پژوهشهای زیستشناسی و شیمی دربارهٔ تأثیرات ایزوتوپها مورد نیازند.[77]
- تریتیوم (هیدروژن-۳) که در رآکتورهای هستهای پدید میآید در ساخت بمبهای هیدروژنی مورد نیاز است.[78]
- تریتیوم یک ایزوتوپ طبقهبندی شده در علوم زیستی است و به عنوان یک منبع ذرات بتا کاربرد دارد (مثلاً در رادیولومینسانس).[79]
حامل انرژی
- همچنین ببینید: اقتصاد هیدروژن
هیدروژن به خودی خود یک منبع انرژی نیست.[80] مگر آنکه با کمک واکنشهای همجوشی هستهای در دوتریوم یا تریتیوم برای نیروگاهها انرژی تولید کند؛ که البته این فناوری بسیار پیشرفتهاست.[81] انرژی خورشید هم از همجوشی هستهای هیدروژن گرفته شدهاست اما بر روی زمین به سختی میتوان به صورت کنترل شده به این فرایند دست یافت.[82] هیدروژن بدست آمده از خورشید، فرایندهای زیستی یا الکتریکی انرژی مورد نیاز برای تولیدش بیشتر از انرژی بدست آمده از سوختنش است به همین دلیل در این موقعیتها با هیدروژن به عنوان یک حامل انرژی برخورد میشود مانند یک باتری. هیدروژن را میتوان از سوختهای سنگوارهای (مانند متان) بدست آورد اما این گونه منبعها همیشگی و پایدار نیستند.[80]
چگالی انرژی در یکای حجم هم برای هیدروژن مایع و هم برای گاز فشردهٔ هیدروژن در هر فشاری که بتوان با آن کار کرد آشکارا از چگالی انرژی سوختهای سنگوارهای سنتی پایینتر است همچنین چگالی انرژی در یکای جرم هم برای سوختهای سنگوارهای بالاتر است.[80] اما همچنان پژوهشها بر سر این است که در آینده به گستردگی از هیدروژن عنوان یک حامل انرژی بهره برده شود.[83] برای نمونه میتوان فرایند جداسازی کربن از هواکره و ذخیرهسازی آن را برای هیدروژن هم همانند کرد و از سوختهای سنگوارهای هیدروژن بدست آورد.[84] اگر بتوان از هیدروژن به عنوان سوخت در ترابری بهره برد، این سوخت به نسبت دیگر سوختها، پاک میسوزد، اندکی NOx تولید میکند[84] اما به هر حال بدون پدیدآوردن کربن میسوزد.[84] نباید فراموش کرد که هزینههای مربوط به دگرگونی کامل سامانه، به اقتصاد هیدروژنی درخور نگرش است.[85]
خنککننده
از هیدروژن در نیروگاههای برق به عنوان خنککنندهٔ ژنراتورها بهره برده میشود. این به دلیل ظرفیت گرمایی بسیار بالای این گاز است که از همهٔ گازها بالاتر است.
در نیمه رساناها
هیدروژن برای اشباع پیوندهای شکستهٔ سیلیسیم آمورف و کربن آمورف کاربرد دارد و کمک میکند تا ویژگیهای ماده پایدار شود.[86] همچنین در بسیاری از اکسیدهای مواد به عنوان دهندهٔ الکترون کار میکند. چند مورد از این اکسیدها عبارتند از:[87][88][89][90]
ZnO, SnO۲, CdO, MgO, ZrO۲, HfO۲, La۲O۳, Y۲O۳, TiO۲, SrTiO۳، LaAlO۳، SiO۲, Al۲O۳، ZrSiO۴، HfSiO۴ و SrZrO۳.
دیگر کاربردها
به مقدار بسیار زیادی هیدروژن در فرایند هابر (Haber Process) نقش دارد. دیگر کاربردهای هیدروژن عبارتاند از:
- آلکیل زدایی آبی (هیدرو دِ آلکیلاسیون hydrodealkylation)، گوگردزدایی آبی (هیدرو دِ سولفوریزاسیون، hydrodesulfurization) و هیدروکرکینک (hydrocracking)
- در سوختهای موشک
هیدروژن میتواند در موتورهای درونسوز سوخته شود یا در پیلهای هیدروژنی، انرژی الکتریکی تولید کند. تاکنون چند خودروی آزمایشی توسط چند شرکت خودروسازی از جمله BMW (موتور گرمایی) و بنز، تویوتا، اپل و … (پیل هیدروژنی) تولید شدهاست. پیلهای سوختی هیدروژنی، بهعنوان راه کاری برای تولید توان بالقوهٔ ارزان و بدون آلودگی، مورد توجه قرار گرفتهاست.[91][92]
واکنشهای زیستی
H۲ محصول برخی از واکنشهای بدون هوا است که توسط چندین گونه میکروب درست میشود. این واکنشها معمولاً با کمک آهن یا نیکل موجود در آنزیمهایی به نام هیدروژناس آسان میشوند. این آنزیمها به عنوان آسانگر در واکنشهای برگشتپذیر اکسایش و کاهش میان H۲ و اجزایش، دو پروتون و دو الکترون، کار میکنند. گاز هیدروژن هنگام انتقال تعادلهای کاهشی بهوجود آمده در اثر تخمیر اسید پیرویک با آب، پدید میآید.[93]
همه روزه شکستن مولکول آب به اجزای سازنده اش، پروتونها، الکترونها و اکسیژن در واکنش نورساخت در اندامهای زنده روی میدهد. برخی از اندامها مانند سیانوباکتر و جلبک کلامیدوموناز رینهارتی یک گام دوم را هم وارد واکنش میکنند که مربوط به واکنشهای در تاریکی است و در آن پروتونها و الکترونها کاهیده میشوند و با کمک آنزیمهای ویژهای که در کلروپلاست[94] وجود دارد گاز H۲ را درست میکنند. تلاش شده تا آنزیمهای سیانوباکتری را به صورت ژنی تصحیح کنند و با کمک آنها حتی در حضور اکسیژن هم گاز هیدروژن تولید کنند.[95] همچنین تلاش شده تا ژنهای جلبک یک واکنش دهندهٔ زیستی را هم اصلاح کنند.[96]
هشدارها
| هیدروژن | |
|---|---|
| خطرات | |
| GHS pictograms |  |
| سیستم هماهنگ جهانی طبقهبندی و برچسبگذاری مواد شیمیایی | Danger |
| GHS hazard statements | H220 |
| GHS precautionary statements | P202, P210, P271, P403, P377, P381[97] |
| لوزی آتش | |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| Infobox references | |
|
| |
هنگام کار با هیدروژن باید بسیار هشیار بود. این به دلیل توان آتشگیری و انفجار آن است به ویژه هنگامی که با هوا آمیخته میشود و هنگامی که خالص یا بدون اکسیژن باشد هم فرد را دچار خفگی میکند.[98] هیدروژن مایع توان سردکنندگی بسیار بالایی دارد و مانند دیگر مایعات بسیار سرد، میتواند آسیبهایی همچون یخزدگی را به بار آورد.[99] هیدروژن در بسیاری از فلزها حل میشود گاهی این توانایی دلخواه ما نیست مانند امکان نشت به بیرون و پدیدهٔ تردی هیدروژنی[100] که در صورت ادامه باعث ترک خوردگی یا انفجار میشود.[101] نشت هیدروژن در هوای آزاد باعث شعلهور شدن آن میشود افزون بر این سوختن هیدروژن هنگامی که بسیار داغ باشد، تقریباً پدیدهای ناپیدا (نامرئی) است و میتواند باعث رویدادهای ناگواری شود.[102]
دادههای مربوط به هیدروژن از جمله دادههای مربوط به امنیت آن به دستهای از پدیدهها بستگی دارد. بسیاری از ویژگیهای فیزیکی و شیمیایی هیدروژن به نسبت اورتوهیدروژن و پاراهیدروژن گاز وابستهاست که معمولاً روزها و گاهی هفتهها طول میکشد تا در یک دمای مشخص به تعادل برسد و چون دادههای امنیت مربوط به حالت تعادل است کمی کار دشوار میشود همچنین پارامترهای انفجار، مانند فشار و دمای بحرانی به شدت به هندسهٔ ظرف دربردارنده هم بستگی دارد.[98]
جستارهای وابسته
منابع
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. p. 240. ISBN 978-0-12-352651-9.
- Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0486-6.
- Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 978-0-8493-0464-4.
- "Hydrogen". Van Nostrand's Encyclopedia of Chemistry. Wylie-Interscience. 2005. pp. 797–799. ISBN 978-0-471-61525-5.
- Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 183–191. ISBN 978-0-19-850341-5.
- Stwertka, Albert (1996). A Guide to the Elements. Oxford University Press. pp. 16–21. ISBN 978-0-19-508083-4.
- «Senmerv - هیدروژن». بایگانیشده از اصلی در ۲۵ مه ۲۰۱۱. دریافتشده در ۳ آوریل ۲۰۱۱.
- Palmer, D. (13 September 1997). "Hydrogen in the Universe". NASA. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- Presenter: Professor Jim Al-Khalili (۲۰۱۰-۰۱-۲۱). "Discovering the Elements". Chemistry: A Volatile History. ۲۵:۴۰ minutes in. BBC. BBC Four. Archived from the original on 24 دسامبر 2012. https://www.webcitation.org/6D9jfzNVA?url=http://www.bbc.co.uk/programmes/b00q2mk5.
- "Hydrogen Basics — Production". Florida Solar Energy Center. 2007. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- Rogers، H.C. (۱۹۹۹). «Hydrogen Embrittlement of Metals». Science. ۱۵۹ (۳۸۱۹): ۱۰۵۷–۱۰۶۴. doi:10.1126/science.159.3819.1057. PMID 17775040. بیبکد:1968Sci...159.1057R.
- Christensen, C.H.; Nørskov, J. K.; Johannessen, T. (9 July 2005). "Making society independent of fossil fuels — Danish researchers reveal new technology". Technical University of Denmark. Archived from the original on 24 October 2017. Retrieved 19 May 2015.
- "Dihydrogen". O=CHem Directory. University of Southern Maine. Archived from the original on 24 December 2012. Retrieved 2009-04-06.
- Carcassi، M.N.؛ Fineschi، F. (۲۰۰۵). «Deflagrations of H۲–air and CH۴–air lean mixtures in a vented multi-compartment environment». Energy. ۳۰ (۸): ۱۴۳۹–۱۴۵۱. doi:10.1016/j.energy.2004.02.012.
- Committee on Alternatives and Strategies for Future Hydrogen Production and Use, US National Research Council, US National Academy of Engineering (2004). The Hydrogen Economy: Opportunities, Costs, Barriers, and R&D Needs. National Academies Press. p. ۲۴۰. ISBN 0-309-09163-2. Archived from the original on 25 December 2012.
- Patnaik, P (2007). A comprehensive guide to the hazardous properties of chemical substances. Wiley-Interscience. p. ۴۰۲. ISBN 0-471-71458-5. Archived from the original on 25 December 2012.
- Dziadecki, J. (2005). "Hindenburg Hydrogen Fire". Archived from the original on 24 December 2012. Retrieved 2007-01-16.
- Kelly, M. "The Hindenburg Disaster". About.com:American history. Archived from the original on 24 December 2012. Retrieved 2009-08-08.
- Clayton، D.D. (۲۰۰۳). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. شابک ۰-۵۲۱-۸۲۳۸۱-۱.
- Millar, Tom (December 10, 2003). "Lecture 7, Emission Lines — Examples". PH-3009 (P507/P706/M324) Interstellar Physics. University of Manchester. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- Stern, David P. (2005-05-16). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA Goddard Space Flight Center (mirror). Archived from the original on 24 December 2012. Retrieved 2007-12-20.
- Stern, David P. (2005-02-13). "Wave Mechanics". NASA Goddard Space Flight Center. Archived from the original on 24 December 2012. Retrieved 2008-04-16.
- Staff (2003). "Hydrogen (H۲) Properties, Uses, Applications: Hydrogen Gas and Liquid Hydrogen". Universal Industrial Gases, Inc. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- Tikhonov, Vladimir I. (2002). "Separation of Water into Its Ortho and Para Isomers". Science. ۲۹۶ (۵۵۷۷): ۲۳۶۳. doi:10.1126/science.1069513. PMID 12089435. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Hritz, James (2006). "CH. 6 – Hydrogen" (PDF). NASA Glenn Research Center Glenn Safety Manual, Document GRC-MQSA.001. NASA. Archived from the original (PDF) on 24 October 2017. Retrieved 2008-02-05. Unknown parameter
|month=ignored (help) - Shinitzky, M; Elitzur, Avshalom C. (2006). "Ortho-para spin isomers of the protons in the methylene group". Chirality. ۱۸ (۹): ۷۵۴–۷۵۶. doi:10.1002/chir.20319. PMID 16856167. More than one of
|نام خانوادگی=and|last1=specified (help); More than one of|نام=and|first1=specified (help) - Milenko، Yu. Ya. (۱۹۹۷). «Natural ortho-para conversion rate in liquid and gaseous hydrogen». Journal of Low Temperature Physics. ۱۰۷ (۱–۲): ۷۷–۹۲. doi:10.1007/BF02396837. بیبکد:1997JLTP..107...77M. از پارامتر ناشناخته
|coauthors=صرف نظر شد (|author=پیشنهاد میشود) (کمک) - Amos, Wade A. (1 November 1998). "Costs of Storing and Transporting Hydrogen" (PDF). National Renewable Energy Laboratory. pp. 6–9. Archived from the original (PDF) on 24 October 2017. Retrieved 19 May 2015.
- Svadlenak، R. Eldo (۱۹۵۷). «The Conversion of Ortho- to Parahydrogen on Iron Oxide-Zinc Oxide Catalysts». Journal of the American Chemical Society. ۷۹ (۲۰): ۵۳۸۵–۵۳۸۸. doi:10.1021/ja01577a013. از پارامتر ناشناخته
|coauthors=صرف نظر شد (|author=پیشنهاد میشود) (کمک) - Wigner, E.; Huntington, H.B. (1935). "On the possibility of a metallic modification of hydrogen". Journal of Chemical Physics. 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590.
- Eremets, M.I.; Troyan, I.A. (2011). "Conductive dense hydrogen". Nature Materials. Bibcode:2011NatMa..10..927E. doi:10.1038/nmat3175.
- Dalladay-Simpson, Philip; Howie, Ross; Gregoryanz, Eugene (2016). "Evidence for a new phase of dense hydrogen above 325 gigapascals". Nature. 529: 63–67. Bibcode:2016Natur.529...63D. doi:10.1038/nature16164. Archived from the original on 24 October 2017. Retrieved 20 June 2016.
- Clark, Jim (2002). "The Acidity of the Hydrogen Halides". Chemguide. Archived from the original on 24 December 2012. Retrieved 2008-03-09.
- Kimball, John W. (2003-08-07). "Hydrogen". Kimball's Biology Pages. Archived from the original on 24 December 2012. Retrieved 2008-03-04.
- IUPAC Compendium of Chemical Terminology, Electronic version, Hydrogen Bond بایگانیشده در ۱۹ مارس ۲۰۰۸ توسط Wayback Machine
- Sandrock, Gary (2002-05-02). "Metal-Hydrogen Systems". Sandia National Laboratories. Archived from the original on 24 December 2012. Retrieved 2008-03-23.
- "Structure and Nomenclature of Hydrocarbons". Purdue University. Archived from the original on 24 December 2012. Retrieved 2008-03-23.
- "Organic Chemistry". Dictionary.com. Lexico Publishing Group. 2008. Archived from the original on 24 December 2012. Retrieved 2008-03-23.
- "Biochemistry". Dictionary.com. Lexico Publishing Group. 2008. Archived from the original on 24 December 2012. Retrieved 2008-03-23.
- Moers, Kurt (1920). "Investigations on the Salt Character of Lithium Hydride". Zeitschrift für Anorganische und Allgemeine Chemie. ۱۱۳ (۱۹۱): ۱۷۹–۲۲۸. doi:10.1002/zaac.19201130116.
- Downs، Anthony J. (۱۹۹۴). «The hydrides of aluminium, gallium, indium, and thallium: a re-evaluation». Chemical Society Reviews. ۲۳ (۳): ۱۷۵–۱۸۴. doi:10.1039/CS9942300175. از پارامتر ناشناخته
|coauthors=صرف نظر شد (|author=پیشنهاد میشود) (کمک) - Hibbs, David E. (1999). "A remarkably stable indium trihydride complex: synthesis and characterisation of [InH۳P(C۶H۱۱)۳]". Chemical Communications (۲): ۱۸۵–۱۸۶. doi:10.1039/a809279f. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Miessler, Gary L. (2003). Inorganic Chemistry (3rd ed.). Prentice Hall. ISBN 0-13-035471-6. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - «دانشنامه ستارهشناسی - هیدروژن». بایگانیشده از اصلی در ۵ ژوئن ۲۰۱۲. دریافتشده در ۶ مه ۲۰۱۲.
- Boyle, Robert "Tracts written by the Honourable Robert Boyle containing new experiments, touching the relation betwixt flame and air..." (London, England: 1672).
- Winter, Mark (2007). "Hydrogen: historical information". WebElements Ltd. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- "Why did oxygen supplant phlogiston? Research programmes in the Chemical Revolution – Cambridge Books Online – Cambridge University Press". Archived from the original on 24 December 2012. Retrieved 2011-10-22.
- Just the Facts—Inventions & Discoveries, School Specialty Publishing, 2005
- "NTS-2 Nickel-Hydrogen Battery Performance 31". Aiaa.org. Archived from the original on 24 December 2012. Retrieved 2009-04-06.
- Jannette, A.G.; Hojnicki, J.S.; McKissock, D.B.; Fincannon, J.; Kerslake, T.W.; Rodriguez, C.D. (2004 (2002)). "IECEC '02. 2002 37th Intersociety Energy Conversion Engineering Conference, 2002": ۴۵–۵۰. doi:10.1109/IECEC.2002.1391972. ISBN 0-7803-7296-4. Archived from the original (PDF) on 25 December 2012. Retrieved ۲۰۱۱-۱۱-۱۱. Check date values in:
|سال=(help);|فصل=ignored (help) - Anderson, P.M.; Coyne, J.W. (2002). "A lightweight high reliability single battery power system for interplanetary spacecraft". ۵: ۵–۲۴۳۳. doi:10.1109/AERO.2002.1035418. ISBN 0-7803-7231-X.
|chapter=ignored (help) - "Mars Global Surveyor". Astronautix.com. Archived from the original on 24 December 2012. Retrieved 2009-04-06.
- Crepeau, Bob (2006-01-01). Niels Bohr: The Atomic Model. Great Scientific Minds. Great Neck Publishing. ISBN 1-4298-0723-7.
- Berman، R. (۱۹۵۶). «Cryogenics». Annual Review of Physical Chemistry. ۷: ۱–۲۰. doi:10.1146/annurev.pc.07.100156.000245. بیبکد:1956ARPC....7....1B. از پارامتر ناشناخته
|coauthors=صرف نظر شد (|author=پیشنهاد میشود) (کمک) - Gagnon, Steve. "Hydrogen". Jefferson Lab. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- Haubold, Hans (November 15, 2007). "Solar Thermonuclear Energy Generation". Columbia University. Archived from the original on 25 December 2012. Retrieved 2008-02-12. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Dresselhaus, Mildred; et al. (May 15, 2003). "Basic Research Needs for the Hydrogen Economy" (PDF). Argonne National Laboratory, U.S. Department of Energy, Office of Science Laboratory. Archived from the original (PDF) on 24 October 2017. Retrieved 2016-08-13.
- Berger, Wolfgang H. (November 15, 2007). "The Future of Methane". University of California, San Diego. Archived from the original on 24 December 2012. Retrieved 2008-02-12.
- Kruse, B. (2002). "Hydrogen Status og Muligheter" (PDF). Bellona. Archived from the original (PDF) on 24 October 2017. Retrieved 2008-02-12. Unknown parameter
|utmccn=ignored (help); Unknown parameter|utmctr=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help); Unknown parameter|utmcmd=ignored (help) - Venere, Emil (May 15, 2007). "New process generates hydrogen from aluminum alloy to run engines, fuel cells". Purdue University. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- Oxtoby، D. W. (۲۰۰۲). Principles of Modern Chemistry (ویراست ۵th). Thomson Brooks/Cole. شابک ۰-۰۳-۰۳۵۳۷۳-۴.
- "Hydrogen Properties, Uses, Applications". Universal Industrial Gases, Inc. 2007. Archived from the original on 24 December 2012. Retrieved 2008-03-11.
- Funderburg, Eddie (2008). "Why Are Nitrogen Prices So High?". The Samuel Roberts Noble Foundation. Archived from the original on 24 December 2012. Retrieved 2008-03-11.
- Lees, Andrew (2007). "Chemicals from salt". BBC. Archived from the original on 26 October 2007. Retrieved 2008-03-11. Unknown parameter
|deadپیوند=ignored (help); More than one of|پیوند بایگانی=and|archiveurl=specified (help); More than one of|تاریخ بایگانی=and|archivedate=specified (help) - «Development of solar-powered thermochemical production of hydrogen from water» (PDF). بایگانیشده از اصلی (PDF) در ۲۴ دسامبر ۲۰۱۲. دریافتشده در ۵ ژوئیه ۲۰۱۲.
- Perret, Robert. "Development of Solar-Powered Thermochemical Production of Hydrogen from Water, DOE Hydrogen Program, 2007" (PDF). Archived from the original (PDF) on 24 December 2012. Retrieved 2008-05-17.
- Chemistry Operations (2003-12-15). "Hydrogen". Los Alamos National Laboratory. Archived from the original on 24 December 2012. Retrieved 2008-02-05.
- Takeshita، T.؛ Wallace، W.E.؛ Craig، R.S. (۱۹۷۴). «Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt». Inorganic Chemistry. ۱۳ (۹): ۲۲۸۲–۲۲۸۳. doi:10.1021/ic50139a050.
- Kirchheim، R.؛ Mutschele، T.؛ Kieninger، W.؛ Gleiter، H؛ Birringer، R؛ Koble، T (۱۹۸۸). «Hydrogen in amorphous and nanocrystalline metals». Materials Science and Engineering. ۹۹: ۴۵۷–۴۶۲. doi:10.1016/0025-5416(88)90377-1.
- Durgutlu، Ahmet (۲۰۰۳). «Experimental investigation of the effect of hydrogen in argon as a shielding gas on TIG welding of austenitic stainless steel». Materials & Design. ۲۵ (۱): ۱۹–۲۳. doi:10.1016/j.matdes.2003.07.004.
- «Atomic Hydrogen Welding». Specialty Welds. ۲۰۰۷. بایگانیشده از اصلی در ۲۵ دسامبر ۲۰۱۲.
- Hardy، Walter N. (۲۰۰۳). «From H2 to cryogenic H masers to HiTc superconductors: An unlikely but rewarding path». Physica C: Superconductivity. ۳۸۸–۳۸۹: ۱–۶. doi:10.1016/S0921-4534(02)02591-1. بیبکد:2003PhyC..388....1H.
- Barnes, Matthew (2004). "LZ-129, Hindenburg". The Great Zeppelins. Archived from the original on 24 December 2012. Retrieved 2008-03-18.
- Block, M. (3 September 2004). Hydrogen as Tracer Gas for Leak Detection. 16th WCNDT 2004. Montreal, Canada: Sensistor Technologies. Archived from the original on 24 October 2017. Retrieved 25 March 2008.
- "Report from the Commission on Dietary Food Additive Intake" (PDF). European_Union. Archived from the original (PDF) on 24 December 2012. Retrieved 2008-02-05.
- International Temperature Scale of 1990 (PDF). Procès-Verbaux du Comité International des Poids et Mesures. 1989. pp. T23–T42. Archived from the original (PDF) on 24 October 2017. Retrieved 25 March 2008.
- Reinsch، J (۱۹۸۰). «The deuterium isotope effect upon the reaction of fatty acyl-CoA dehydrogenase and butyryl-CoA». J. Biol. Chem. ۲۵۵ (۱۹): ۹۰۹۳–۹۷. PMID 7410413. از پارامتر ناشناخته
|coauthors=صرف نظر شد (|author=پیشنهاد میشود) (کمک) - Bergeron، Kenneth D. (۲۰۰۴). «The Death of no-dual-use». Bulletin of the Atomic Scientists. Educational Foundation for Nuclear Science, Inc. ۶۰ (۱): ۱۵. doi:10.2968/060001004. بایگانیشده از اصلی در ۲۵ دسامبر ۲۰۱۲.
- Quigg، Catherine T. (۱۹۸۴). «Tritium Warning». Bulletin of the Atomic Scientists. ۴۰ (۳): ۵۶–۵۷. از پارامتر ناشناخته
|ماه=صرفنظر شد (کمک) - McCarthy, John (1995-12-31). "Hydrogen". Stanford University. Archived from the original on 24 December 2012. Retrieved 2008-03-14.
- "Nuclear Fusion Power". World Nuclear Association. 2007. Archived from the original on 24 December 2012. Retrieved 2008-03-16. Unknown parameter
|month=ignored (help) - "Chapter 13: Nuclear Energy — Fission and Fusion". Energy Story. California Energy Commission. 2006. Archived from the original on 24 December 2012. Retrieved 2008-03-14.
- "DOE Seeks Applicants for Solicitation on the Employment Effects of a Transition to a Hydrogen Economy". Hydrogen Program (Press release). US Department of Energy. 22 March 2006. Archived from the original on 19 July 2011. Retrieved 16 March 2008.
- "Carbon Capture Strategy Could Lead to Emission-Free Cars" (Press release). Georgia Tech. 11 February 2008. Archived from the original on 24 October 2017. Retrieved 16 March 2008.
- Romm، Joseph J. (۲۰۰۴). The Hype About Hydrogen: Fact And Fiction In The Race To Save The Climate (ویراست ۱st). Island Press. شابک ۱-۵۵۹۶۳-۷۰۳-X.
- Le Comber، P. G.؛ Jones، D. I.؛ Spear، W. E. (۱۹۷۷). «Hall effect and impurity conduction in substitutionally doped amorphous silicon». Philosophical Magazine. ۳۵ (۵): ۱۱۷۳–۱۱۸۷. doi:10.1080/14786437708232943. بیبکد:1977PMag...35.1173C. از پارامتر ناشناخته
|unused_data=صرفنظر شد (کمک) - Peacock، P. W.؛ Robertson، J. (۲۰۰۳). «Behavior of hydrogen in high dielectric constant oxide gate insulators». Applied Physics Letters. ۸۳ (۱۰): ۲۰۲۵–۲۰۲۷. doi:10.1063/1.1609245. بیبکد:2003ApPhL..83.2025P. از پارامتر ناشناخته
|unused_data=صرفنظر شد (کمک) - Kilic، Cetin؛ Zunger، Alex (۲۰۰۲). «n-type doping of oxides by hydrogen». Applied Physics Letters. ۸۱ (۱): ۷۳–۷۵. doi:10.1063/1.1482783. بیبکد:2002ApPhL..81...73K. از پارامتر ناشناخته
|unused_data=صرفنظر شد (کمک) - Van de Walle، Chris G. (۲۰۰۰). «Hydrogen as a cause of doping in zinc oxide». Physical Review Letters. ۸۵ (۵): ۱۰۱۲–۱۰۱۵. doi:10.1103/PhysRevLett.85.1012. PMID 10991462. بیبکد:2000PhRvL..85.1012V.
- Janotti، Anderson؛ Van De Walle، CG (۲۰۰۷). «Hydrogen multicentre bonds». Nature Materials. ۶ (۱): ۴۴–۴۷. doi:10.1038/nmat1795. PMID 17143265. بیبکد:2007NatMa...6...44J. از پارامتر ناشناخته
|unused_data=صرفنظر شد (کمک) - سوخت هیدروژن:
- «Contents> سوخت هیدروژن». بایگانیشده از اصلی در ۱۸ مه ۲۰۱۱. دریافتشده در ۳ آوریل ۲۰۱۱.
- Cammack, Richard (2001). Hydrogen as a Fuel: Learning from Nature. Taylor & Francis Ltd. pp. ۲۰۲–۲۰۳. ISBN 0-415-24242-8. Archived from the original on 24 December 2012. Retrieved 19 July 2012. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Kruse, O. (2005). "Improved photobiological H۲ production in engineered green algal cells". The Journal of Biological Chemistry. ۲۸۰ (۴۰): ۳۴۱۷۰–۷. doi:10.1074/jbc.M503840200. PMID 16100118. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Smith, H. O. (2005). "IV.E.6 Hydrogen from Water in a Novel Recombinant Oxygen-Tolerant Cyanobacteria System" (PDF). FY2005 Progress Report. United States Department of Energy. Archived from the original (PDF) on 24 December 2012. Retrieved 2008-02-05. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Williams, Chris (2006-02-24). "Pond life: the future of energy". Science. The Register. Archived from the original on 24 December 2012. Retrieved 2008-03-24.
- "MyChem: Chemical" (PDF). Archived from the original (PDF) on 1 October 2018. Retrieved 1 October 2018.
- Brown, W. J., H. O.; et al. (1997). "Safety Standard for Hydrogen and Hydrogen Systems" (PDF). NASA. Archived from the original (PDF) on 24 December 2012. Retrieved 2008-02-05. Unknown parameter
|coauthors=ignored (|author=suggested) (help); More than one of|نام خانوادگی=and|author=specified (help) - "Hydrogen, refrigerated liquid" (PDF). Praxair, Inc. 2015. Archived from the original (PDF) on 24 October 2017. Retrieved 2016-08-13. Unknown parameter
|month=ignored (help) - «'Bugs' and hydrogen embrittlement». Science News. Washington, D.C. ۱۲۸ (۳): ۴۱. ۱۹۸۵-۰۷-۲۰. doi:10.2307/3970088. جیاستور ۳۹۷۰۰۸۸.
- Hayes, B. "Union Oil Amine Absorber Tower". TWI. Archived from the original on 24 December 2012. Retrieved 29 January 2010.
- "Hydrogen Safety". Humboldt State University. Archived from the original on 24 December 2012. Retrieved 2010-04-14.
| معنای هیدروژن را در ویکیواژه، واژهنامهٔ آزاد، ببینید. |
| در ویکیانبار پروندههایی دربارهٔ هیدروژن موجود است. |
جدول تناوبی بر اساس دوره کشف | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ۱ | ۲ | ۳ | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ | |||||||||||||||||||||||||||||||||||||
| گروه → | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ دوره | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۱ | ۱ H |
۲ He | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۲ | ۳ Li |
۴ Be |
۵ B |
۶ C |
۷ N |
۸ O |
۹ F |
۱۰ Ne | ||||||||||||||||||||||||||||||||||||||||||||||
| ۳ | ۱۱ Na |
۱۲ Mg |
۱۳ Al |
۱۴ Si |
۱۵ P |
۱۶ S |
۱۷ Cl |
۱۸ Ar | ||||||||||||||||||||||||||||||||||||||||||||||
| ۴ | ۱۹ K |
۲۰ Ca |
۲۱ Sc |
۲۲ Ti |
۲۳ V |
۲۴ Cr |
۲۵ Mn |
۲۶ Fe |
۲۷ Co |
۲۸ Ni |
۲۹ Cu |
۳۰ Zn |
۳۱ Ga |
۳۲ Ge |
۳۳ As |
۳۴ Se |
۳۵ Br |
۳۶ Kr | ||||||||||||||||||||||||||||||||||||
| ۵ | ۳۷ Rb |
۳۸ Sr |
۳۹ Y |
۴۰ Zr |
۴۱ Nb |
۴۲ Mo |
۴۳ Tc |
۴۴ Ru |
۴۵ Rh |
۴۶ Pd |
۴۷ Ag |
۴۸ Cd |
۴۹ In |
۵۰ Sn |
۵۱ Sb |
۵۲ Te |
۵۳ I |
۵۴ Xe | ||||||||||||||||||||||||||||||||||||
| ۶ | ۵۵ Cs |
۵۶ Ba |
57 La |
۷۲ Hf |
۷۳ Ta |
۷۴ W |
۷۵ Re |
۷۶ Os |
۷۷ Ir |
۷۸ Pt |
۷۹ Au |
۸۰ Hg |
۸۱ Tl |
۸۲ Pb |
۸۳ Bi |
۸۴ Po |
85 At |
86 Rn | ||||||||||||||||||||||||||||||||||||
| ۷ | ۸۷ Fr |
۸۸ Ra |
۸۹ Ac |
۱۰۴ Rf |
۱۰۵ Db |
۱۰۶ Sg |
۱۰۷ Bh |
۱۰۸ Hs |
۱۰۹ Mt |
۱۱۰ Ds |
۱۱۱ Rg |
۱۱۲ Cn |
۱۱۳ Nh |
۱۱۴ Fl |
۱۱۵ Mc |
۱۱۶ Lv |
۱۱۷ Ts |
۱۱۸ Og | ||||||||||||||||||||||||||||||||||||
| ۵۸ Ce |
۵۹ Pr |
۶۰ Nd |
۶۱ Pm |
۶۲ Sm |
۶۳ Eu |
۶۴ Gd |
۶۵ Tb |
۶۶ Dy |
۶۷ Ho |
۶۸ Er |
۶۹ Tm |
۷۰ Yb |
۷۱ Lu |
|||||||||||||||||||||||||||||||||||||||||
| ۹۰ Th |
۹۱ Pa |
۹۲ U |
۹۳ Np |
۹۴ Pu |
۹۵ Am |
۹۶ Cm |
۹۷ Bk |
۹۸ Cf |
۹۹ Es |
۱۰۰ Fm |
۱۰۱ Md |
۱۰۲ No |
۱۰۳ Lr |
|||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||


