پتاسیم
پتاسیم (Potassium) با نماد شیمیایی K (از واژهٔ kalium در لاتین نو) یک فلز قلیایی است و عدد اتمی آن ۱۹ میباشد. عنصر پتاسیم نرم و به رنگ نقرهای - سفید است در هوا به آسانی اکسید میشود و با آب به شدت واکنش میدهد و تولید گرما میکند و در نتیجه باعث شعلهور شدن هیدروژن و واکنش آن میگردد.
 تکه های پتاسیم (در روغن پارافین ، هر کدام 5 میلی متر) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پتاسیم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | /pəˈtæsiəm/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | نقرهy gray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | ۳۹٫۰۹۸۳(۱)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پتاسیم در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 19 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | 1: هیدروژن و فلزهای قلیایی | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Alkali metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Ar] 4s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2, 8, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 336.53 K (63.38 °C, 146.08 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 1032 K (759 °C, 1398 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | 0.862 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (at m.p.) | 0.828 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه سهگانه | 336.35 K, kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | 2.33 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 76.9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | 29.6 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −1, +1 (a strongly basic اکسید) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 0.82 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع اتمی | empirical: 227 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 203±12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | 275 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Color lines in a spectral range | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | (bcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت thin rod | 2000 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | 83.3 µm/(m·K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 102.5 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | 72 n Ω·m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | paramagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول یانگ | 3.53 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول برشی | 1.3 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول حجمی | 3.1 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی موس | 0.4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی برینل | 0.363 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7440-09-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای پتاسیم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


پیدایش
این عنصر حدوداً ۲٫۴٪ از وزن پوسته زمین را تشکیل میدهد و از نظر فراوانی هفتمین عنصر در آن میباشد. به دست آوردن پتاسیم از کانیها به دلیل خاصیت نامحلولی و ماندگاری آن بسیار دشوار است.
با این وجود، مواد معدنی دیگر مانند Carnallite, Langbeinite, Polyhalite و Sylvite در بستر دریاها یا دریاچههای قدیمی یافت میشوند. مواد معدنی بسیار زیاد تهنشین شده در این برکهها عمل استخراج پتاسیم و نمک آن را اقتصادیتر میکند. منابع مهم پتاسیم و پتاس منابعی در کالیفرنیا، آلمان، نیومکزیکو، یوتا و دیگر نقاط زمین میباشد. در عمق ۳۰۰۰ فوتی زیر بستر Saskatchewan، مقادیر عظیمی از پتاس وجود دارد که میتواند به عنوان یک منبع مهم برای این عنصر در آینده در نظر گرفته شود.
اقیانوسها نیز منابع دیگری برای پتاسیم میباشند، اما در مقایسه با سدیم مقدار پتاسیم موجود در یک حجم معین از آب دریا بسیار کم است. پتاسیم در صورت عمل الکترولیز میتواند به اجزای هیدروکسیدش تجزیه شود. از روشهای حرارتی نیز برای تولید پتاسیم استفاده میشود. پتاسیم هرگز به صورت رها شده در طبیعت یافت نمیشود. با این وجود، یونهای +K در ارگانیسمهای زنده برای فیزیولوژی سلولهای تحریکی بسیار مهم هستند.
خواص
فلز قلیایی نرم با جلای نقره ای؛ سبکوزن؛ در هوای مرطوب بهسرعت اکسیده میشود، از این رو در نفت نگهداری میشود جرم حجمی۰٫۸۷۲؛ نقطه ذوب ۶۳ درجه سانتی گراد؛ نقطه جوش ۷۷۰ درجه سانتی گراد میل ترکیبی آن شدید است، خواص پتاسیم شبیه به سدیم است ولی میل ترکیبی آن شدیدتر است.
طرز تهیه
کانیها و معادن آن در آلمان، نیو مکزیکو، کانادا، کالیفرنیا، اتا، انگلستان، شوروی و مناطق مدیترانه شرقی قرار دارد مهمترین کانیهای آن عبارتاند از کارنالیت؛ سیلویت و پلی هالیت. تقطیر شیمی گرمایی کلرید پتاسیم با سدیم روش اصلی تهیهاست.
درجه خلوص
صنعتی ۹۹٫۹۵ درجه خالص
احتیاط
خطر آتشسوزی؛ با آب واکنش میدهد و این عمل گرمازا است و گرمای حاصل از این عمل پتاسیم را ذوب و پراکنده میکند وهم چنین هیدروژن را آتش میزند؛ خاموش کردن آتشسوزی ناشی از پتاسیم مشکل است؛ برای خاموش کردن آن گرد خشک خاکستر سودا یا گرافیت یا مخلوطهای مخصوصی از مواد شیمیایی خشک پیشنهاد میگردد. میتواند خود به خود در هوای مرطوب آتش بگیرد. در واکنشهای شیمیایی خطر نسبی انفجار به همراه دارد. فلز پتاسیم حتی اگر در زیر روغنهای معدنی انبار شده باشد میتواند در دمای اتاق پراکسید و سوپر اکسید تشکیل دهد؛ وقتی حمل میشود پاره شود ممکن است بهشدت منفجر شود. در جوهای بیاثر ماند آرگون و نیتروژن یا در مایعهایی مانند تولوئن یا کروزن که اکسیژن جذب نمیکنند یا در کپسولهای شیشهای که در خلائ یا جو بیاثر پر میشوند، نگهداری میشوند.
پژوهشها
- در ژانویه ۲۰۱۳ فیزیکدانان ذرات یک گاز کوانتومی بر پایه پتاسیم ساختند. این گاز هنگامی که تحت تأثیر لیزر و میدان مغناطیسی قرار میگیرد به دماهای منفی میرسد. در این دمای ترمودینامیکی، ماده شروع به بروز دادن خواص ناشناخته پیشین میکند.[2][3]
پتاسیم در بدن
پتاسیم یک یون مهم در بدن است، چون تغییرات جزئی آن میتواند action potentials را مختل کند و در نتیجه مشکلات عصبی و قلبی ایجاد میشود، سطح آن در خون بهدقت تنظیم میشود. بسیاری از آنتیبیوتیکها، از جمله آنکه توسط باکتری Bacillus brevis تولید میشود، عملکرد سلولها را با نشستن بر روی کانالهای یون مثبت مختل میکنند. در نتیجه یونهای +k و +Na اجازه پیدا میکنند از غشاء سلولی عبور کنند و بنابراین action potential مختل میشود. پتاسیم در پلاسمای خون نسبتاً در سطح پائینی قرار دارد (معمولاً ۳٫۵ تا ۵٫۰ mmol/L)، ولی درون سلولها تجمع زیادی دارد (در حدود ۱۰0 mmol/L). سطوح پائین آن در خون هیپوکالمی (hypokalemia) و سطوح بالای آن هایپرکالمی (hyperkalemia) نام دارند. هر دو سطح پائین و بالا برای قلب خطرناکند. علائم کمبود آن در بدن شامل موارد زیر است: خستگی، خواب آلودگی، ضعف عضلانی، یبوست، نامنظمی ضربان قلب و تأخیر در تخلیه معدی. بهترین منابع غذایی پتاسیم؛ آرد سویا، لوبیا سفید، عدس، موز و اسفناج میباشد؛ ولی در بیشتر موادغذایی وجود دارد. رژیم غذایی غنی از کلسیم، پتاسیم و منیزیم و نیز محدود در سدیم باعث کاهش فشار خون بالا در افراد دچار فشار خون بالا میشود.
]]کلیهها]] و غدد عرق، هنگامیکه بدن دچار افت پتاسیم میشود، از اتلاف آن جلوگیری کرده و مقدار آن را در حد طبیعی نگه میدارند. به همین دلیل، کمبود پتاسیم بهندرت در ورزشکاران رخ میدهد. نیاز بدن به پتاسیم حتی با ورزش کردن طولانی در هوای گرم، با خوردن یک رژیم معمولی برآورده میشود، چون این عنصر در تمامی موادغذایی به جز شکر تصفیه شده وجود دارد. مصرف داروهایی مثل دیورتیکها و کورتیکواستروئیدها میتوانند باعث کمبود پتاسیم در بدن شوند. همچنین اسهال و تهوع مکرر باعث کمبود آن میشود. در اسهال، پتاسیم بدن از طریق مدفوع و در تهوع از طریق استفراغ دفع میشود. هم در ورزشکاران و هم در افراد عادی، تهوع و استفراغ بیشترین علت کاهش پتاسیم خون و افزایش آن در ادرار میباشد.
پتاسیم در خاک
پتاسیم بهطور معمول فراوانترین عنصر غذایی پر نیاز در ۱۵ سانتیمتری لایه سطحی خاک است. مقدار پتاسیم در خاکهای معدنی۰/۴ تا ۳ درصد یا بیشتر تغییر میکنددر حالی که در خاکهای آلی این مقدار حدود ۰/۰۲ تا ۰/۰۳ درصد است.
اشکال مختلف پتاسیم در خاک
چهار شکل مختلف پتاسیم در خاک به ترتیب سهلالوصول بودن برای گیاهان شامل:پتاسیم محلول، پتاسیم تبادلی، پتاسیم غیر تبادلی (تثبیت شده) و پتاسیم ساختمانی میباشد.
پتاسیم محلول:پتاسیمی است که در محلول خاک به فرم یونی موجود بوده وتنها فرم قابل جذب پتاسیم برای گیاهان است و کاهش ذخیره پتاسیمی خاک در اثر شستشوی عمقی نیز پس از تبدیل سایر شکلهای پتاسیم به این فرم صورت میگیرد.
پتاسیم تبادلی: پتاسیم تبادلی یا پتاسیم جذب سطحی شده روی کلوئیدها و قابل جایگزین با سایر کاتیونها، همانند کاتیونهای تبادلی دیگر به وسیله نیروهای الکترو استاتیک بارهای منفی کلوئیدهای آلی و معدنی خاک نگهداری میشود و تحت شرایطی به آسانی توسط نمکهای خنثی قابل استخراج میباشد.
پتاسیم غیرتبادلی: پتاسیمی است که بهآسانی قابل تبادل نبوده و در زمانهای کوتاه نیز توسط محلولهای نمکی آزاد نمیشود و تاحدودی برای گیاه قابل استفاده است.
پتاسیم ساختمانی: به شکلی از پتاسیم اطلاق میشود که جزئی از شبکه کریستالی کانیها میباشد.
پتاسیم در گیاه
پتاسیم فراوانترین کاتیون موجود در سیتوپلاسم بوده و نمکهای پتاسیم به ایجاد پتانسیل اسمزی مناسب در درون سلولها و بافتهای گیاهان غیر نمک دوست کمک عمدهای میکند.
جذب پتاسیم به وسیله گیاه
جذب پتاسیم به داخل سیتوپلاسم یا واکئولهای سلولهای ریشه از طریق جذب فعال است و نیاز به انرژی دارد. بین غلظت پتاسیم محلول اطراف ریشه و مقدار جذب پتاسیم به وسیلهٔ گیاه رایطه مستقیم وجود دارد.
میزان پتاسیم قابل جذب در خاکهای مختلف معمولاً در حدود ۰/۱ درصد میزان کلسیم قابل جذب میباشد، با این حال مقدار پتاسیم گیاه معمولاً ۱۰ برابر کلسیم میباشد و این نشان میدهد که گیاه قدرت انتخابی شدیدی برای برخی عناصر مورد نیاز خود دارد.
نقش پتاسیم در گیاه
پتاسیم در فیزیولوژی گیاه از قبیل: فعال شدن آنزیمها، ساختن پروتئینها، فتوسنتز، بزرگ شدن سلول، باز و بسته شدن روزنهها وافزایش مقاومت به تنشهای محیطی نقش دارد. همچنین پتاسیم در درختان میوهای بزرگ شدن میوهها را باعث میشود. رنگ نارنجی مرکبات و رنگ قرمز در سیب و هلو تابعی از غلظت پتاسیم در گیاه میباشد.
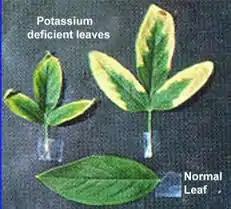
کمبود پتاسیم در گیاهان
کمبود پتاسیم در گیاهان در ابتدا منجر به بروز علائم ظاهری و نشانههای قابل دیدن نمیشود، بلکه ابتدا فقط کاهشی در میزان رشد و عملکرد وجود دارد که به آن اصطلاحاً گرسنگی پنهان گفته میشود و تا زمانی که کمبود پتاسیم شدید نباشد، حتی تا پایان فصل رشد نیز علائم ظاهری همچنان بروز نکرده اما کاهش عملکرددر این شرایط قطعی خواهد بود. به دلیل موبایل بودن این عنصر نشانههای ظاهری کمبود پتاسیم ابتدا بر روی دومین و سومین برگهای پیرتر ظاهر میشود. در پیرترین برگها اغلب زردی و سوختگی از نوک و حاشیه برگها شروع شده و به سمت پهنک توسعه پیدا میکند.[4]
منابع
- Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- "Quantum gas temperature drops below absolute zero". Wired. 4 January 2013. Archived from the original on 24 January 2013. Retrieved 5 February 2013.
- "Quantum gas goes below absolute zero". Nature. 3 January 2013. Retrieved 5 February 2013.
- ملکوتی، محمدجعفر (۱۳۹۵). پتاسیم در کشاورزی (نقش پتاسیم در تولید محصولات کشاورزی سالم). تهران، خیابان دکتربهشتی: انتشارات مبلغان. صص. ۵،۸۲. شابک ۹۷۸-۹۶۴-۲۶۱۴-۹۷-۴.
| در ویکیانبار پروندههایی دربارهٔ پتاسیم موجود است. |
کتاب فرهنگ عناصر نوشته سید رضا آقاپور مقدم
