آنتالپی ذوب
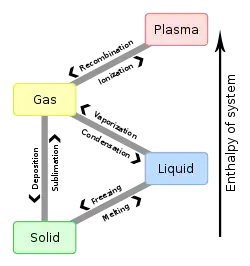
آنتالپی ذوب یا گداز در یک ماده، (به انگلیسی: Enthalpy of fusion)؛ که «گرمای نهان همجوشی» نیز شناخته میشود، پدیدهٔ تغییر در آنتالپی آن، حاصل از ارائهٔ مقدار مشخصی انرژی به ماده؛ معمولاً به صورت گرما، در نتیجهٔ تغییر حالت خود از جامد به مایع، در فشار ثابت است. گرمای انجماد: (زمانی که یک ماده از مایع به جامد تغییر میکند) برابر و در جهت مخالف آن است. مطابق تعریف آنتالپی ذوب برابر است با تغییر آنتالپی به ازای یک مول از مادهٔ جامد که به مایع (یا برعکس) تبدیل میشود.
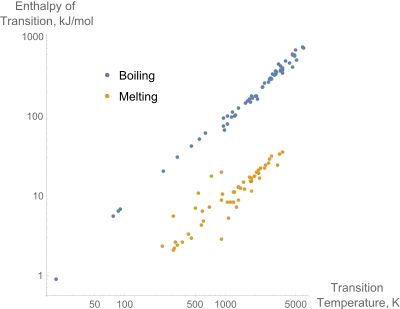
آنتالپیهای ذوب و جوش برای عناصر خالص در مقایسه با دماهای انتقال؛ نمایشگر قانون تروتن
به عنوان مثال، هنگام ذوب شدن ۱ کیلوگرم یخ (در دمای صفر درجه سانتیگراد تحت نمودار فازی آب) (در دمای صفر درجه سانتیگراد |نمودار فازی)، ۳۳۳٫۵۵ کیلوژول انرژی؛ بدون تغییر دما، جذب میشود.
این پدیده در نقطه جوش ماده رخ میدهد. این کمیت با واحد کیلوژول بر مول گزارش میشود.
منابع
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.