نقطه سهگانه
نقطه سهگانه (به انگلیسی: Triple point) عبارتست از دما و فشاری که در آن سه فاز یک ماده با هم در تعادل ترمودینامیکی قرار دارند. بهطور کلی، برای یک ماده با p فاز مختلف؛ نقطه سهگانه وجود دارد.
علاوه بر نقطه سهگانه برای فازهای جامد، مایع و گاز، یک نقطه سهگانه ممکن است بیش از یک فاز جامد را شامل شود، برای مواد دارای چند شکلی چندگانه. هلیوم-۴ یک مورد خاص است که یک نقطه سهگانه را شامل میشود که شامل دو مرحله مختلف سیال است (نقطه لاندا).[1]
از نقطه سهگانه آب برای تعریف کلوین، واحد پایه دمای ترمودینامیکی در سیستم بینالمللی واحدها (SI) استفاده شدهاست.[2] مقدار نقطه سهگانه آب به جای اندازهگیری، با تعریف تعیین شد، اما با تعریف مجدد ۲۰۱۹ واحدهای پایه SI تغییر یافت. از نقاط سهگانه چندین ماده برای تعریف نقاط در مقیاس بینالمللی دمای ITS-90 استفاده میشود، از نقطه سهگانه هیدروژن (۱۳٫۸۰۳۳K) تا نقطه سهگانه آب (۲۷۳٫۱۶ K یا ۰٫۰۱ درجه سانتیگراد یا ۳۲٫۰۱۸ درجه فارنهایت).
اصطلاح «نقطه سهگانه» در سال ۱۸۷۳ توسط جیمز تامسون، برادر لرد کلوین ابداع شد.[3]
نقطه سهگانه آب
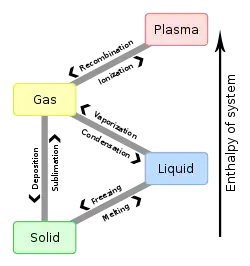
نقطه سهگانه مایع - گاز - جامد
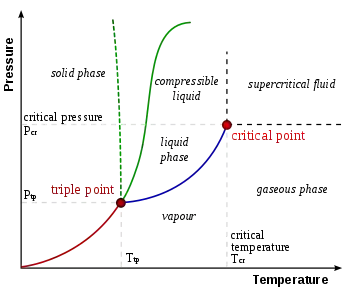
فقط ترکیب واحدی از فشار و دما وجود دارد که در آن آب مایع، یخ جامد و بخار آب میتوانند در یک تعادل پایدار در دمای تقریباً ۲۷۳٫۱۵۷۵ کلوین (معادل ۰٫۰۱ درجه سانتی گراد یا ۳۲٫۰۱۳۵ درجه فارنهایت) و فشار بخار جزئی ۶۱۱٫۶۵۷ پاسکال (۶٫۱۱۶۵۷ میلی بار یا ۰٫۰۰۶۰۳۶۵۹ اتمسفر) وجود داشته باشند.[4][5] در آن مرحله، میتوان با ایجاد تغییرات دلخواه کوچک در فشار و دما، همه مواد را به یخ، آب یا بخار تغییر داد. حتی اگر فشار کل یک سیستم کاملاً بالاتر از نقطه سهگانه آب باشد، به شرطی که فشار جزئی بخار آب ۶۱۱٫۶۵۷ پاسکال باشد، باز هم میتوان سیستم را به نقطه سهگانه آب رساند. بهطور دقیق، سطوح جدا کننده مراحل مختلف نیز باید کاملاً صاف باشند تا اثرات کشش سطحی را نفی کنند.
نقطه سهگانه گاز - مایع - جامد با حداقل فشاری که میتواند آب مایع در آن وجود داشته باشد مطابقت دارد. در فشارهای زیر نقطه سهگانه (مانند فضای بیرونی)، یخ جامد هنگامی که با فشار ثابت گرم میشود مستقیماً به بخار آب تبدیل میشود در فرآیندی که به عنوان تصعید شناخته میشود. بالاتر از نقطه سهگانه، یخ جامد با گرم شدن در فشار ثابت ابتدا ذوب میشود و آب مایع تشکیل میشود و سپس بخار میشود یا میجوشد و در دمای بالاتر بخار تشکیل میشود.
برای بیشتر مواد، نقطه سهگانه گاز-مایع-جامد نیز حداقل دمایی است که مایع میتواند در آن وجود داشته باشد. برای آب اما این درست نیست زیرا نقطه ذوب یخهای معمولی به عنوان تابعی از فشار کاهش مییابد، همانطور که توسط خط سبز تیره در نمودار فاز نشان داده شدهاست. در دماهای دقیقاً زیر نقطه سه برابر، فشرده سازی در دمای ثابت بخار آب را ابتدا به جامد و سپس به مایع تبدیل میکند (یخ آب دارای تراکم کمتری نسبت به آب مایع است، بنابراین افزایش فشار منجر به مایع شدن میشود).
فشار نقطه سهگانه آب در هنگام مأموریت مارینر ۹ به مریخ به عنوان نقطه مرجع برای تعریف سطح دریا استفاده شد. مأموریتهای اخیر به جای فشار از ارتفاع سنجی و اندازهگیری گرانش لیزر برای تعریف ارتفاع در مریخ استفاده میکنند.[6]
فازهای فشار بالا
در فشارهای بالا، آب دارای یک نمودار فازی پیچیده با ۱۵ مرحله شناخته شده یخ و چندین نقطه سهگانه است، از جمله ۱۰ تایی که مختصات آن در نمودار نشان داده شدهاست. به عنوان مثال، نقطه سهگانه در ۲۵۱ کلوین (معادل -۲۲ درجه سانتی گراد) مطابق با شرایط همزیستی یخ معمولی، یخ III و آب مایع، همه در تعادل است. همچنین برای همزیستی سه مرحله جامد، نقاط سهگانه وجود دارد، به عنوان مثال یخ II، یخ V و یخ VI در ۲۱۸ کلوین (یا −۵۵ درجه سانتی گراد)) و ۶۲۰ مگاپاسکال (معادل ۶۱۲۰ اتمسفر).

نقطه سهگانه چند ماده
| ماده | T [کلوین] (سلسیوس) | p [پاسکال]* |
|---|---|---|
| استیلن | ۱۹۲٫۴ کلوین (−۸۰٫۷ درجه سلسیوس) | ۱۲۰ کیلوپاسکال (۱٫۲ اتمسفر استاندارد) |
| آمونیاک | ۱۹۵٫۴۰ کلوین (−۷۷٫۷۵ درجه سلسیوس) | ۶٫۰۷۶ کیلوپاسکال (۰٫۰۵۹۹۷ اتمسفر استاندارد) |
| آرگون | ۸۳٫۸۱ کلوین (−۱۸۹٫۳۴ درجه سلسیوس) | ۶۸٫۹ کیلوپاسکال (۰٫۶۸۰ اتمسفر استاندارد) |
| آرسنیک | ۱٬۰۹۰ کلوین (۸۲۰ درجه سلسیوس) | ۳٬۶۲۸ کیلوپاسکال (۳۵٫۸۱ اتمسفر استاندارد) |
| بوتان (هیدروکربن)[7] | ۱۳۴٫۶ کلوین (−۱۳۸٫۶ درجه سلسیوس) | ۷× 10−4 kPa |
| Carbon (گرافیت) | ۴٬۷۶۵ کلوین (۴٬۴۹۲ درجه سلسیوس) | ۱۰٬۱۳۲ کیلوپاسکال (۱۰۰٫۰۰ اتمسفر استاندارد) |
| کربن دیاکسید | ۲۱۶٫۵۵ کلوین (−۵۶٫۶۰ درجه سلسیوس) | ۵۱۷ کیلوپاسکال (۵٫۱۰ اتمسفر استاندارد) |
| کربن مونوکسید | ۶۸٫۱۰ کلوین (−۲۰۵٫۰۵ درجه سلسیوس) | ۱۵٫۳۷ کیلوپاسکال (۰٫۱۵۱۷ اتمسفر استاندارد) |
| کلروفرم[8] | ۱۷۵٫۴۳ کلوین (−۹۷٫۷۲ درجه سلسیوس) | ۰٫۸۷۰ کیلوپاسکال (۰٫۰۰۸۵۹ اتمسفر استاندارد) |
| دوتریوم | ۱۸٫۶۳ کلوین (−۲۵۴٫۵۲ درجه سلسیوس) | ۱۷٫۱ کیلوپاسکال (۰٫۱۶۹ اتمسفر استاندارد) |
| اتان | ۸۹٫۸۹ کلوین (−۱۸۳٫۲۶ درجه سلسیوس) | ۸ × 10−4 kPa |
| اتانول[9] | ۱۵۰ کلوین (−۱۲۳ درجه سلسیوس) | ۴٫۳ × 10−7 kPa |
| اتیلن | ۱۰۴٫۰ کلوین (−۱۶۹٫۲ درجه سلسیوس) | ۰٫۱۲ کیلوپاسکال (۰٫۰۰۱۲ اتمسفر استاندارد) |
| فرومیک اسید[10] | ۲۸۱٫۴۰ کلوین (۸٫۲۵ درجه سلسیوس) | ۲٫۲ کیلوپاسکال (۰٫۰۲۲ اتمسفر استاندارد) |
| هلیم-۴ (نقطه لاندا) | ۲٫۱۹ کلوین (−۲۷۰٫۹۶ درجه سلسیوس) | ۵٫۱ کیلوپاسکال (۰٫۰۵۰ اتمسفر استاندارد) |
| هگزاافلوئورواتان[11] | ۱۷۳٫۰۸ کلوین (−۱۰۰٫۰۷ درجه سلسیوس) | ۲۶٫۶۰ کیلوپاسکال (۰٫۲۶۲۵ اتمسفر استاندارد) |
| هیدروژن | ۱۳٫۸۴ کلوین (−۲۵۹٫۳۱ درجه سلسیوس) | ۷٫۰۴ کیلوپاسکال (۰٫۰۶۹۵ اتمسفر استاندارد) |
| هیدروژن کلرید | ۱۵۸٫۹۶ کلوین (−۱۱۴٫۱۹ درجه سلسیوس) | ۱۳٫۹ کیلوپاسکال (۰٫۱۳۷ اتمسفر استاندارد) |
| ید[12] | ۳۸۶٫۶۵ کلوین (۱۱۳٫۵۰ درجه سلسیوس) | ۱۲٫۰۷ کیلوپاسکال (۰٫۱۱۹۱ اتمسفر استاندارد) |
| Isobutane[13] | ۱۱۳٫۵۵ کلوین (−۱۵۹٫۶۰ درجه سلسیوس) | ۱٫۹۴۸۱ × 10−5 kPa |
| جیوه | ۲۳۴٫۲ کلوین (−۳۹٫۰ درجه سلسیوس) | ۱٫۶۵ × 10−7 kPa |
| متان | ۹۰٫۶۸ کلوین (−۱۸۲٫۴۷ درجه سلسیوس) | ۱۱٫۷ کیلوپاسکال (۰٫۱۱۵ اتمسفر استاندارد) |
| نئون | ۲۴٫۵۷ کلوین (−۲۴۸٫۵۸ درجه سلسیوس) | ۴۳٫۲ کیلوپاسکال (۰٫۴۲۶ اتمسفر استاندارد) |
| نیتریک اکسید | ۱۰۹٫۵۰ کلوین (−۱۶۳٫۶۵ درجه سلسیوس) | ۲۱٫۹۲ کیلوپاسکال (۰٫۲۱۶۳ اتمسفر استاندارد) |
| نیتروژن | ۶۳٫۱۸ کلوین (−۲۰۹٫۹۷ درجه سلسیوس) | ۱۲٫۶ کیلوپاسکال (۰٫۱۲۴ اتمسفر استاندارد) |
| دی نیتروژن مونوکسید | ۱۸۲٫۳۴ کلوین (−۹۰٫۸۱ درجه سلسیوس) | ۸۷٫۸۵ کیلوپاسکال (۰٫۸۶۷۰ اتمسفر استاندارد) |
| اکسیژن | ۵۴٫۳۶ کلوین (−۲۱۸٫۷۹ درجه سلسیوس) | ۰٫۱۵۲ کیلوپاسکال (۰٫۰۰۱۵۰ اتمسفر استاندارد) |
| پالادیم | ۱٬۸۲۵ کلوین (۱٬۵۵۲ درجه سلسیوس) | ۳٫۵ × 10−3 kPa |
| پلاتین | ۲٬۰۴۵ کلوین (۱٬۷۷۲ درجه سلسیوس) | ۲٫۰ × 10−4 kPa |
| گوگرد دیاکسید | ۱۹۷٫۶۹ کلوین (−۷۵٫۴۶ درجه سلسیوس) | ۱٫۶۷ کیلوپاسکال (۰٫۰۱۶۵ اتمسفر استاندارد) |
| تیتانیم | ۱٬۹۴۱ کلوین (۱٬۶۶۸ درجه سلسیوس) | ۵٫۳ × 10−3 kPa |
| هگزافلوراید اورانیوم | ۳۳۷٫۱۷ کلوین (۶۴٫۰۲ درجه سلسیوس) | ۱۵۱٫۷ کیلوپاسکال (۱٫۴۹۷ اتمسفر استاندارد) |
| آب | ۲۷۳٫۱۶ کلوین (۰٫۰۱ درجه سلسیوس) | ۰٫۶۱۱۷ کیلوپاسکال (۰٫۰۰۶۰۳۷ اتمسفر استاندارد) |
| زنون (عنصر) | ۱۶۱٫۳ کلوین (−۱۱۱٫۸ درجه سلسیوس) | ۸۱٫۵ کیلوپاسکال (۰٫۸۰۴ اتمسفر استاندارد) |
| روی | ۶۹۲٫۶۵ کلوین (۴۱۹٫۵۰ درجه سلسیوس) | ۰٫۰۶۵ کیلوپاسکال (۰٫۰۰۰۶۴ اتمسفر استاندارد) |
منابع
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (1994) "Triple point"..
- Definition of the kelvin بایگانیشده در ۱۶ ژوئیه ۲۰۱۲ توسط Wayback Machine at BIPM.
- James Thomson (1873) "A quantitative investigation of certain relations between the gaseous, the liquid, and the solid states of water-substance", Proceedings of the Royal Society, 22: 27–36. From a footnote on page 28: " … the three curves would meet or cross each other in one point, which I have called the triple point".
- International Equations for the Pressure along the Melting and along the Sublimation Curve of Ordinary Water Substance. W. Wagner, A. Saul and A. Pruss (1994), J. Phys. Chem. Ref. Data, 23, 515.
- Murphy, D. M. (2005). "Review of the vapour pressures of ice and supercooled water for atmospheric applications". Quarterly Journal of the Royal Meteorological Society. 131 (608): 1539–1565. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94.
- Carr, Michael H. (2007). The Surface of Mars. Cambridge University Press. p. 5. ISBN 978-0-521-87201-0.
- See Butane (data page)
- See Chloroform (data page)
- See Ethanol (data page)
- See Formic acid (data page)
- See Hexafluoroethane (data page)
- Walas, S. M. (1990). Chemical Process Equipment – Selection and Design. Amsterdam: Elsevier. p. 639. ISBN 0-7506-7510-1.
- See Isobutane (data page)
- IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8.