گوگرد دیاکسید
گوگرد دیاکسید یک ترکیب شیمیایی به شکل گاز در دمای اتاق با فرمول شیمیایی SO2 میباشد. این ماده توسط آتشفشانها و بسیاری از فعالیتهای صنعتی تولید میشود. سوختن نفت و زغال سنگ به علت وجود ترکیبات گوگردی در آنها با تولید این گاز همراه است. معمولاً کاتالیزگرهایی چون NO2 در جو باعث واکنش این گاز با بخار آب موجود در هوا و تشکیل اسید سولفوریک میشود. این گاز بیرنگ سمی دارای جرم مولی ۶۴٫۰۷ گرم بر مول، چگالی 1٫۵۵۱ گرم بر لیتر، نقطهٔ ذوب ۷۵٫۵- درجهٔ سانتی گراد و نقطهٔ جوش ۱۰٫۰- درجهٔ سانتی گراد است و اشتعال زا نیست.
| گوگرد دیاکسید | |
|---|---|
 | |
 | |
Sulfur dioxide | |
دیگر نامها Sulfurous anhydride | |
| شناساگرها | |
| شماره ثبت سیایاس | ۷۴۴۶-۰۹-۵ |
| پابکم | ۱۱۱۹ |
| کماسپایدر | ۱۰۸۷ |
| UNII | 0UZA3422Q4 |
| شمارهٔ ئیسی | 231-195-2 |
| شمارهٔ یواِن | 1079 2037 |
| KEGG | D05961 |
| MeSH | Sulfur+dioxide |
| ChEBI | CHEBI:18422 |
| ChEMBL | CHEMBL۱۲۳۵۹۹۷ |
| شمارهٔ آرتیئیسیاس | WS4550000 |
مرجع بیلشتین |
3535237 |
مرجع جیملین |
1443 |
| جیمول-تصاویر سه بعدی | Image 1 |
SMILES
| |
| |
| خصوصیات | |
| فرمول مولکولی | SO 2 |
| جرم مولی | 64.066 g mol-1 |
| شکل ظاهری | Colorless gas |
| چگالی | 2.6288 kg m-3 |
| دمای ذوب | −۷۲ درجه سلسیوس؛ −۹۸ درجه فارنهایت؛ ۲۰۱ کلوین |
| دمای جوش | −۱۰ درجه سلسیوس (۱۴ درجه فارنهایت؛ ۲۶۳ کلوین) |
| انحلالپذیری در آب | 94 g dm-3[1] |
| فشار بخار | 237.2 kPa |
| اسیدی (pKa) | 1.81 |
| خاصیت بازی (pKb) | 12.19 |
| گرانروی | 0.403 cP (at 0 °C) |
| ساختار | |
| گروه فضایی | C2v |
| Digonal | |
| شکل مولکولی | Dihedral |
| گشتاور دوقطبی | 1.62 D |
| ترموشیمی | |
آنتروپی مولار استاندارد S |
248.223 J K-1 mol-1 |
آنتالپی استاندارد تشکیل ΔfH |
-296.81 kJ mol-1 |
| خطرات | |
| شاخص ئییو | ۰۱۶-۰۱۱-۰۰-۹ |
| طبقهبندی ئییو | |
| کدهای ایمنی | R۲۳, R۳۴, R50 |
| شمارههای نگهداری | (S1/2), S۹, S26, S36/37/39, S45 |
| لوزی آتش | Error: imagemap_invalid_title |
| LD50 | 3000 ppm (30 min inhaled, mouse) |
| ترکیبات مرتبط | |
| مرتبط با گوگرد اکسیدs | مونواکسید گوگرد تریاکسید سولفور |
| ترکیبات مرتبط | ازن سلنیوم دیاکسید سولفورو اسید دیاکسید تلوریم |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
ساختمان
مولکول گوگرد دیاکسید یک مولکول دارای ساختار رزونانسی میباشد. رزونانس این مولکول بین دو پیوند S-O میباشد و سه ساختار رزونانسی آن در شکل نشان داده شدهاند. طول پیوند S-O در مولکول سولفور دیاکسید (۱۴۳٫۱ پیکومتر) از طول پیوند S-O سولفور مونو اکسید(۱۴۸٫۱ پیکومتر) کوتاهتر است. به این معنی که انرژی این پیوند در مولکول SO2 بیشتر است و دانشمندان به این دلیل به وجود ساختار رزونانسی این مولکول پی بردهاند.
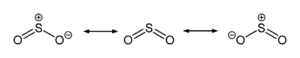
واکنشها
گوگرد دیاکسید به راحتی با مواد قلیایی واکنش میدهد و نمکهای سولفیت را به وجود میآورد
- SO2 + 2 NaOH → Na2SO3 + H2O
همچنین این ماده با هالوژنها واکنش میدهد و نمکهای هالیدی را به وجود میآورد.
- SO2 + Cl2 → SO2Cl2
ساخت
این ماده با سوختن گوگرد ایجاد میشود.
- S8 + 8 O2 → 8 SO2
هیدروژن سولفید و ترکیبات زیست کره هم مانند گوگرد حین سوختن گوگرد دیاکسید تولید میکنند.
- 2 H2S + 3 O2 → 2 H2O + 2 SO2
گرمادهی به کانیهای سولفیدی نیز این گاز را آزاد میکند.
- 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
- 2 ZnS + 3 O2 → 2 ZnO + 2 SO2
- HgS + O2 → Hg + SO2
این گاز فراورده جانبی ساخت کلسیم سیلیکات (در فرایند ساخت سیمان) است. در این فرایند کلسیم سولفات همراه با شن و کُک گرمادهی میشود.
- 2 CaSO4 + 2 SiO2 + C → 2 CaSiO3 + 2 SO2 + CO2
با استفاده از سدیم متا بی سولفات
- H2SO4 + Na2S2O5 → 2 SO2 + Na2SO4 + H2O
استفادهها
سولفوریک اسید
این گاز در ساخت سولفوریک اسید استفاده میشود. برای این کار ابتدا آن را به گوگرد تریاکسید تبدیل میکنند.
نگه دارنده
این گاز در برخی مواقع به عنوان نگه دارندهٔ مواد خشک به ویژه میوههای خشک استفاده میشود. چرا که ظاهر میوه را خوب حفظ میکند.
منابع
| در ویکیانبار پروندههایی دربارهٔ گوگرد دیاکسید موجود است. |
- Lide, David R., ed. (2006). هندبوک شیمی و فیزیک سی آر سی (87th ed.). Boca Raton, FL: انتشارات سیآرسی. ISBN 0-8493-0487-3.

