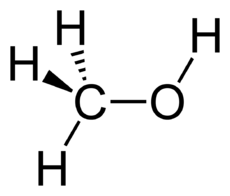
متانول
متانول، متیل الکل، الکل متیلیک، کاربینول یا الکل چوب که سادهترین نوع الکلهاست با فرمول شیمیایی CH۳OH شناخته میشود. متانول از فعالیت بیهوازی گونههای زیادی از باکتریها تولید میشود و در نتیجه مقدار اندکی از بخار متانول وارد جو میشود و پس از چندین روز بهوسیله اکسیژن و با کمک نور خورشید اکسید شده به آب و دیاکسید کربن تبدیل میگردد. البته در فرایند سوختن متانول هم از نظر مواد بدست آمده چنین اتفاقی رخ میدهد ولی بسیار سریعتر. در ضمن شعله سوختن متانول بیرنگ است و باید مراقب بود تا شعله آن سبب سوختگی نشود.با این حال متانول به مراتب سمی تر از اتانول است. با تولید بیش از 20 میلیون تن در سال ، از آن به عنوان پیش ماده دیگر مواد شیمیایی کالایی از جمله فرمالدئید ، اسید استیک ، متیل ترت بوتیل اتر و همچنین میزبان مواد شیمیایی تخصصی تر استفاده می شود.
| متانول | |||
|---|---|---|---|
| |||
| |||
دیگر نامها Hydroxymethane | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۶۷-۵۶-۱ | ||
| پابکم | ۸۸۷ | ||
| کماسپایدر | ۸۶۴ | ||
| UNII | Y4S76JWI15 | ||
| شمارهٔ ئیسی | 200-659-6 | ||
| شمارهٔ یواِن | 1230 | ||
| KEGG | D02309 | ||
| MeSH | Methanol | ||
| ChEBI | CHEBI:17790 | ||
| ChEMBL | CHEMBL۱۴۶۸۸ | ||
| شمارهٔ آرتیئیسیاس | PC1400000 | ||
مرجع بیلشتین |
1098229 | ||
مرجع جیملین |
449 | ||
| 3DMet | B01170 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
SMILES
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | C۱H۴O۱ | ||
| جرم مولی | ۳۲٫۰۴ g mol−1 | ||
| شکل ظاهری | Colorless liquid | ||
| چگالی | 0.7918 g cm-3 | ||
| دمای جوش | ۶۵ درجه سلسیوس (۱۴۹ درجه فارنهایت؛ ۳۳۸ کلوین) | ||
| log P | -0.69 | ||
| فشار بخار | 13.02 kPa (at 20 °C) | ||
| اسیدی (pKa) | 15.5[2] | ||
| گرانروی | 5.9×10-4 Pa s (at 20 °C) | ||
| گشتاور دوقطبی | 1.69 D | ||
| خطرات[3] | |||
| شاخص ئییو | 603-001-00-X | ||
| طبقهبندی ئییو | |||
| کدهای ایمنی | R۱۱, R23/24/25, R39/23/24/25 | ||
| شمارههای نگهداری | (S1/2), S۷, S۱۶, S36/37, S45 | ||
| لوزی آتش | Error: imagemap_invalid_title | ||
| نقطه اشتعال | |||
| دمای خودآتشگیری | |||
| محدودیتهای انفجار | ۳۶٪ | ||
| ترکیبات مرتبط | |||
| ترکیبات مرتبط | متانتیول سیلانول | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
2C۲H۵OH+7O۲→4CO۲+6H۲O سوختن اتانول
۲CH۳OH + 3 O۲ → ۲ CO۲ + ۴ H۲O
در سال ۱۹۲۳ شیمیدان آلمانی، «ماتیاس پیِر»، متانول را از گاز سنتز (مخلوطی از CO و H۲ که از کُک به دست میآید) تولید کرد. در این فرایند، از کروماتِ روی به عنوان کاتالیزور استفاده میشد و واکنش در شرایط سختی مانند فشار ۱۰۰۰–۳۰۰ اتمسفر و دمای حدود ۴۰۰ درجه سانتیگراد انجام میگرفت. در شیوهٔ مدرنِ تولید متانول، از کاتالیزورهایی استفاده میشود که در فشارهای پایین عمل میکنند و کارایی مؤثرتری دارند.
امروزه گاز سنتز مورد نظر برای تولید متانول مانند گذشته از زغال به دست نمیآید، بلکه از واکنش متان موجود در گازهای طبیعی تحت فشار ملایم ۱۰–۲۰ اتمسفر و دمای ۸۵۰ درجه سانتیگراد با بخار آب و در مجاورت کاتالیزور نیکل تولید میشود. CO و H۲ تولید شده، تحت تأثیر کاتالیزوری که مخلوطی از مس و اکسید روی و آلومینیوم است، واکنش داده، متانول ایجاد میکنند. این کاتالیزور نخستین بار در سال ۱۹۶۶ توسط ICI استفاده شد. این واکنش در فشار ۵۰–۱۰۰ اتمسفر و دمای ۲۵۰ درجه سانتیگراد صورت میگیرد.
روش دیگر تولید متانول، واکنش دیاکسیدکربن با هیدروژن اضافی است که تولید متانول و آب میکند.
کاربرد
بهعنوان ضدیخ، حلال و سوخت بکار برده میشود. از متانول برای تقلیب اتانول نیز استفاده میشود، این عمل به منظور غیرقابل شرب نمودن اتانولی که برای مصارف صنعتی تولید میشود انجام میپذیرد (در کشورهای اسلامی به جهت مسائل شرعی و در کشورهای دیگر به جهت معافیت از مالیات فروش مواد مستکننده) بدین منظور از مواد دیگری چون پریدین و تربانتین نیز استفاده میشود.
متانول به صورت محدود به عنوان سوخت در موتورهایی با سیستم احتراق داخلی استفاده میشود. متانول تولید شده از چوب و سایر ترکیبات آلی را متانول آلی یا بیو الکل مینامند که یک منبع تجدید شدنی برای سوخت است و میتواند جایگزین مشتقات نفت خام شود. با این همه، از بیو الکل ۱۰۰ درصد نمیتوان در ماشینهای دیزلی بدون ایجاد تغییر در موتور ماشین استفاده کرد. متانول به عنوان حلال، ضدیخ و در تهیه سایر ترکیبات شیمیایی استفاده میشود.
۴۰ درصد از متانول تولیدی برای تهیه فرمالدئید استفاده میشود که آن هم در تهیه پلاستیک، تخته سه لایی، رنگ و مواد منفجره استفاده میشود. برای تغییر ماهیت اتانول صنعتی و جلوگیری از کاربرد آن به عنوان نوشیدنی، مقداری متانول به آن اضافه میکنند. دی متیل اتر از مشتقات متانول است که به جای CFCها در افشانههای آتروسل به عنوان پیشرانه استفاده میشود. همچنین از متانول در تهیه استیک اسید و متیل ترشیو بوتیل اتر نیز استفاده میشود.
شناسایی خطرات
متانول اثرات مخربی بر روی بینائی داشته و از راه پوست جذب میشود. فوقالعاده قابل احتراق بوده اما در دمای محیط آتش نمیگیرد. بین متانول و فلزاتی از قبیل پتاسیم، منیزیم، اکسیدکنندههایی مثل پرکلرات باریم، برومین کلرین، پراکسید هیدروژن و سدیم در صورت وجود حرارت خاصیت انفجاری ایجاد میکند متانول با کلروفرم، دی اتیل روی، کلریدسیانوریک و نیتریک اسید شدیداً واکنش میدهد. در صورت تجزیه حرارتی متانول به دی اکسیدکربن (CO2,CO) و فرمالدئید تولید میشود.
نکات ایمنی
متانول مادهای سمی است و نوشیدن آن موجب نابینایی و حتی مرگ میشود. هنگام استفاده از متانول باید از ماسک و دستکش استفاده کرد چون از طریق تنفس و پوست وآشامیدن نیز میتواند جذب شود.
اقدامات اورژانسی
پس از مسمومیت با متانول باید سریعاً الکل اتانول به صورت وریدی یا خوراکی برای بیمار شروع ودیالیز انجام شود.
منابع
- "Methanol". The PubChemProject. USA: National Center for Biotechnology Information.
- Ballinger, P.; Long, F.A. (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds". J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- "The Emergency Response Safety and Health Database: Systematic Agent: METHANOL". Centers for Disease Control and Prevention. Retrieved 26 August 2009.
pharmacology vetrinary azad karaj <javadtakdehghan> ویکیپدیای انگلیسی http://daneshnameh.roshd.ir/mavara/mavara-index.php?page=متانول&SSOReturnPage=Check&Rand=0
| در ویکیانبار پروندههایی دربارهٔ متانول موجود است. |