اتیلن
اتیلن یا اتن، سادهترین هیدروکربن غیر اشباع بوده و اولین عضو از گروه آلکنها است. فرمول شیمیایی آن C2H4 بوده، بین دو اتم کربن پیوند دوگانه وجود دارد. به دلیل وجود این پیوند دوگانه، اتیلن ایزومر صورتبندی ندارد، یعنی دو نیمه مولکول نمیتوانند با چرخش حول پیوند دوگانه، صورتبندی خود را تغییر دهند.
| اتیلن | |||
|---|---|---|---|
 | |||
| |||
Ethene | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۷۴-۸۵-۱ | ||
| پابکم | ۶۳۲۵ | ||
| کماسپایدر | ۶۰۸۵ | ||
| UNII | 91GW059KN7 | ||
| EC-number | 200-815-3 | ||
| KEGG | C06547 | ||
| ChEBI | CHEBI:18153 | ||
| ChEMBL | CHEMBL۱۱۷۸۲۲ | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
SMILES
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | C 2H 4 | ||
| جرم مولی | 28.05 g/mol | ||
| شکل ظاهری | colorless gas | ||
| چگالی | 1.178 kg/m3 at 15 °C gas[1] | ||
| دمای ذوب | −۱۶۹٫۲ °C (104.0 K, -272.6 °F) | ||
| دمای جوش | −۱۰۳٫۷ °C (169.5 K, -154.7 °F) | ||
| انحلالپذیری در آب | 3.5 mg/100 mL (17 °C) ; 2.9 mg/L[2] | ||
| انحلالپذیری در ethanol | 4.22 mg/L[2] | ||
| انحلالپذیری در diethyl ether | good[2] | ||
| اسیدی (pKa) | 44 | ||
| ساختار | |||
| شکل مولکولی | D2h | ||
| گشتاور دوقطبی | zero | ||
| ترموشیمی | |||
آنتروپی مولار استاندارد S |
219.32 J K-1·mol-1 | ||
آنتالپی استاندارد تشکیل ΔfH |
+52.47 kJ/mol | ||
| خطرات | |||
| طبقهبندی ئییو | Extremely flammable (F+) | ||
| لوزی آتش | Error: imagemap_invalid_title | ||
| نقطه اشتعال | |||
| دمای خودآتشگیری | |||
| ترکیبات مرتبط | |||
| ترکیبات مرتبط | اتان استیلن | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
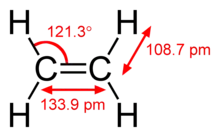
اتیلن دارای ساختمان مسطح بوده، زاویه بین دو اتصال کربن-هیدروژن، ۱۱۷ درجه است. یعنی مقداری بستهتر از زاویه ۱۲۰ درجه که برای هیبریداسیون sp2 مناسب است. اتیلن گازی بیرنگ و آتشگیر بهشمار میرود و در ترکیب نفت و گاز طبیعی یافت میشود.
تاریخچه
در سال ۱۷۹۵، اتیلن را گاز اولفین مینامیدند. اولین سنتز ترکیبات اتیلن (دی کلرو اتان) در سال ۱۷۹۵ توسط شیمیدان هلندی انجام شد. در اواسط قرن ۱۹ به علت اینکه C2H4 یک هیدروژن از C2H5 اتیل کم داشت، پسوندهای ene (از ریشه یونانی) به آخر اتیل اضافه کرده و از آن به بعد گاز اولفین را اتیلن مینامند. تا سال ۱۸۵۲ در متون علمی واژه اتیلن استفاده میشد.
در سال ۱۸۶۶ «هافمن» شیمیدان آلمانی، سیستم نامگذاری هیدروکربنها را بر پایه آلکان بنا نهاد. در این سیستم، هر هیدروکربنی که از آلکان مربوطه دو هیدروژن کمتر داشت، آلکن با فرمول CnH2n و اگر چهار هیدروژن از آلکان مربوطه کم داشت آلکین CnH2n-2 نامیده میشود. طبق این نامگذاری، اتیلن به اتن تغییر نام یافت. انجمن بینالمللی شیمیدانها در سال ۱۸۹۲ این نام را وارد نامگذاری آیوپاک کردند و از آن تاریخ تا امروز، این نام در متون علمی و کتابهای درسی و … مورد استفاده قرار میگیرد. جرم مولکولی این ترکیب ۰۵/۲۸گرم بر مول و چگالی آن ۲۶/۱ گرم بر لیتر است. قابلیت انحلال آن 250mL در یک لیتر آب صفر درجه است. نقطه ذوب آن °41.04K و نقطه جوش آن °169.4K و حد انفجارش ۲٫۷ تا ۳۶٪ در هواست.
روشهای تولید
اتیلن در صنایع پتروشیمی با روش کراکینگ با بخار آب تولید میشود. در این فرایند هیدروکربنهای گازی و محلولهای سبک هیدروکربن حاصل از نفت به مدت بسیار کوتاه در دمای ۹۵۰–۷۵۰ درجه سانتیگراد حرارت داده میشوند. عموماً در این واکنش هیدروکربنهای بزرگ به هیدروکربنهای کوچک شکسته شده، هیدروکربنهای اشباع با ازدستدادن هیدروژن به هیدروکربنهای غیر اشباع تبدیل میشوند.
محصول این واکنش مخلوطی از انواع هیدروکربنهاست که اتیلن عمدهترین آن است. مخلوط را بهوسیله متراکمسازی و تقطیر جز به جز جداسازی میکنند. روشهای دیگر، هیدروژندارکردن استیلن با استفاده از کاتالیزور و آبگیری از اتانول است.
واکنشهای شیمیایی مربوطه
آلکنها بهعلت داشتن پیوند دوگانه در واکنشهای افزایشی شرکت میکنند. هالوژنها با اتیلن واکنش داده و تولید هالو اتان میکند. با افزودن آب به پیوند دوگانه اتانول تولید میشود، اما سرعت واکنش بدون حضور کاتالیزگر پایین است. در حضور کاتالیزگرهای فلزی نظیر پلاتین، نیکل و … و فشار بالا، اتیلن، هیدروژندار شده، به اتان تبدیل میشود. اتیلن در حضور پراسیدها به اتواکسید که یک ترکیب حلقوی است تبدیل میشود. اتیلن در حضور رادیکالهایی که واکنش بسپارش را آغاز میکنند، به پلیاتیلن پلیمریزه میشود.
کاربردها
اتیلن ماده اولیه مهم برای تولید بسیاری از ترکیبات آلی پرمصرف در صنعت بهشمار میرود. اتیلن به صورت گسترده در صنعت پلاستیک مورد استفاده قرار میگیرد. اتیلن با پلیمریزه شدن، پلیاتیلن را تولید میکند که یک پلاستیک بسیار مهم است. با تکرار شدن، پیش ماده پلیوینیل کلرید (PVC) را تولید میکند. با ترکیب شدن، بنزن، اتیلبنزن ایجاد میکند که ماده اصلی پلیاستر است.
اتیلن، نوعی هورمون گیاهی است که باعث رسیدن میوهها، بازشدن شکوفهها و گلها و همچنین ریزش برگها در پاییز میشود. به دلیل این ویژگی در کشاورزی مورد استفاده قرار میگیرد. برای جلوگیری از خرابشدن میوههایی مانند سیب، گلابی و موز، در ترابری یا انبار، آنها را کمی نارس میچینند و پیش از وارد کردن به بازار، تحت تأثیر اتیلن قرار میدهند تا رسیده شود.
نحوه شناسایی
اتیلن، رنگ قهوهای محلول برم در تتراکلرید کربن را بیرنگ میکند و رنگ بنفش محلول سرد و رقیق پرمنگنات پتاسیم را از بین میبرد و در نتیجه واکنش رسوبات قهوهای MnO2 حاصل میشود. در اسید سولفوریک سردو غلیظ حل میشود.
منابع
- الگو:GESTIS ZVG 12710
- Нейланд О. Я. Органическая химия: Учебник для хим. спец. вузов. — Москва: Высшая школа, 1990. — с. 128
| در ویکیانبار پروندههایی دربارهٔ اتیلن موجود است. |