آلکان
آلکانها، (به انگلیسی: Alkane)یا پارافینها (به انگلیسی: Paraffin) هیدروکربنهایی هستند که در آنها هر اتم کربن با ۴ پیوند کووالانسی به ۴ اتم هیدروژن یا کربن میچسبد. در واقع پیوند دو یا سهگانه بین اتمهای کربن وجود ندارد؛ بنابراین آلکانها گروهی از هیدروکربنهای آلیفاتیک هستند. فرمول کلی آلکانها CnH2n+2 است. یک سری ترکیب که در آنها هر عضو نسبت به عضو بعدی در مقدار ثابتی تفاوت داشته باشد، سری همولوگ مینامند و اعضای این سری، همولوگ خوانده میشود. خانواده آلکانها چنین سری همولوگی را تشکیل میدهند و اختلاف ثابت و پیاپی آن CH2 میباشد.
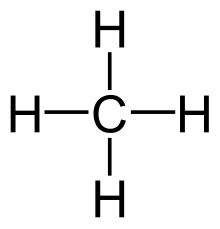
سادهترین آلکان، متان (CH۴) است که بخش عمدهٔ گاز طبیعی را تشکیل میدهد. اتان (C2H۶)، پروپان (C3H۸) و بوتان (C4H۱۰) دیگر آلکانهای گازی هستند. پنتان (C5H۱۲)، هگزان (C6H۱۴)، هپتان (C7H۱۶) و اوکتان (C8H۱۸) مهمترین آلکانهای مایع هستند. نامگذاری آلکانها را آیوپاک (مجمع بینالمللی شیمی محض و کاربردی) به عهده دارد.
ویژگیهای ساختاری آلکانها
همهٔ آلکانها، گازها، مایعها یا جامدهایی بیرنگ هستند که با افزایش تعداد کربن نقطه جوش و گرانروی (گرانروی یک مایع، میزان عدم تمایل آن را برای جاری شدن معین میکند) آنها افزایش مییابد. همهٔ آلکانها در هوا با شعله زرد – آبی تمیزی میسوزند.
اتم کربن این امکان را دارد که با به اشتراک گذاشتن چهار الکترون لایه ظرفیتی خود با سایر اتمها چهار پیوند کووالانسی ایجاد کند. اگر تمامی کربنهای یک ترکیب در تشکیل پیوند کووالانسی از هیبریداسیون sp3 استفاده کرده باشند آن ترکیب آلکان نامیده میشود (اوربیتالهای sp3 از اختلاط یک اوربیتال s و سه اوربیتال p تشکیل شدهاند). فرمول عمومی آلکانها CnH2n+2 میباشد که n نمایشگر تعداد اتم کربن است. در این ترکیبها پیوند C–C یگانه بوده، طول پیوند C– A°C 53/1، طول پیوند H– C A°۰۹/۱، زاویه پیوند در آنها ۱۰۹/۵درجه است و اطراف هر اتم کربن، دارای ساختار چهاروجهی میباشد. ساختار چهاروجهی به اوربیتالها اجازه میدهد تا حد امکان از یکدیگر فاصله بگیرند. برای اینکه همپوشانی این اوربیتالها با اوربیتال کروی اتم هیدروژن به گونهای مؤثر صورت پذیرد و در نتیجه پیوند محکمتری تشکیل شود، هر هسته هیدروژن باید در یک گوشه این چهار وجهی قرار بگیرد. آلکانها از نظر ساختاری، ترکیبهایی منظم هستند که این امر باعث شده ثابتهای فیزیکی، یک روند قابل پیشبینی داشته باشند.
متان (CH4) گازی بیبو و بیرنگ، نامحلول در آب، نفوذپذیرتر و سبکتر از هواست و اولین ترکیب از سری هیدروکربنهای اشباع شدهاست. همچنین این ترکیب یک گاز گلخانهای است و به عنوان سوخت نیز بکار میرود. شکل هندسی آن به صورت یک چهاروجهی کامل بوده و هر یک از چهار اتم هیدروژن به وسیلهٔ پیوند کووالانسی، یعنی با یک جفت الکترون اشتراکی به اتم کربن متصل شدهاند. هیبریداسیون کربن نیز sp3 میباشد. عضو بعدی خانواده آلکانها، اتان (C2H6) میباشد. هر کربن به سه هیدروژن و یک کربن دیگر متصل است و چون هر اتم به چهار اتم دیگر متصل است، اوربیتالهای پیوندی آن (اوربیتالهای sp3) به سوی گوشهای چهاروجهی جهت گرفتهاند. پیوند C–C از همپوشانی دو اوربیتال sp3 کربنهای مجاور نتیجه شدهاست.
سیکلوبوتان (C4H8) و سیکلوهگزان (C6H12)، دو مثال از ترکیبهای پر حجم وسنگین وستبر و محکم و مقاوم سیکلوآلکانی میباشند. فرمول کلی سیکلوآلکانها CnH2n میباشد. با معلوم بودن تعداد اتم کربن در یک آلکان یا سیکلوآلکان میتوان فرمول مولکولی ترکیب را بدست آورد. برای مثال، چون هگزان ۶ اتم کربن دارد پس تعداد هیدروژنهای آن، ۱۴=۲+(۶×۲)، بوده و فرمول مولکولی آن C6H14 میباشد. سیکلوهگزان با داشتن ۶ اتم کربن، ۱۲ اتم هیدروژن (۱۲=۶×۲) خواهد داشت و فرمول مولکولی آن C6H12 میباشد.
آلکانها فاقد گروه عاملی هستند و در نتیجه خواص شیمیایی آنها با سایر ترکیبهای آلی متفاوت میباشد. این ترکیبها در واقع ترکیبهای مادر در شیمی آلی محسوب میشوند و از لحاظ سنتز و نامگذاری سایر ترکیبهای آلی بسیار مهم میباشند.
ایزومری در آلکانها
آلکانها میتوانند راستزنجیر یا شاخهدار باشند. آلکان راست زنجیر به آلکانی میگویند که در ساختار آلکان همه اتمهای کربن به یک یا دو اتم کربن دیگر متصل باشند. معمولاً کلمه نرمال در ابتدا یا انتهای نام آلکان راست زنجیر گفته میشود. آلکان شاخه دار به آلکانی گفته میشود که در ساختار آن حداقل یک اتم کربن به ۳ یا ۴ اتم کربن دیگر متصل باشد. ترکیباتی که فرمول مولکولی یکسان دارند اما آرایش اتمی و فرمول ساختاری و خواص فیزیکی و شیمیایی متفاوت دارند را نسبت به هم، هم پار یا ایزومر مینامند. آلکانهایی که چهار یا تعداد بیش تری اتم کربن داشته باشند دارای ایزومر هستند. تعداد ایزومرها برای آلکانها به ترتیب به شرح زیر است: ۱ -۱ - ۱ - ۲ - ۳ - ۵ - ۹ - ۱۸ - ۳۵ - ۷۵ - ۱۵۹ - ۳۵۵ - ۸۰۲ - ۱۸۵۸ - ۴۳۴۷ - ۱۰۳۵۹ - ۲۴۸۹۴ - ۶۰۵۲۳ و…
جالب است بدانید که تا به حال هیچ فرمول ریاضی کلی برای محاسبهٔ تعداد ایزومرهای یک آلکان پیدا نشدهاست. اما فرمول زیر برای یافتن تعداد ایزومرهای آلکانهایی است که دارای ۴ تا ۷ کربن هستند.
خواص فیزیکی آلکانها
خواص فیزیکی آلکانها از همان الگوی خواص فیزیکی متان پیروی میکند و با ساختار آلکانها سازگار است.
قطبیت
یک مولکول آلکان فقط بهوسیله پیوندهای کووالانسی برپا نگه داشته شدهاست. این پیوندها یا دو اتم از یک نوع را بهم متصل میکنند و در نتیجه، غیر قطبیاند، یا دو اتم را که تفاوت الکترونگاتیوی آنها بسیار کم است، به یکدیگر ربط میدهند و در نتیجه قطبیت آنها کم است. به علاوه، این پیوندها به طریقی بسیار متقارن جهت گرفتهاند، بهطوری که این قطبیهای پیوندی نیز یکدیگر را خنثی میکنند. در نتیجه یک مولکول آلکان یا غیر قطبی است یا قطبیت بسیار ضعیفی دارد. نیروهایی که مولکولهای غیر قطبی را گرد هم نگه میدارند (نیروهای واندروالسی) ضعیف هستند و گستره بسیار محدودی دارند. این نیروها فقط بین بخشهایی از مولکولهای مختلف که با یکدیگر در تماس نزدیک باشند، یعنی بین سطوح مولکولها، عمل میکنند؛ بنابراین در یک خانواده معین، انتظار داریم که هر اندازه مولکول بزرگتر شود در نتیجه سطح تماس آنها بیشتر و نیروهای بین مولکولی نیز قویتر شوند.
نقطهٔ ذوب و جوش
دمای جوش و ذوب با افزایش شمار اتمهای کربن، زیاد میشود. فرایند جوشیدن و ذوب شدن، مستلزم فایق آمدن بر نیروهای بین مولکولی در یک مایع و یک جامد است. دمای جوش و دمای ذوب بالا میرود، زیرا این نیروهای بین مولکولی با بزرگ شدن مولکولها افزایش مییابند. آلکانهای چهار کربنه یا کمتر به صورت گاز، اغلب آلکانهای پنج تا هفده کربنه به صورت مایع و آلکانهای ۱۸ کربنه به بالا جامد میباشند و در نفت خام به وفور یافت میشوند.
نقطه جوش یک ترکیب به نیروهای جاذبه بین مولکولی بستگی دارد. قدرت این نیروها عبارتند از مقدار انرژی مورد نیاز جهت تبدیل یک مولکول از حالت مایع به حالت گاز. هرچه این نیروها قویتر باشند نقطه جوش ترکیب بالاتر خواهد بود؛ بنابراین به علت ضعیف بودن نیروهای بین مولکولی در آلکانها نقطه جوش آنها نسبت به ترکیبهای هم جرم پایینتر میباشد؛ ولی هرچه تعداد کربنها و هیدروژنها زیادتر میشوند، نقطه جوش آنها بالاتر میرود. با اضافه شدن هر گروه CH2 نقطه جوش نرمال آلکان حدود ۳۰–۲۰ درجه سانتیگراد افزایش میابد. وجود انشعاب موجب پایین آمدن نقطه جوش میشود، چون ممانعت فضایی مانعی در برابر نیروهای جاذبه بین مولکولی است (با شاخه دار شدن، شکل مولکول به حالت کرهای نزدیک میشود و سطح تماس کاهش مییابد). نقطه ذوب آلکانها با افزایش جرم آنها افزایش مییابد. آلکانهایی که تعداد کربن زوج دارند نقطه ذوب بالاتری دارند چون ساختار بلوری آنها مرتب تر بوده و بهتر میتوانند در همدیگر فشرده شوند.
انحلالپذیری
طبق قاعده «شبیه، شبیه را حل میکند» آلکانها در حلالهای غیرقطبی مانند بنزن، اتر و کلروفرم حل میشوند و در آب و سایر حلالهای قطبی نامحلولند. هر چه نیروی جاذبه بین حلال و ترکیب زیادتر باشد و گروههای عاملی مشابه داشته باشند قابلیت انحلال بیشتر میشود. درصورتیکه آلکانها را به عنوان حلال در نظر بگیریم، آلکانهای مایع ترکیبهای کم قطبی را در خود حل کرده و ترکیبهای خیلی قطبی را حل نمیکنند.
چگالی
با افزایش اندازه آلکانها، دانسیته نسبی زیاد میشود اما مقدار آن حدود ۰/۵ تا ۰/۸ میباشد؛ بنابراین تمام آلکانها دانسیته کمتری از آب دارند. تعجبی ندارد که تقریباً تمام ترکیبهای آلی دانسیته کمتری از آب دارند زیرا مانند آلکانها بهطور عمده از کربن و هیدروژن تشکیل شدهاند.
واکنشهای آلکانها
آلکانها و سیکلوآلکانها در مقایسه با ترکیبهای آلی که دارای گروه عاملی میباشند، ترکیبهای غیرفعالی هستند. برای مثال اغلب ترکیبهای آلی با اسیدهای قوی، بازهای قوی، اکسیدکنندهها یا احیاکنندهها واکنش میدهند. اما آلکانها و سیکلوآلکانها در این شرایط هیچگونه واکنشی نمیدهند، به این دلیل به آلکانها پارافین میگویند (در لاتین پارافین یعنی میل ترکیبی کم). برخی از واکنشهای معمول آلکانها در ادامه معرفی شدهاست.
سوختن آلکانها
واکنش هیدروکربنها و به ویژه آلکانها با اکسیژن و تولید دیاکسیدکربن، آب و گرما، از جمله مهمترین واکنشهای آلکانهاست. این واکنش فوقالعاده گرماده است. سوختن کامل منجر به تولید آب و دی اکسیدکربن میشود. در صورت عدم وجود اکسیژن کافی سوختن ناقص انجام شده و تولید کربن منواکسید یا کربن به شکل دوده مینماید.
کراکینگ و هیدروکراکینگ
تجزیه یک ترکیب به وسیلهٔ گرما را پیرولیز (گرماکافت) مینامند که از نظر شیمیدانها گسستن بر اثر گرما معنی میدهد. پیرولیز آلکانها به ویژه وقتی با نفت سروکار داریم، کراکینگ نامیده میشود. در کراکینگ گرمایی، آلکانها را بهطور ساده درون اتاقی که تا دمای بالا گرم شده، عبور میدهند. بدین طریق میتوان آلکانهای بزرگ را به آلکانهای کوچکتر و مقدار کمی هیدروژن تبدیل کرد. در روشی دیگر که در واقع اصلاح شده روش فوق میباشد هیدروکربن را با مقداری بخارآب رقیق میکنند و به مدت کوتاهی (کسری از ثانیه) ۷۰۰ تا ۹۰۰ درجه سانتیگراد حرارت میدهند و به سرعت سرد میکنند. این روش را کراکینگ گرمایی با بخار آب مینامند که در تولید برخی مواد شیمیایی از جمله اتیلن، پروپیلن، ایزوپرن و... اهمیت فراوان دارد.
حالا اگر در این تجزیه هیدروژن از هیدروکربن کاسته شود و یک هیدروکربن و هیدروژن داشته باشیم.
این عمل هیدرو کراکینگ میباشد.
واکنش با هالوژنها
مولکولهای آلکان با هالوژنها واکنش میدهند و طی یک واکنش جانشینی، برخی اتمهای هالوژن به جای اتمهای هیدروژن قرار میگیرند و هالوآلکانها را میسازند.
منابع
شیمی آلی؛ موریسون و بوید؛ ویرایش ششم؛ فصل ۲ و ۳
| در ویکیانبار پروندههایی دربارهٔ آلکان موجود است. |
