اتر
اتر نامی است که به ترکیبهای شیمیایی که گروه اتری دارند گفته میشود. این گروه یک اکسیژن است که از دو سو به دو گروه آلکیل پیوند دارد.
ویژگیهای فیزیکی
- نمیتوانند بین خودشان پیوند هیدروژنی داشته باشند.
- دمای جوششان نسبت به کتونها و آلدهیدها و کربوکسیلیک اسیدها پایین است.
- اترها باز لوییس هستند.
نامگذاری اترها
روش معمولی نامگذاری اترها به شکل آلکوکسی آلکان است. برای نمونه:(اتوکسیاتان، CH۳-CH۲-O-CH۲-CH۳). هر چند که روش کمکاربردتری نیز برای نامگذاری اترها هست که در آن نخست نام دو گروه آلکیلی که با اکسیژن پیوند دارند آمده و سپس نام اتر میآید. اتر نامبرده در روش دوم دیاتیل اتر نامگذاری میشود.
طرز تهیه اترها
از واکنش الکلهای نوع اول در محیط اسیدی میتوان اتر تولید کرد. البته اتر تولید شده متقارن خواهد بود. بهطور مثال دیاتیلاتر با گرم کردن مخلوطی از اتیلالکل و اسیدسولفوریک تا ۱۴۰ درجه سانتیگراد بهدست میآید. این واکنش با خروج دائمی آب از محیط و افزایش تدریجی اما مداوم الکل همراه است تا نسبت واکنشدهندهها تقریباً ثابت باقی ¬بماند. سنتز اتر به روش ویلیامسون بهدلیل تنوعپذیری آن، بسیار مهم و کاربردی است و میتوان آن را برای سنتز اترهای متقارن و نامتقارن بهکار برد. در سنتز اتر ویلیامسون، اتر از واکنش هستهدوستی سدیمآلکوکسید با آلکیلهالید بدست میآید. آلکوکسیدها هستهدوستهای بسیار خوبی هستند و معمولاً از واکنش سدیمهیدرید (NaH) با الکل در حلال قطبی غیرپروتونی مانند DMSO، تهیه میشوند.
اترهای نوع اول، دوم و سوم
اترها بسته به گروه کربنی که به اکسیژن آنها پیوند داشته باشد در این سه گروه جای میگیرند. در اینجا از هر نوع یک نمونه آورده شدهاست. یک اتر نوع اول: دیاتیل اترCH۳-CH۲-O-CH۲-CH۳. یکاتر نوع دوم:دیایزوپروپیل اتر (CH۳)۲CH-O-CH(CH۳)۲ و یک اتر نوع سوم: دیترسیوبوتیل اتر (CH۳)۳C-O-C(CH۳)۳.
![]()
![]()
![]()
![]()
دیمتیل اتر، یک اتر نوع اول، نوع دوم، نوع سوم
چند اتر معروف
- اتیلن اکسید، کوچکترین اتر حلقوی:
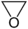
- دیمتیل اتر: یک افشانهٔ آئروسل منفجره:

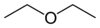
- دیاتیل اتر: یک حلکنندهٔ پرکاربرد با دمای جوش پایین:
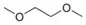
- دیمتیلوکسی اتان، یک حلکننده با دمای جوش بالا:
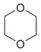
- دیاکسان، یک اتر حلقوی که حلکنندهای با دمای جوش بالاست.
جستارهای وابسته
منابع
Wikipedia contributors, "ether", Wikipedia, The Free Encyclopedia, http://en.wikipedia.org/wiki/Ehter (accessed 111:10 ب. ظ 2006/09/08)
