تیول (شیمی)
تیول (/ˈθaɪɒl/) یا مشتق تیولی ، ترکیب آلی گوگرد داری است که به شکل (R-SH) باشد، R نشان دهنده یک آلکیل یا استخلافهای آلی دیگر بوده و گروه عاملی SH- خود یک گروه تیول یا یک گروه سولفانیل درنظر گرفته می شود. تیولها مشابه الکلها هستند (چرا که اتم گوگرد بجای یک اتم اکسیژن در گروه هیدروکسیل یک الکل قرار گرفته است). بسیاری از تیولها بوی قوی مشابه سیر و یا تخم مرغ گندیده دارند. تیولها بعنوان ترکیبات معطر جهت کمک به تشخیص گاز طبیعی (که در حالت خالص بی بو هستند) بکار گرفته می شوند که منجر به خفگی نشود. بوی گاز طبیعی در اصل بخاطر بوی تیول موجود بعنوان ترکیب معطر می باشد. پیشتر به تیولها، مرکاپتان نیز میگفتهاند. عبارت مرکاپتان برای اولین بار در سال 1832 توسط ویلیام کریستوفر زایس مطرح و ریشه لاتین دارد. بدلیل اینکه گروه تیولات (-RS) قویا با ترکیبات جیوه پیوند می دهد.
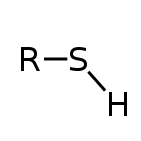
ساختار و پیوند
تیولهای با ساختار (R-SH)، بعنوان آلکان تیولها یا آلکیل تیولها ذکر شده اند، که در آن گروه آلکیل (R) به گروه سولفانیل (SH) متصل شده است. همانطور که پیش تر آورده شد، تیولها و الکلها، وجه اشتراک دارند. بخاطر اینکه گوگرد یک عنصر بزرگتر از اکسیژن است، طول پیوند های گوگرد-هیدروژن، غالبا حدود 180 پیکومتر (نزدیک 40 پیکومتر طویلتر از پیوند معمول کربن-اکسیژن) می باشد. زوایای کربن-گوگرد-هیدروژن به 90 درجه خواهد رسید. در حالتهای جامد و مایع، پیوند هیدروژنی بین گروه های جداگانه تیول ضعیف است، تاثیرگذارترین نیرو، برهمکنشهای واندروالسی میان مراکز گوگردی دوقطبی-دوقطبی می باشد. پیوند گوگرد-هیدروژن بسیار ضعیفتر از پیوند کربن-اکسیژن می باشد، همانگونه که در انرژی تفکیک پیوند (BDE) بازتاب شده است. بعنوان مثال: انرژی تفکیک پیوند برای متان تیول یا متیل مرکاپتان (CH3S-H)، مقدار 366kJ/mol بوده، درحالیکه برای متانول (CH3O-H)، مقدار 440kJ/mol می باشد. بعلت تفاوت مقداری ناچیز الکترونگاتیوی گوگرد و هیدروژن، یک پیوند S-H نسبتا قطبی است. در تضاد، پیوندهای کربن-اکسیژن در گروههای هیدروکسیلی بیشتر قطبی اند. تیولها گشتاور قطبیت نسبی کوچکتری در مقایسه با الکلهای هم رده مذکور دارند.
نامگذاری
راه های متعددی برای نامگذاری آلکیل تیولها وجود دارد:
1) پسوند -تیول به نام آلکان اضافه می شود. این روش تقریبا یکسان با نامگذاری یک الکل بوده و توسط آیوپاک (IUPAC) استفاده شده است. برای نمونه: CH3SH، متان تیول می باشد.
2) کلمه مرکاپتان با الکل ،به نام ترکیب الکلی هم ارز، جابجا می شود. مثال: CH3SH متیل مرکاپتان می شود، همانگونه که CH3OH متیل الکل نامیده می شود.
3) عبارت سولفانیل- یا مرکاپتو- بعنوان یک پیشوند بکار گرفته شده است، مانند: مرکاپتوپورین.
خصوصیات فیزیکی
نقطه جوش و انحلال پذیری
تیولها تمایل ناچیزی به پیوند هیدروژنی دارند، چه با مولکولهای آب و چه میان خودشان. بنابراین، آنها نقطه جوش پایین تری و به همین ترتیب، حلالیت کمتری در آب و دیگر حلالهای قطبی تر از الکلهای با وزن مولکولی مشابه دارند. برای همین، تیولها و گروه های عاملی سولفیدی ایزومری متناظرشان، انحلال پذیری و نقاط جوش مشابهی دارند، درحالیکه مورد مذکور برای الکلها و اتر های ایزومری متناظر صادق نیست.
پیوند
پیوند گوگرد-هیدروژن در تیولها ضعیف است، در مقایسه با پیوند اکسیژن-هیدروژن در الکلها. برای مثال: آنتالپی پیوند برای CH3X-H، برابر 365.07kcal/mol برای X=S و 440.2kcal/mol برای X=O. خروج اتم هیدروژن از ترکیب، باعث پدید آمدن رادیکال تییل با فرمول .RS، که R می تواند آلکیل یا آریل باشد، می شود.
ویژگی های ساختاری در روش های دستگاهی
تیولهای فرار به آسانی بواسطه بوی آنها قابل تشخیص می باشند. آنالیزور های تنظیم شده گوگرد در کروماتوگرافی گازی بسیار کارآمد می باشند. مثلا نشانگرهای اسپکتروسکوپی به تبادل سیگنال هیدروژن در تیول با ایزوتوپ سنگینتر آن، دوتریم (D در آب سنگین D2O)، در طیف NMR (ایزوتوپ دیگر گوگرد، 33S، در طیف NMR فعال است و سیگنال می دهد اما سیگنالها برای گوگرد دو پیوندی معمولا بسیار پهن می باشند.) در طیف سنجی H-NMR، تغییر مکان شیمیایی پیوند گوگرد-هیدروژن در محدوده 2-3 پی پی ام (ppm)، پدید می آید. در طیف سنجی IR ، فرکانس جذب نزدیکای 2400cm-1 ظاهر خواهد شد.
آماده سازی (تهیه)
- در صنعت، متان تیول بوسیله واکنش هیدروژن سولفید (H2S) با متانول تهیه می شود. این روش در اختیار گرفته می شود برای سنتز صنعتی متان تیول :
CH3OH + H2S → CH3SH + H2O
این چنین واکنشها در حضور کاتالیزورهای اسیدی انجام می گیرند. روش اصلی دیگری برای تهیه تیولها، که شامل اضافه کردن هیدروژن سولفید به آلکن بوده، معمولا در مجاورت کاتالیزورهای اسیدی، همانند روش قبل، وجود دارد.
- روش دیگر شامل آلکیل دار کردن سدیم هیدروسولفید می باشد:
RX + NaSH → RSH + NaX (X = Cl, Br, I)
این روش برای تهیه تیوگلیکونیک اسید از کلرواستیک اسید بکار گرفته می شود.
- عموما، در مقیاس آزمایشگاهی، واکنش مستقیم آلکیل هالید با سدیم هیدروسولفید نامطلوب می باشد، بدلیل اینکه واکنش رقابتی تشکیل سولفید همزمان اتفاق خواهد افتاد. بنابراین بهتر است تا تیول را به مشتق آلی گوگردی دیگر، مانند تیوآمید تبدیل نماییم. آلکیل هالید در اثر واکنش با تیوآمید، می تواند تیول را به عنوان فرآورده به ما دهد، که واکنشی چندمرحله، یک طرفه و بهمراه تشکیل نمک حدواسط ایزوتیواورونیوم می باشد.
- CH3CH2Br + SC(NH2)2 → [CH3CH2SC(NH2)2]Br
- [CH3CH2SC(NH2)2]Br + NaOH → CH3CH2SH + OC(NH2)2 + NaBr
تیواوره ، به عنوان یک تیوآمید، بخوبی با هالیدهای اصلی، مخصوصا آنهایی که فعال هستند، واکنش می دهد. تیولهای نوع دوم و سوم، همانند نوع اول، به آسانی تشکیل نمی شوند.
- ترکیب های آلی لیتیمی و واکنشگر های گرینیارد با گوگرد واکنش می دهند تا تیولات تشکیل شده بتواند تیول را همراه نمک فلز فعال بعنوان فرآورده دهد:
- RLi + S → RSLi
- RSLi + HCl → RSH + LiCl
واکنشها
مشابه شیمی الکلها، تیولها سولفیدها، تیواستالها و تیواسترها را تشکیل می دهند، که مشابه اترها، استالها و استرها بترتیب هستند. تیولها و الکلها از لحاظ واکنش پذیری با هم بسیار متفاوت اند، تیولها راحت تر از الکلها اکسید می شوند. تیولات ها نوکلئوفیل های بالقوه بهتری از آلکوکسیدها می باشند.
ُُآلکیل دار کردن گوگردی
تیولها، یا به نحوی دقیق تر باز مزدوج آنها، به آسانی آلکیل دار می شوند تا سولفیدها را دهند:
RSH + R′Br + B → RSR′ + [HB]Br (B = base)
خاصیت اسیدی بودن
تیولها راحت پروتون خود را از دست می دهند. نسبت به الکلها، تیولها اسیدی ترند. باز مزدوج یک تیول، تیولات نامیده می شود. بوتان تیول دارای pKa = 10.5، در مقابل مقدار 15 برای بوتانول. اسیدی ترین تیول شناخته شده، پنتافلوئوروتیوفنول با فرمول (C6F5SH) می باشد، با pKa = 2.68. بنابراین، تیولاتها می توانند از تیولها بوسیله واکنش دادن با هیدروکسید فلزات قلیایی بدست آیند:
منابع
- (Mercaptans (or Thiols) at The Periodic Table of Videos (University of Nottingham
- Applications, Properties, and Synthesis of ω-Functionalized n-Alkanethiols and Disulfides – the Building Blocks of Self-Assembled Monolayers by D. Witt, R. Klajn, P. Barski, B.A. Grzybowski at Northwestern University
- Mercaptan, by The Columbia Electronic Encyclopedia
- What is Mercaptan?, by Columbia Gas of Pennsylvania and Maryland
- What Is the Worst Smelling Chemical? , by About Chemistry
ویکیپدیای انگلیسی http://en.wikipedia.org/w/index.php?title=Thiol&action=edit
| در ویکیانبار پروندههایی دربارهٔ تیول (شیمی) موجود است. |
