قطبیت شیمیایی
قطبیت شیمیایی(به انگلیسی: Chemical polarity) مفهومیست در علم شیمی که بر اساس آن مولکولها از دیدگاه بار الکتریکی به دو دسته قطبی و غیر قطبی تقسیمبندی میشوند. در مولکولهای قطبی مانند آب، نسبت پراکنش الکترونها در اطراف مولکول نامتوازن است، در نتیجه قسمتی از مولکول بار مثبت و قسمتی دیگر بار منفی به خود میگیرد. در نقطه مقابل ترکیبات غیر قطبی قرار دارند که در آنها پراکنش الکترونها یکنواخت میباشد، در نتیجه مولکول از نظر بار الکتریکی خنثی است. هیدروکربنها نمونه مهمی از این نوع مواد هستند.
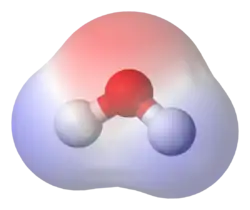
قطبیت در مولکولها:
الف) مولکول دو اتمی:
۱)جور هسته: پیوند ناقطبی، مولکولهای ناقطبی
مثال:
Cl-Cl
O=O
H-H
۲)ناجور هسته: پیوند قطبی، مولکول قطبی
مثال:
H-I
H-Cl
N=O
ب) مولکول چند اتمی:
۱) قطبی: اتم مرکزی حداقل یکی از شرایط زیر را دارا باشد:
یک) اتم جانبی متفاوت
دو) اتم مرکزی دارای جفت ناپیوندی
مثال:
CHCl3
NH3
H2O
H2S
CH2O
۲) ناقطبی:
اتم مرکزی دارای هیچیک از شرایط ذکر شده در بالا نباشد.
مثال:
O=C=O CO2
CH4
CCl4
CS2
قطبیت شیمیائی یکی از سه ویژگی اصلی پیوندهای شیمیایی است؛ دو ویژگی دیگر استحکام پیوند (به انگلیسی: Bond strength) و طول پیوند (به انگلیسی: (Bond length) هستند[1]
نگارخانه
منابع
- /chemical-bonding/43416/The-polarity-of-moleculesChemical bonding, ENCYLOPEDIA BRITANNICA http://www.britannica.com/EBchecked/topic/684121
- مورتیمر، چارلز (۱۳۸۳). شیمی عمومی ۱. اول. تهران: نشر علوم دانشگاهی. شابک ۹۶۴۶۱۸۶۳۳۵.
اصول شیمی عمومی مارتین سیلبرگ شیمی عمومی بروس ادواردبرستن