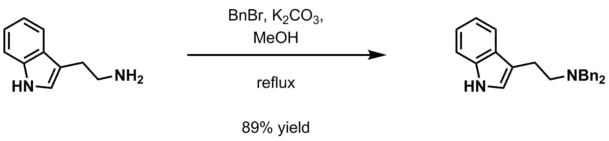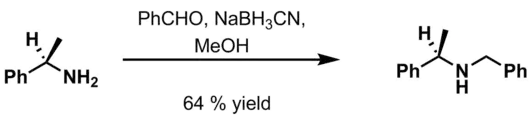گروه بنزیل
در شیمی آلی گروه بنزیل عبارت است از استخلاف یا جزء مولکولی دارای ساختار C6H5CH2– بنزیل ارائه دهندهٔ یک حلقهٔ بنزن متصل به یک گروه CH2 است.[1]
واکنشپذیری هستههای بنزیلی
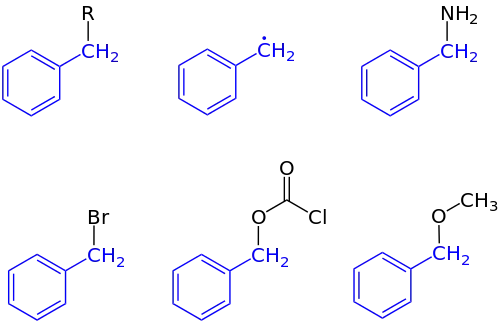
در بحث واکنش پذیری، پیوندهای C-H در بنزیلیک دارای انرژی تفکیک پیوند کم است. به ویژه پیوندهای C-H در C6H5CH2−H نزدیک به ۱۰ تا ۱۵ درصد ضعیف تر از دیگر انواع پیوند C-H است. در جدول زیر پیوند C-H در بنزیلیک را با مقاومت پیوندهای C-H مرتبط مقایسه شده است:
| پیوند | پیوند | انرژی تفکیک پیوند | توضیح | |
|---|---|---|---|---|
| (kcal/mol) | (kJ/mol) | |||
| C6H5CH2−H | پیوند C−H در بنزیلیک | ۹۰ | ۳۷۷ | همانند پیوند C−H در آلیلیک، این پیوندها واکنشپذیری را نشان میدهد. |
| H3C−H | پیوند C-H متیل | ۱۰۵ | ۴۳۹ | یکی از قویترین پیوندهای C-H آلیفاتیک |
| C2H5−H | پیوند C-H اتیل | ۱۰۱ | ۴۲۳ | کمی ضعیف تر از H3C−H |
| C6H5−H | پیوند C-H فنیل | ۱۱۳ | ۴۷۳ | قابل مقایسه با رادیکالهای وینیل، نادر |
| CH2=CHCH2−H | پیوند C-H آلیل | ۸۹ | ۳۷۲ | چنین پیوندهایی واکنشپذیری را نشان میدهد. |
میزان ضعف پیوندهای C-H، بازتابکنندهٔ رادیکالهای بنزیلیک است.
به عنوان گروه محافظتکننده
محافظت الکل
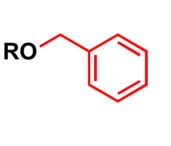
بنزیل به اختصار Bn به فراوانی در تولید مواد آلی به عنوان گروه محافظتکنندهٔ باثبات برای الکل و کربوکسیلیک اسید بکار میرود.
پرکاربردترین روشهای محافظت
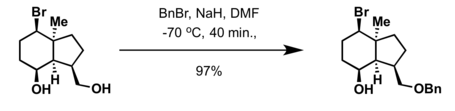
پردازش الکل با یک باز قوی مانند پتاسیم هیدروکسید پودری یا سدیم هیدرید و بنزیل هالید (BnCl) یا BnBr[2][3]
- مونوبنزیلاسیون کردن دیالها را میتوان با استفاده از Ag2O در دیمتیل فرمآمید (DMF) در محیطی با دمای بالا انجام داد.[4]
- الکل نوع یک را میتوان در حضور گروههای عاملی فنول با استفاده از Cu(acac)2، متال استیل استونات، بنزیلی کرد.[5]
پرکاربردترین روشهای محافظتزدایی یا واپیرگی
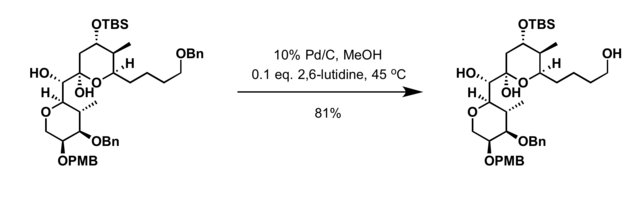
بنزیل اترها را میتوان در شرایط اکسایش-کاهش و با استفاده از اسیدهای لوییس، حذف کرد.[6]
شرایط اکسایشی
میتوان گروههای محافظتکنندهٔ بنزیل را با استفاده از عاملهای اکسایشی گستردهای حذف کرد از جمله:
- CrO3/استیک اسید در دمای محیط
- اوزون
- ان-بروموسوکینیمید (NBS)
- ان-یدوسوکینیمید (NIS)
اسید و باز لوییس
تری متیل سیلیل یدید (Me3SiI) در دی کلرومتان در دمای محیط (به صورت گزینشی در شرایط خاص میتوان بدست آورد)
گروه محافظتکنندهٔ پی-متوکسی بنزیل
پی-متوکسی بنزیل (PMB) را به عنوان یک گروه محافظتکننده برای الکل در تولید مواد آلی بکار میبریم.
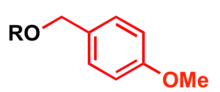
پرکاربردترین روشهای محافظت
- بازهای قوی مانند پودر پتاسیم هیدروکسید یا سدیم هیدرید و پی-متوکسی بنزیل هالید (کلرید یا برمید)[8][9]
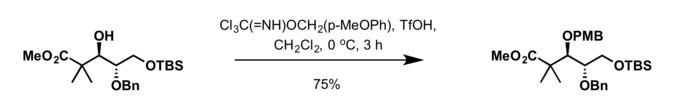
- ۴-متوکسی بنزیل-۲٬۲٬۲-تری کلرواستیمیدات را میتوان در نصب گروه PMB در حضور مواد زیر بکار برد:
- تری فلوئورومتان سولفونات اسکاندیم(III) (Sc(OTf)3) در تولوئن در دمای صفر درجهٔ سانتیگراد.[10]
- تری فلوئورومتان سولفونیک اسید TfOH در دی کلرومتان در دمای صفر درجهٔ سانتیگراد.[11]
پرکاربردترین روشهای محافظت زدایی
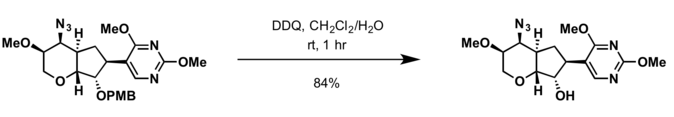
- ۳٬۲-دی کلرو-۶٬۵-دیسیانو-پی-بنزوکینون (DDQ)[12]
- شرایط برای محافظت زدایی گروه بنزیل برای کلیواژهای گروه محافظتکنندهٔ PMB قابل استفاده است.
محافظت گروه آمین

در سنتز آلی، گروه بنزیل به فراوانی به عنوان گروه محافظتکننده برای آمینها بکار میرود.
پرکاربردترین روشهای محافظت آمینها
- پتاسیم کربنات آبی و بنزیل هالید (بنزیل کلرید، بنزیل برمید) در متانول.[13]
- بنزآلدهید، 6 M HCl و NaBH3CN در متانول[14]
پرکاربردترین روشهای محافظت زدایی آمین
- هیدروژنه کردن در حضور فروکافت پالادیم[15]
جستارهای وابسته
منابع
- Carey, F. A.; Sundberg, R. J. (2008). Advanced Organic Chemistry, Part A: Structure and Mechanisms (5th ed.). New York, NY: Springer. pp. 806–808, 312–313. ISBN 978-0-387-44897-8.
- Wuts, Peter G. M.; Greene, Theodora W. Greene's Protective Groups in Organic Synthesis (4th ed.). Wiley Online Library. doi:10.1002/0470053488.
- Fukuzawa, Akio; Sato, Hideaki; Masamune, Tadashi (1987-01-01). "Synthesis of (±)-prepinnaterpene, a bromoditerpene from the red alga Yamada". Tetrahedron Letters. 28 (37): 4303–4306. doi:10.1016/S0040-4039(00)96491-8.
- Van Hijfte, Luc; Little, R. Daniel (1985-10-01). "Intramolecular 1,3-diyl trapping reactions. A formal total synthesis of (±)-coriolin". The Journal of Organic Chemistry. 50 (20): 3940–3942. doi:10.1021/jo00220a058. ISSN 0022-3263.
- Sirkecioglu, Okan; Karliga, Bekir; Talinli, Naciye (2003-11-10). "Benzylation of alcohols by using bis[acetylacetonato]copper as catalyst". Tetrahedron Letters. 44 (46): 8483–8485. doi:10.1016/j.tetlet.2003.09.106.
- Wuts, Peter G. M. ; Greene, Theodora W. Greene's Protective Groups in Organic Synthesis (4th ed.). Wiley Online Library. doi:10.1002/0470053488.
- Smith, Amos B.; Zhu, Wenyu; Shirakami, Shohei; Sfouggatakis, Chris; Doughty, Victoria A.; Bennett, Clay S.; Sakamoto, Yasuharu (2003-03-01). "Total Synthesis of (+)-Spongistatin 1. An Effective Second-Generation Construction of an Advanced EF Wittig Salt, Fragment Union, and Final Elaboration". Organic Letters. 5 (5): 761–764. doi:10.1021/ol034037a. ISSN 1523-7060.
- Marco, José L.; Hueso-Rodríguez, Juan A. (1988-01-01). "Synthesis of optically pure 1-(3-furyl)-1,2-dihydroxyethane derivatives". Tetrahedron Letters. 29 (20): 2459–2462. doi:10.1016/S0040-4039(00)87907-1.
- Takaku, Hiroshi; Kamaike, Kazuo; Tsuchiya, Hiromichi (1984-01-01). "Oligonucleotide synthesis. Part 21. Synthesis of ribooligonucleotides using the 4-methoxybenzyl group as a new protecting group for the 2′-hydroxyl group". The Journal of Organic Chemistry. 49 (1): 51–56. doi:10.1021/jo00175a010. ISSN 0022-3263.
- Trost, Barry M.; Waser, Jerome; Meyer, Arndt (2007-11-01). "Total Synthesis of (−)-Pseudolaric Acid B". Journal of the American Chemical Society. 129 (47): 14556–14557. doi:10.1021/ja076165q. ISSN 0002-7863. PMC 2535803. PMID 17985906.
- Mukaiyama, Teruaki; Shiina, Isamu; Iwadare, Hayato; Saitoh, Masahiro; Nishimura, Toshihiro; Ohkawa, Naoto; Sakoh, Hiroki; Nishimura, Koji; Tani, Yu-ichirou (1999-01-04). "Asymmetric Total Synthesis of Taxol\R". Chemistry – A European Journal. 5 (1): 121–161. doi:10.1002/(SICI)1521-3765(19990104)5:13.0.CO;2-O. ISSN 1521-3765.
- Hanessian, Stephen; Marcotte, Stéphane; Machaalani, Roger; Huang, Guobin (2003-11-01). "Total Synthesis and Structural Confirmation of Malayamycin A: A Novel Bicyclic C-Nucleoside from Streptomyces malaysiensis". Organic Letters. 5 (23): 4277–4280. doi:10.1021/ol030095k. ISSN 1523-7060.
- Kuehne, Martin E.; Xu, Feng (1993-12-01). "Total synthesis of strychnan and aspidospermatan alkaloids. 3. The total synthesis of (±)-strychnine". The Journal of Organic Chemistry. 58 (26): 7490–7497. doi:10.1021/jo00078a030. ISSN 0022-3263.
- Cain, Christian M.; Cousins, Richard P. C.; Coumbarides, Greg; Simpkins, Nigel S. (1990-01-01). "Asymmetric deprotonation of prochiral ketones using chiral lithium amide bases". Tetrahedron. 46 (2): 523–544. doi:10.1016/S0040-4020(01)85435-1.
- Zhou, Hao; Liao, Xuebin; Cook, James M. (2004-01-01). "Regiospecific, Enantiospecific Total Synthesis of the 12-Alkoxy-Substituted Indole Alkaloids, (+)-12-Methoxy-Na-methylvellosimine, (+)-12-Methoxyaffinisine, and (−)-Fuchsiaefoline". Organic Letters. 6 (2): 249–252. doi:10.1021/ol0362212. ISSN 1523-7060.