آمونیاک
آمونیاک (به انگلیسی: Ammonia) با فرمول شیمیایی NH3، ترکیبی از نیتروژن و هیدروژن است. آمونیاک یک هیدرید دوتایی پایدار و سادهترین هیدرید آن، یک گاز بیرنگ با بوی تند مشخص است. آمونیاک یک زباله نیتروژنی متداول است، بهویژه در میان موجودات آبزی، و با عملکرد به عنوان یک پیش مادهٔ غذایی و در کودها بهطور قابل توجهی به نیازهای غذایی موجودات زنده در زمین کمک میکند. آمونیاک، بهطور مستقیم یا غیرمستقیم، همچنین یکی از عناصر سازنده بسیاری از محصولات دارویی است و در بسیاری از محصولات تمیز کنندهٔ تجاری مورد استفاده قرار میگیرد. این ماده عمدتاً با جابجایی هوا و آب به سمت پایینتر جمع میشود.
| آمونیاک | |||
|---|---|---|---|
| |||
Azane | |||
دیگر نامها Hydrogen nitride | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۷۶۶۴-۴۱-۷ | ||
| پابکم | ۲۲۲ | ||
| UNII | 5138Q19F1X | ||
| شمارهٔ ئیسی | 231-635-3 | ||
| شمارهٔ یواِن | 1005 | ||
| KEGG | D02916 | ||
| MeSH | Ammonia | ||
| ChEBI | CHEBI:16134 | ||
| ChEMBL | CHEMBL۱۱۶۰۸۱۹ | ||
| شمارهٔ آرتیئیسیاس | BO0875000 | ||
مرجع بیلشتین |
3587154 | ||
مرجع جیملین |
79 | ||
| 3DMet | B00004 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
SMILES
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | NH3 | ||
| جرم مولی | 17.031 g/mol | ||
| شکل ظاهری | Colourless gas with strong pungent odour | ||
| چگالی | 0.86 kg/m3 (1.013 bar at boiling point) 0.73 kg/m3 (1.013 bar at 15 °C) 681.9 kg/m3 at -33.3 °C (liquid)[1] 817 kg/m3 at -80 °C (transparent solid)[2] | ||
| دمای ذوب | −۷۷٫۷۳ درجه سلسیوس (−۱۰۷٫۹۱ درجه فارنهایت؛ ۱۹۵٫۴۲ کلوین) | ||
| دمای جوش | −۳۳٫۳۴ درجه سلسیوس (−۲۸٫۰۱ درجه فارنهایت؛ ۲۳۹٫۸۱ کلوین) | ||
| انحلالپذیری در آب | 47% (0 °C) 31% (25 °C) 28% (50 °C)[3] | ||
| اسیدی (pKa) | 32.5 (-33 °C)[4] 10.5 (DMSO) | ||
| خاصیت بازی (pKb) | 4.75 | ||
| ساختار | |||
| شکل مولکولی | Trigonal pyramid | ||
| گشتاور دوقطبی | 1.42 D | ||
| خطرات | |||
| GHS pictograms |  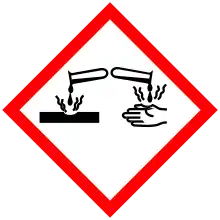   [5] [5] | ||
| GHS hazard statements | H221, H280, H314, H331, H400[5] | ||
| GHS precautionary statements | P210, P261, P273, P280, P305+351+338, P310[5] | ||
| شاخص ئییو | 007-001-00-5 (anhydrous) 007-001-01-2 (solutions) | ||
| طبقهبندی ئییو | Toxic (T) Corrosive (C) Dangerous for the environment (N) | ||
| کدهای ایمنی | R۱۰, R۲۳, R۳۴, R50 | ||
| شمارههای نگهداری | (S1/2), S۹, S۱۶, S26, S36/37/39, S45, S61 | ||
| لوزی آتش | Error: imagemap_invalid_title | ||
| نقطه اشتعال | |||
| دمای خودآتشگیری | |||
| محدودیتهای انفجار | ۱۵–۲۸٪ | ||
| آمریکا Permissible exposure limit (PEL) |
50 ppm (25 ppm ACGIH - TLV; 35 ppm STEL) | ||
| ترکیبات مرتبط | |||
| دیگر کاتیونها | فسفین آرسین Stibine | ||
| مرتبط با nitrogen hydrides | هیدرازین هیدرازوئیک اسید | ||
| ترکیبات مرتبط | هیدروکسید آمونیوم | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
هرچند که در طبیعت - چه زمینی و چه در سیارههای بیرونی منظومه شمسی - استفادهٔ گسترده از آن متداول است، اما آمونیاک به شکل غلیظ خود بسیار خورنده و خطرناک است. در ایالات متحده این ماده به عنوان مادهای بسیار خطرناک طبقهبندی میشود و در مراکز تولید، ذخیره یا استفاده در مقادیر قابل توجه نیازمند گزارش و سختگیری است.[6]
تولید جهانی صنعتی آمونیاک در سال ۲۰۱۷ برابر ۱۷۵ میلیون تن بود،[7] آمونیاک صنعتی یا به صورت آمونیوم هیدروکسید (معمولاً ۲۸٪ آمونیاک در آب) یا به صورت آمونیاک مایع فشرده بیآب یا یخچال دار که در اتومبیلهای با مخزن ویژه یا در سیلندر حمل و عرضه میشود.[8] بازار جهانی آمونیاک در سال ۲۰۱۶ معادل ۶۵٫۴۸ میلیارد دلار ارزیابی شدهاست. پیشبینی میشود این صنعت تا سال ۲۰۲۵ به ۷۶٫۶۴ میلیارد دلار برسد.[9]
در طبیعت از تجزیهٔ مواد آلی ازت دار همچون اوره ادرار بهدست میآید.
رومیهای باستان آمونیوم کلرید را به عنوان پول و سپرده استفاده میکردند. آنها سنگ آمونیوم را از مکانی به نام پرستشگاه ژوپیتر یا همان لیبی جدید جمعآوری میکردند. اما آمونیاک به شکل نمک آمونیاک نخستین بار توسط جابر ابن حیان در قرن 7 شناخته شد.[10]
ساختار مولکولی
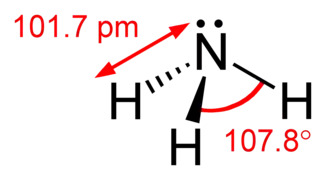
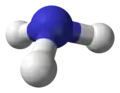
مولکول آمونیاک از یک اتم نیتروژن و سه اتم هیدروژن متصل به آن تشکیل شدهاست. با توجه به وجود یک جفت الکترون ناپیوندی بر روی نیتروژن، این مولکول ساختار هرم مثلثی دارد و زوایای پیوند کمتر از ۱۰۹ درجه هستند.[11] مولکول آمونیاک یک مولکول قطبی است که میتواند با خودش و بسیاری مولکولهای دیگر، پیوند هیدروژنی برقرار نماید.
خواص شیمیایی
فرایند تولید
روشهای صنعتی
مهمترین روش صنعتی تولید آمونیاک، فرایند هابر نام دارد که شامل تهیة آمونیاک از عناصر سازنده آن میباشد. در این روش، گازهای نیتروژن و هیدروژن در دمای بالا و در فشار زیاد با هم واکنش میدهند و آمونیاک را تولید میکنند. کاتالیزگرهای مختلف هم به سهولت این واکنش کمک مینمایند.[13]
کاربرد
از موارد استفادهٔ آمونیاک میتوان به استفاده در تهیهٔ کودهای شیمیایی، یخ سازی، اسید نیتریک، سایر ترکیبات نیتروژنه، مواد منفجره و نگهداری از مواد غذایی اشاره کرد.
کود
در سال ۲۰۱۹ در ایالات متحده، تقریباً ۸۸٪ از آمونیاک تولید شده به عنوان کود، به صورت نمک، محلول یا انیدروز استفاده شدهاست. هنگامی که این کودها روی خاک قرار میگیرند، به افزایش عملکرد محصولاتی مانند ذرت و گندم کمک میکنند.[14] ۳۰٪ نیتروژن کشاورزی مورد استفاده در ایالات متحده به شکل آمونیاک بی آب است و سالانه ۱۱۰ میلیون تن از آن در جهان استفاده میشود.[15]
پیش ماده ترکیبات حاوی نیتروژن
آمونیاک بهطور مستقیم یا غیر مستقیم پیش ساز اکثر ترکیبات حاوی نیتروژن است. تقریباً تمام ترکیبات نیتروژن مصنوعی از آمونیاک حاصل میشوند. یکی از این مشتقات مهم، اسید نیتریک است.[16] از اسید نیتریک برای تولید کودها، مواد منفجره و بسیاری از ترکیبات ارگانونیتروژن استفاده میشود.
از آمونیاک همچنین برای ساخت ترکیبات زیر استفاده میشود:
- هیدرازین، توسط فرایند اولین-راشیگ و فرایند پراکسید
- هیدروژن سیانید، توسط فرایند BMA و فرایند آندروسوف
- هیدروکسیل آمین و آمونیوم کربنات، توسط فرایند راشیگ
- فنول، توسط فرایند راشیگ-هوکر
- اوره، توسط فرایند اوره بوش-مایزر و در سنتز وهلر
- اسیدهای آمینه، با استفاده از سنتز آمینو اسید Strecker
- اکریلونیتریل، توسط فرایند Sohio
از آمونیاک همچنین برای ایجاد ترکیباتی در واکنشهایی که بهطور خاص نامگذاری نشدهاند، استفاده میشود. نمونههایی از این ترکیبات عبارتند از: آمونیوم پرکلرات، آمونیوم نیترات، فرم آمید، دینیتروژن تتراکسید، آلپرازولام، اتانولآمین، اتیل کربامات، هگزامتیلن تترامین و آمونیوم بیکربنات.
به عنوان یک تمیزکننده
آمونیاک خانگی محلول NH3 در آب است و به عنوان یک تمیز کننده عمومی برای بسیاری از سطوح استفاده میشود. از آنجا که آمونیاک منجر به درخشش نسبتاً بدون رگه میشود، یکی از رایجترین کاربردهای آن تمیز کردن شیشه، پرسلان و فولاد زنگ نزن است. از این ماده همچنین برای تمیز کردن اجاق گازها و خیساندن لکههای پخته شده استفاده میشود. غلظت آمونیاک خانگی از نظر وزنی ۵ تا ۱۰ درصد است.[17]
تخمیر
از محلولهای آمونیاک ۱۶ تا ۲۵٪ در صنعت تخمیر به عنوان منبع نیتروژن برای میکروارگانیسمها و تنظیم pH در هنگام تخمیر استفاده میشود.
سنتز و تولید
آمونیاک یکی از پرمصرفترین مواد شیمیایی معدنی است که در سال ۲۰۱۸ تولید جهانی آن ۱۷۵ میلیون تن گزارش شدهاست.[18] ۲۸٫۵٪ از این مقدار توسط چین تولید شدهاست، و پس از آن روسیه با ۱۰٫۳٪، ایالات متحده با ۹٫۱٪ و هند با ۶٫۷٪ قرار دارند.[18]
منابع
- Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. p. 132. ISBN 1-4067-7302-6.
- Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids. 24 (4): 277. doi:10.1080/00337577508240819.
- Perry, Dale L. ; Phillips, Sidney L. (1995). Handbook of inorganic compounds. CRC Press. p. 17. ISBN 0-8493-8671-3.
- Perrin, D.D. , Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed. , Pergamon Press: Oxford, 1982.
- کاتالوگ آنلاین زیگما ، تاریخ بررسی: June 6, 2011.
- "40 C.F.R. : Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities" (PDF) (1 July 2008 ed.). Government Printing Office. Archived from the original (PDF) on 25 February 2012. Retrieved 29 October 2011.
- "Mineral Commodity Summaries 2020, p. 117 – Nitrogen" (PDF). USGS. 2020. Retrieved 12 February 2020.
- R. Norris Shreve; Joseph Brink (1977). Chemical Process Industries (4th ed.). p. 276. ISBN 978-0-07-057145-7. See also Gas carrier and Bottled gas.
- "Ammonia Market Size Worth $76.64 Billion By 2025 | CAGR 5.3%". www.grandviewresearch.com. Retrieved 2021-01-08.
- http://www.irannh3.com بایگانیشده در ۲۶ آوریل ۲۰۱۵ توسط Wayback Machine www.irannh3.com
- Chemistry; Charles E. Mortimer; 6th Edition; Chapter9
- Chemistry; Charles E. Mortimer; 6th Edition; Chapter16
- Chemistry; Charles E. Mortimer; 6th Edition; Chapter 23
- Lassaletta, Luis; Billen, Gilles; Grizzetti, Bruna; Anglade, Juliette; Garnier, Josette (2014). "50-year trends in nitrogen use efficiency of world cropping systems: the relationship between yield and nitrogen input to cropland". Environmental Research Letters. 9 (10): 105011. Bibcode:2014ERL.....9j5011L. doi:10.1088/1748-9326/9/10/105011. ISSN 1748-9326.
- David Brown (18 April 2013). "Anhydrous ammonia fertilizer: abundant, important, hazardous". Washington Post. Retrieved 23 April 2013.
- Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- "The Facts About Ammonia". www.health.ny.gov. Retrieved 2018-04-06.
- "Mineral Commodity Summaries 2020, p. 117 – Nitrogen" (PDF). USGS. 2020. Retrieved 12 February 2020.
| در ویکیانبار پروندههایی دربارهٔ آمونیاک موجود است. |