نیترو اسید
نیتروس اسید یا نیترو اسید (به انگلیسی: Nitrous acid) با فرمول شیمیایی HNO۲ یک ترکیب شیمیایی با شناسه پابکم ۲۴۵۲۹ است. که جرم مولی آن ۴۷٫۰۱۳ g/mol میباشد. شکل ظاهری این ترکیب، محلول آبی کمرنگ است. این ماده دارای خواص اسیدی است[1]. همچنین میتواند در واکنشهای اکسایش و کاهش نیز شرکت نماید.
| نیترو اسید | |
|---|---|
 | |
Preferred IUPAC name Nitrous acid | |
Hydroxidooxidonitrogen | |
| شناساگرها | |
| شماره ثبت سیایاس | ۷۷۸۲-۷۷-۶ |
| پابکم | ۲۴۵۲۹ |
| کماسپایدر | ۲۲۹۳۶ |
| شمارهٔ ئیسی | 231-963-7 |
| KEGG | C00088 |
| MeSH | Nitrous+acid |
| ChEBI | CHEBI:25567 |
| ChEMBL | CHEMBL۱۱۶۱۶۸۱ |
مرجع جیملین |
983 |
| 3DMet | B00022 |
| جیمول-تصاویر سه بعدی | Image 1 |
SMILES
| |
| |
| خصوصیات | |
| فرمول مولکولی | HNO2 |
| جرم مولی | 47.013 g/mol |
| شکل ظاهری | Pale blue solution |
| چگالی | Approx. 1 g/ml |
| دمای ذوب | Only known in solution |
| اسیدی (pKa) | 3.398 |
| خطرات | |
| شاخص ئییو | Not listed |
| نقطه اشتعال | |
| ترکیبات مرتبط | |
| دیگر آنیونها | نیتریک اسید |
| دیگر کاتیونها | سدیم نیتریت پتاسیم نیتریت نیتریت آمونیوم |
| ترکیبات مرتبط | دینیتروژن تریاکسید |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
ساختار
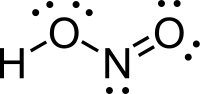
در نیترو اسید، توالی اتمها به شکل HONO است و ساختار پیوندی آن به صورت H-O-N=O میباشد. نیتروژن دارای هیبریداسیون sp2 است و اتمهای اکسیژن از هیبریداسیون sp3 استفاده میکنند[2]. چرخش حول پیوند H-O در این مولکول موجب میشود صورتبندیهای مختلفی دیده شود که فرم ترانس از فرم سیس پایدارتر میباشد (به دلیل دافعهٔ کمتر ابر الکترونی پیوندهای H-O و N=O). به دلیل اختلاف الکترونگاتیوی بین اتمهای پیوندی در این مولکول، و نیز به دلیل ساختار نامتقارن، مولکول نیترو اسید یک مولکول قطبی به شمار میآید.
خواص فیزیکی
نیترو اسید دارای مولکولهای قطبی است؛ بنابراین نیروی بین این مولکولها از جنس جاذبههای دوقطبی-دوقطبی میباشد. از طرفی با توجه به ساختار مولکول که توالی H-O-N در آن دیده میشود؛ اتم هیدروژن در مولکول نیترو اسید دارای کمبود الکترون (اندکی بار مثبت) است و میتواند با اکسیژنِ متصل به نیتروژن مولکول دیگر، پیوند هیدروژنی برقرار نماید. با توجه به موارد گفتهشده، نیترو اسید به خوبی در آب و سایر حلالهای قطبی دیگر (با خاصیت یونیزهکنندگی بالا=ثابت دیالکتریک بالا) حل میشود.
خواص شیمیایی
خصلت اسیدی
نیترو اسید یک اسید ضعیف است و میتواند با از دست دادن یون هیدروژن (=پروتون) به یون نیتریت تبدیل شود:
HNO2→H++NO2-
بنابراین محلول نیترو اسید دارای pH (پی اچ) کمتر از 7 است.
اکسایش و کاهش
عدد اکسایش نیترژن در این ماده 3+ است؛ پس میتواند تا 5+ بالا رود و تا 3- پایین بیاید؛ بنابراین میتوان نیترو اسید را به نیتریک اسید اکسید کرد یا آن را به مواد مختلف احیا نمود. چند نمونه از واکنشهای مختلف را در زیر میبینید:
2HNO2+1O2→2HNO3
HNO2+ArNH2+H+→ArN2++2H2O
طرز تهیه
یکی از رایجترین روشهای تهیه (سنتز) این ماده، حل کردن دینیتروژن تریاکسید (نیتروژن(III) اکسید) در آب است:
N2O3+H2O→2HNO2
NaNo2+ HCl
جستارهای وابسته
منابع
- Chemistry; Charles E. Mortimer; Chap. 16
- Chemistry; Charles E. Mortimer; Chap. 8&9
- «IUPAC GOLD BOOK». دریافتشده در ۱۸ مارس ۲۰۱۲.