طیفبینی فروسرخ
طیف فروسرخ، به گسترهای از طول موج پس از امواج مرئی تا امواج رادیویی یعنی ۷۵۰ نانومتر تا ۱ میلیمتر گفته میشود.[1] در این ناحیه ارتعاشات مولکولی جذب دارند. در طیف بینی فروسرخ از طیفهای این ناحیه اطلاعات کیفی و کمی استخراج میشود که در شناسایی گروه عاملی مواد تعیینکننده است. این طیف به سه ناحیه فروسرخ نزدیک، میانه و دور تقسیم میشود. یکی از روشهای طیفسنجی بسیار مفید که به ما در شناسایی نوع پیوندهای موجود در یک ترکیب کمک میکند طیفسنجی مادون قرمز (InfraRed) یا همان IR میباشد. طیفسنجی مادون قرمز، IR، روشی برای شناسایی مولکولها و بهخصوص گروههای عاملی مولکولهاست. هر مادهای، طیف مادون قرمز مخصوص به خود را دارد و همانند اثر انگشت، مختص همان مولکول میباشد. ما توسط این روش طیفسنجی نمیتوانیم ساختار گسترده یک ترکیب را رسم کنیم ولی میتوانیم از ماهیت پیوندها مانند پیوند یکگانه، دوگانه یا سهگانه آگاه شویم. از جمله مزایای این روش طیفسنجی، غیرتخریبی بودن آن میباشد که بر خلاف طیفسنجی جرمی پس از استفاده از نمونه در دستگاه IR میتوان دوباره از آن استفاده کرد. طیفسنجی مادون قرمز بر اساس جذب تابش و بررسی جهشهای ارتعاشی مولکولها و یونهای چند اتمی صورت میگیرد. این روش به عنوان روشی پرقدرت و توسعه یافته برای تعیین ساختار و اندازهگیری گونههای شیمیائی به کار میرود. همچنین این روش عمدتاً برای شناسایی ترکیبهای آلی به کار میرود، زیرا طیفهای این ترکیبها معمولاً پیچیده هستند و تعداد زیادی پیکهای بیشینه (ماکسیمم) و کمینه (مینیمم) دارند که میتوانند برای اهداف مقایسهایی به کار گرفته شوند.
در فرایند جذب، فرکانسهایی از اشعه مادون قرمز که با فرکانسهای ارتعاشی طبیعی مولکول مورد نظر تطبیق کند جذب خواهد شد و انرژی جذب شده برای افزایش دامنه حرکت ارتعاشی اتصال موجود در مولکول به کار گرفته میشود. باید توجه داشت که تمام پیوندهای موجود در مولکول قادر به جذب انرژی مادون قرمز نیستند، حتی اگر فرکانس اشعه کاملاً با فرکانس حرکت تطبیق کند. فقط آن پیوندهایی که دارای گشتاور دو قطبی هستند قادر به جذب اشعه مادون قرمز خواهند بود. پیوندهای متقارن، اشعه مادون قرمز را جذب نمیکنند زیرا یک پیوند باید خصلت دو قطبی الکتریکی را از خود بروز دهد که این دو قطبی با همان فرکانس اشعه ورودی متغیر بوده تا انتقال انرژی صورت پذیرد. در مولکولها دو نوع ارتعاش وجود دارد که اصطلاحاً ارتعاشهای کششی و خمشی نامیده میشوند. ارتعاش کششی به دو صورت متقارن و نامتقارن تقسیمبندی میشود. هر گاه یک نیم متناوب کششی نامتقارن رخ دهد، گشتاور دو قطبی در یک جهت تغییر مییابد و در نیم تناوب دیگر، گشتاور دو قطبی در جهت مخالف جابهجا میگردد. بدین ترتیب گشتاور دو قطبی با فرکانس ارتعاشی مولکول، نوسان مینماید. این نوسان باعث ارتقای مولکول به نوار جذبی مادون قرمز میگردد و به همین علت آن را فعال مادون قرمز مینامند. در حالت ارتعاش کششی متقارن، دو اتم در یک نیم تناوب ارتعاشی، در جهتهای مختلف حرکت میکنند که در این صورت تغییر نهایی در گشتاور دو قطبی مولکول به وجود نمیآید و به همین علت آن را غیرفعال مادون قرمز مینامند (فقط پیوندهایی که گشتاور قطبی دارند قادر به جذب اشعهٔ مادون قرمز (فروسرخ) میباشند. پیوندهای متقارن مانند H2 و Cl2 اشعهٔ مادون قرمز را جذب نمیکنند). برهمکنش تابش مادون قرمز با یک نمونه باعث تغییر انرژی ارتعاشی پیوند در مولکولهای آن میشود و روش مناسبی برای شناسایی گروههای عاملی و ساختار مولکولی است. شرط جذب انرژی مادون قرمز توسط مولکول این است که گشتاور دو قطبی در حین ارتعاش تغییر نماید. انتقالهای به وجود آورندهٔ نوارهای جذبی IR ناشی از ارتعاشهای مولکولی یعنی حرکتهای کششی و خمشی پیوندها میباشند.
فرکانس ارتعاشی (یعنی موقعیت نوارهای جذبی IR) به ماهیت پیوندها بستگی دارد. ارتعاشهای کششی پیوندهای قویتر نسبت به پیوندهای ضعیفتر در انرژی بالاتر، فرکانس بالاتر و در نتیجه در طول موج کوتاهتر ظاهر میشوند. همینطور، پیوندهای شامل اتمهای سبکتر در مقایسه یا پیوندهای شامل اتمهای سنگینتر، در انرژی بالاتری مرتعش میشود. جذبهای اشاره شده در بالا (شکل ۱۲–۱) را جذبهای اصلی میگوییم ولی معمولاً به دلیل وجود جذبهای دیگری همچون اورتون، ترکیبی و اختلافی طیفهای مادون قرمز پیچیده میشوند.
جذبهای اورتون بر اثر تهییج از حالت پایه به حالات انرژی بالاتر صورت میگیرند که در واقع ضریبی از فرکانس اصلی جذب هستند. وقتی دو فرکانس ارتعاشی در یک مولکول باهم ترکیب شده و ارتعاش دیگری با فرکانس جدید در مولکول پدیدآورد که این ارتعاش در مادون قرمز فعال باشد، این جذب جدید را جذب ترکیبی گویند. این جذب از مجموع دو جذب ادغام شده ایجاد میشود. باید توجه داشت که کلیه جذبهای ترکیبی ممکن رخ نمیدهد. قوانینی وجود دارند که نشان میدهند کدام یک از جذبهای ترکیبی مجاز هستند. جذبهای اختلافی مشابه جذبهای ترکیبی هستند که فرکانس مشاهده شده در این حالت از اختلاف بین دو جذب ادغام شده حاصل میگردد. جذبهای اورتون، ترکیبی و اختلافی را میتوان به ترتیب با اجرای اعمال ضرب، جمع و تفریق بر روی فرکانسها (برحسب عدد موج) به دست آورد. اگر یک ارتعاش اصلی با یک جذب اورتون یا ترکیبی ادغام گردد، ارتعاش حاصل رزونانس فرمی گویند. رزونانس فرمی اغلب در ترکیبات کربنیلدار مشاهده میگردد. اگرچه تمام فرکانسهای چرخشی یک مولکول در مادون قرمز، فعال نبوده، ولی آن فرکانسها با ارتعاشات کششی و خمشی دیگر ترکیب شده و موجب پیچیدگی بیشتر طیف میگردند. یکی از دلیلهایی که گاهی در طیف مادون قرمز، یک جذب پهن وجود دارد، ترکیب و امتزاج فرکانسهای چرخشی است (شکل ۱۲–۲).
مهمترین بخش تابش مادونقرمز مورد بررسی و استفاده شیمیدانهای آلی، در ناحیه بین ۴۰۰ تا cm−1۴۰۰۰ قرار گرفتهاست. محل نوار در طیفهای IR، به صورت عدد موج (ύ) که واحد آن عکس سانتیمتر (cm−1) است بیان میشود. این واحد با انرژی رابطه مستقیم دارد (عدد موج بیشتر نشانگر انرژی بیشتر است). بهطور کلی سه نوع طیفسنجی IR داریم که بر اساس دامنهٔ طول موج نوری که به نمونه تابیده میشود، این دستهبندی انجام میشود. این سه نوع عبارتند از:
1. IR دور: طول موج در دامنهٔ (cm−1) ۶۵۰–۲۰۰
2. IR متوسط: طول موج در دامنهی(cm−1) ۴۰۰۰–۶۵۰
3. IR نزدیک: طول موج در دامنهٔ (cm−1) ۴۳۰۰–۴۰۰۰
این سه نوع از IR هر کدام برای یک سری از ترکیبهای شیمیایی استفاده میشود برای مثال برای شناسایی ترکیبهای آلی باید از IR متوسط استفاده کنیم (همانطور که اشاره شد، حدود دامنه ۴۰۰ تا cm−1 ۴۰۰۰).
مفهوم
تعداد حالتهای لرزش
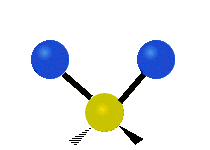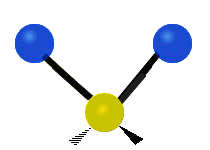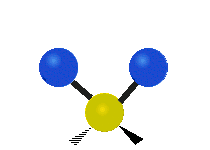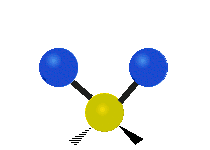
هر مولکولی به تعداد ۳n درجه آزادی دارد. از این تعداد ۳ درجه مربوط به چرخشی و بسته به اینکه خطی باشد ۳n-۵ درجه آزادی ارتعاشی و اگر غیرخطی باشد ۳n-۶ درجه آزادی ارتعاشی موجود میباشد. تنها ارتعاشاتی در فروسرخ فعال هستند که اندازه حرکت دو قطبی آن در هنگام ارتعاش عوض شود. نظریه گروه به بررسی تفضیلی این موضوع میپردازد.[2]
| Symmetrical stretching |
Antisymmetrical stretching |
Scissoring |
|---|---|---|
 |
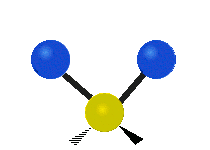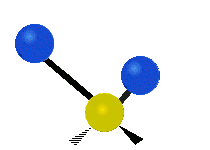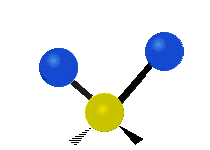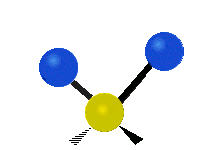 |
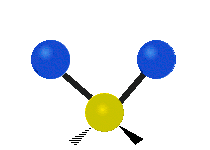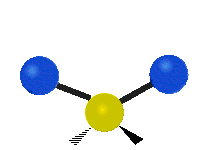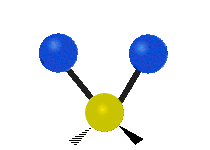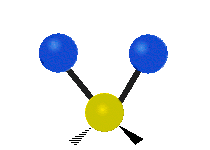 |
| Rocking | Wagging | Twisting |
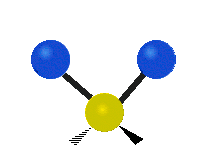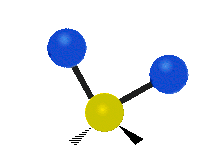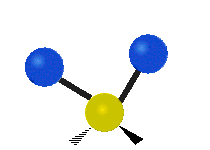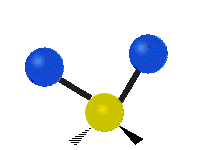 |
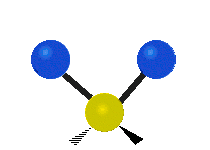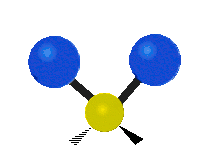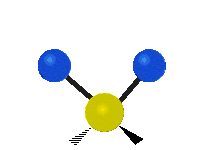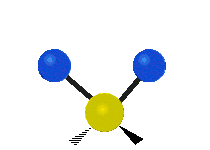 |
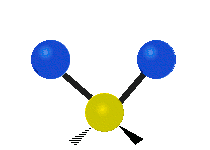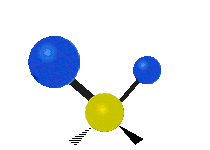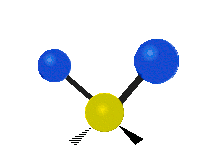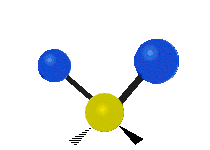 |
هر پیوند دارای فرکانس ارتعاش طبیعی خاصی است و نیز یک پیوند بهخصوص در دو مولکول مختلف در دو محیط متفاوت قرار دارند، بنابراین، هیچگاه دو مولکول با ساختمانهای متفاوت جذب مادون قرمز یا به عبارت دیگر طیف مادون قرمز مشابهی نمیدهند. اگرچه ممکن است که بعضی از فرکانسهای جذب شده در دو مولکول مشابه باشند اما هیچگاه دو مولکول مختلف، طیف مادون قرمز کاملاً یکسانی را نخواهند داشت؛ بنابراین همانگونه که قبلاً نیز اشاره شد، طیف مادون قرمز را میتوان مانند اثر انگشت در انسان برای شناسایی مولکولها به کار گرفت. اگر تمام جذبها در طیف دو مولکول بر یکدیگر منطبق شوند، آن وقت به احتمال قریب یقین دو ماده یکسان هستند. کاربرد دیگر طیف مادون قرمز که مهمتر از اولی است، این ا ست که طیف مزبور اطلاعاتی راجع به ساختمان یک مولکول میدهد.
دستگاهی
دستگاه طیفسنج فروسرخ در مدلها و اندازههای گوناگونی ساخته میشود از یک حسگر ساده کربن دیاکسید تا یک تجزیه گر پیچیده تعیین گروههای عاملی ترکیب شیمیایی؛ همه و همه انواع مختلف این دستگاه هستند. در دستگاههای متداول آزمایشگاهی دو نوع ساده و تبدیل فوریه موجود است. بخشهای اصلی دستگاه شامل منبع و آشکارساز است.[3]
منبع تابش
منبع تابش در این دستگاه باید قابلیت تولید طیف پیوسته در گستره مورد نظر را داشته باشد. یک سیم فولادی داغ شده تا دمای ۲۰۰۰–۱۵۰۰ کلوین میتواند این کار را انجام دهد. چراغ نرنست یک لوله توخالی پر شده از گازهای بیاثر است که در ان سیمی پلاتینی قرار دارد. این چراغ در دمای ۲۲۰۰ کلوین کار میکند. منبع دیگر گلوبار است که یک استوانهٔ سیلیسیم کاربید است و توسط نیروی برق به دمای ۱۵۰۰ کلوین رسیدهاست.[3]
آشکارساز فروسرخ
دو دستهٔ اصلی آشکارسازها، گرمایی و کوانتمی هستند. آشکارسازهای گرمایی به ۴ دسته دماپا، بلومتر، پیزوالکتریک و بادی تقسیم میشوند.[4]
طیفسنج فروسرخ با تبدیل فوریه
این نوع از دستگاه که خود دو نوع نوری و غیر نوری را دارد بر استفاده از روشهای تبدیل فوریه برای پرهیز از پویش استوار است.
کاربرد
استفاده عمومی از طیفبینی مادون قرمز توسط شیمیدانهای آزمایشگاهی برای شناسایی ترکیبهای آلی بسیار معمول است. اگر طیف IR یک ترکیب آلی مجهول را در اختیار داشته باشیم، شناسایی این ترکیب آلی مجهول یک فرایند دو مرحلهایست: مرحله اول شامل تعیین حضور محتملترین گروههای عاملی با بررسی ناحیه فرکانس گروهی (که تابش از حدود ۱۲۰۰ تا cm−1۳۶۰۰ را در بر میگیرد) میباشد. مرحله دوم شامل مقایسه جزئیات طیف مجهول با طیف ترکیبهای خالصی که محتوی کلی گروههای عاملی یافت شده در مرحله اول هستند.
هنگامی که زاویه بزرگتر از ˚۹۰ (˚۱۲۰ در مثال فوق) باشد، ارتعاش کششی پیوند سادهC-C به دو جزء تقسیم میگردد که یکی از آنها منطبق بر جهت ارتعاش کششی C=C است. هنگامی که یک یا دو گروه آلکیلی مستقیماً به پیوند دوگانه متصل باشند، افزایش قابل ملاحظهای در فرکانس جذب پیوند دوگانه موجود در حلقه مشاهده میگردد. این افزایش برای حلقههای کوچک، به ویژه سیکلوپروپنها، بسیار محسوس است. هنگامی که یک گروه آلکیل به پیوند دوگانه متصل گردد، مقدار پایه cm−1 ۱۶۵۶ برای سیکلوپروپن به حدود cm−1 ۱۷۸۸ افزایش مییابد؛ با وجود دو گروه آلکیل این مقدار به حدود cm−1 ۱۸۸۳ فزونی مییابد. در پیوندهای دوگانه خارجی، کاهش اندازه حلقه باعث افزایش فرکانس جذب میگردد. آلن نمونه بارزی از یک ترکیب دارای پیوند دوگانه خارجی است. حلقههای کوچکتر نیاز بیشتری به استفاده از خصلت p در ساخت پیوندهای C-C دارند تا جوابگوی نیاز زوایای کوچک باشند. این مسئله باعث از میان برداشته شدن خصلت p از پیوند سیگمای پیوند دوگانه شده، ولی در عوض به آن خصلت s بیشتری میدهد؛ بنابراین قدرت و استحکام پیوند دوگانه افزایش مییابد. پس ثابت نیروی K افزایش یافته و فرکانس جذب نیز فزونی میگیرد. گروه کربونیل در آلدهیدها، کتونها، اسیدها، استرها، آمیدها، آسیلها و انیدریدها موجوداست. این گروه به علت تغییر زیادی که در گشتاور دو قطبی آن ایجاد میشود یک جذب قوی در cm−1 ۱۸۵۰–۱۶۵۰ میدهد. فرکانس کششی آلدئید معمولی cm−1۱۷۲۵در حدود است. چون موقعیت این جذبها چندان تفاوتی با کتونها ندارند، تشخیص آلدهیدها و کتونها بر این پایه کار چندان سادهای نیست. مزدوج شدن گروه کربونیل با یک پیوند دوگانه از نوع آلفا - بتا، نوار کششی C=O را به طرف فرکانس پایینتر (cm−1 ۱۷۰۰ –۱۶۸۰) منتقل میکند. ارتعاشC-H آلدئید که در حدود cm−1۲۷۵۰ و cm−1۲۸۵۰ یافت میشوند، برای تشخیص آلدهیدها از کتونها بینهایت مهم هستند. مهمترین صفت مشخصه در طیف یک اسید کربوکسیلیک جذب بسیار پهنی است که در ناحیه cm−1 ۳۵۰۰–۲۴۰۰ ظهور میکند. این نوار مربو ط به پیوند هیدروژنی قوی در دیمرها است. این جذب اغلب با ارتعاشات کششی C–H که در همان ناحیه است تداخل میکند. اگر این نوار پهن پیوند هیدروژنی همراه جذب C=O وجود داشته باشد، به احتمال یقین میتوان گفت که ترکیب، یک ترکیب کربوکسیلیک است. جذب کششی C=O برای دیمر اسیدهای کربوکسیلیک که در حدود cm−1 ۱۷۳۰–۱۷۰۰ ظاهر میشود، معمولاً پهنتر و شدیدتر از جذب C=O در یک آلدئید یا کتون خواهد بود. دو صفت بارز در استرها، جذب کششی قویC=O و C-Oهستند که به ترتیب در محدودههای cm−1 ۱۷۵۰–۱۷۳۵ و cm−1۱۳۰۰–۱۰۰۰ ظاهر میشوند.
هر چند گروه کربونیل برخی از استرها ممکن است در ناحیهای که کتونها جذب میدهند ظاهر شوند ولی، میتوان وجود کتون را با مشاهده نوارهای کششی قوی و پهنC-O که در ناحیه cm−1 ۱۳۰۰ – ۱۰۰۰ ظهور میکنند، حذف کرد. در آمیدها، C=O کششی تقریباً درcm−1 ۱۶۸۰ – ۱۶۳۰ یافت میشود. N–Hکششی در آمیدهای نوع اول (-NH2) دو نوار نزدیکی ۳۳۵۰ و cm−1۳۱۸۰ میدهد. امید نوع دوم یک نوار (-NH2)در حدود cm−1 ۳۳۰۰ دارند. N–H خمشی برای آمیدهای نوع اول و دوم در حدود cm−1 ۱۶۴۰ – ۱۵۵۰ ظاهر میشود.
C=O کششی در کلر ور اسیدهای غیر مزدوج در محدوده cm−1۱۷۷۵ – ۱۸۱۰ یافت میشود. مزدوج شدن، باعث کاهش فرکانس تا cm−1 ۱۷۶۰ – ۱۷۸۰ میگردد. ظهور دو نوار قوی در ناحیه cm−1 ۱۸۳۰ – ۱۸۰۰ و cm−1 ۱۷۷۵–۱۷۴۰ از مشخصات انیدریدهای اشباع شده و غیر حلقوی است. این دو نوار حاصل ارتعاشات کششی نا متقارن و متقارن است. مزدوج شدن جذب را به طرف راست برده، در حالی که حلقوی شدن آن را به چپ منتقل میسازد. ارتعاش کششی قوی و پهن C – O در ناحیه cm−1 ۱۳۰۰ – ۹۰۰ ظاهر میگردد. N–H کششی در ناحیه cm−1۳۵۰۰ – ۳۳۰۰ ظاهر میشود. آمینهای نوع اول دو نوار و آمینهای نوع دوم یک نوار دارند. آمینهای نوع سوم N–H کششی ندارند.N–H خمشی در آمینهای نوع اول به صورت نوار پهن در cm−1 ۱۵۶۰ – ۱۶۴۰ ظاهر میگردد. آمینهای نوع دوم در نزدیکی cm−1 ۱۵۰۰ جذب میدهند. N–H جذب خمشی خارج از صفحهای گاهی در نزدیکی cm−1۸۰۰ مشاهده میشود. N–C کششی در ناحیه cm−1۱۳۵۰۰ – ۱۰۰۰ ظاهر میگردد.
طیف بینی فروسرخ در پژوهش، صنعت و علوم قضایی به عنوان یک روش ساده و مطمئن کاربرد دارد.[5]
تعیین گروه عاملی و تعیین ساختار
منطقهٔ ۴۰۰۰–۱۵۰۰ بر سانتیمتر، منطقهای است که گروههای عاملی ترکیبات شیمیایی جذب میدهند.
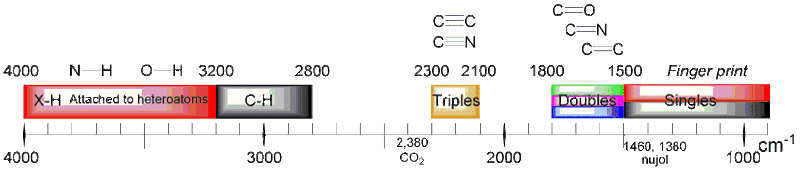 منطقهٔ ۱۵۰۰–۴۰۰ بر سانتیمتر ارزش تحلیل ندارد. این منطقه با نام منطقهٔ اثر انگشت شناخته میشود. این بدان معناست که برای هر ترکیب این منطقه تقریباً منحصربهفرد است.
منطقهٔ ۱۵۰۰–۴۰۰ بر سانتیمتر ارزش تحلیل ندارد. این منطقه با نام منطقهٔ اثر انگشت شناخته میشود. این بدان معناست که برای هر ترکیب این منطقه تقریباً منحصربهفرد است.
مقایسه دو ترکیب
با توجه به منحصر بودن طیف دو ماده میتوان با مقایسه طیف فروسرخ آنها به یکی بودن یا نبودن آنها پی برد. این روش محدودیتهای دارد. مثلاً دو آنانتیومر قابل تشخیص نیستند.
اندازهگیری کمی
اندازهگیری کمی با این دستگاه کمتر صورت میپذیرد. با این حال تعدادی از آلایندهها[6] و کربن فولاد[7] به این روش اندازهگیری میشوند.
منابع
- مشارکتکنندگان ویکیپدیا. «Infrared spectroscopy». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۹ مه ۲۰۱۱.
- Electromagnetic Spectrum
- «Use of Point Groups». بایگانیشده از اصلی در ۱۴ ژوئن ۲۰۱۱. دریافتشده در ۳۰ مه ۲۰۱۱.
- «Infra red Absorption Spectroscopy - Instrumentation». بایگانیشده از اصلی در ۱ ژانویه ۲۰۱۱. دریافتشده در ۳۰ مه ۲۰۱۱.
- «نسخه آرشیو شده» (PDF). بایگانیشده از اصلی (PDF) در ۲۷ سپتامبر ۲۰۰۷. دریافتشده در ۳۰ مه ۲۰۱۱.
- «Applications Of Ir Spectroscopy | Pharmatutor». بایگانیشده از اصلی در ۲۷ ژانویه ۲۰۱۱. دریافتشده در ۳۱ مه ۲۰۱۱.
- «Science - water, effects, environmental, pollutants, United States, causes, EPA, soil, pesticide, chemicals, industrial, liquid, toxic, human, power, use, life». بایگانیشده از اصلی در ۲۰ مه ۲۰۱۱. دریافتشده در ۳۱ مه ۲۰۱۱.
- etd.ohiolink.edu/send-pdf.cgi/LI%20JrHung.pdf?ucin990736063
- «نسخه آرشیو شده». بایگانیشده از اصلی در ۳۰ ژوئیه ۲۰۱۶. دریافتشده در ۱۳ ژوئن ۲۰۱۶.