تشدید پارامغناطیسی الکترون
تشدید پارامغناطیس الکترون (به انگلیسی: Electron paramagnetic resonance یا EPR) یک تکنیک طیفبینی آشکار کنندة مواد دارای الکترون جفتنشده است. لذا غالباً ESR ( تشدید اسپین الکترون ) نیز نامیده میشود. آزمایش تشدید پارا مغناطیس الکترون EPR، را میتوان به صورت جذب تشدیدی انرژی ماکروویو در گونههای پارا مغناطیس بوسیلة گذار اسپین یک الکترون جفتنشده از یک تراز انرژی به تراز انرژی بعدی در حضور یک میدان مغناطیسی قوی تعریف کرد . اولین تجربة EPR بوسیلة زاویسکی در سال ۱۹۴۵ انجام شد. EPR اسپکتروسکپی به دو روش پالسی و پیوسته انجام میشود.
آشنایی با کارکرد
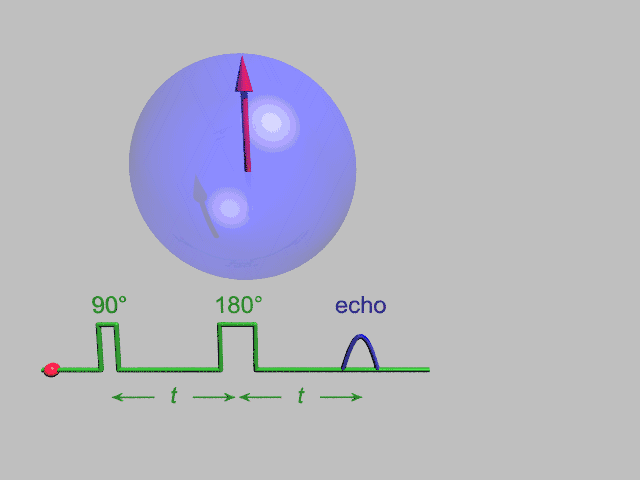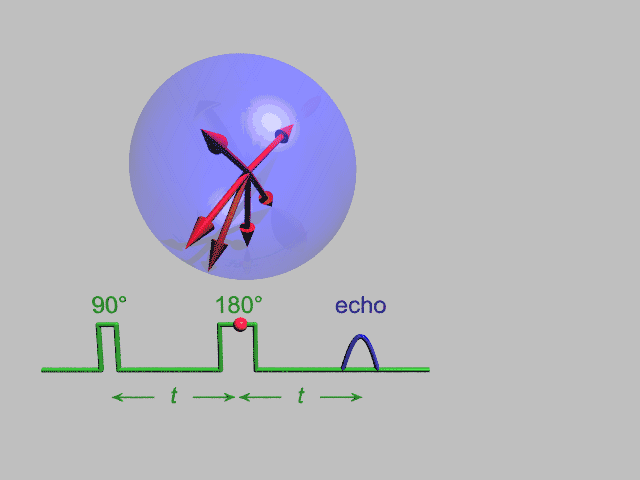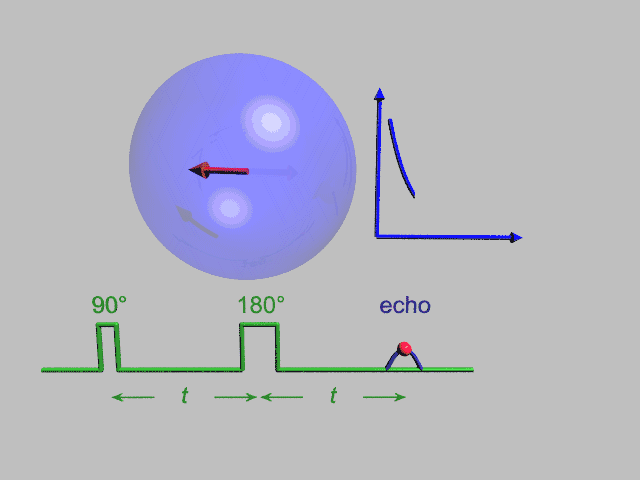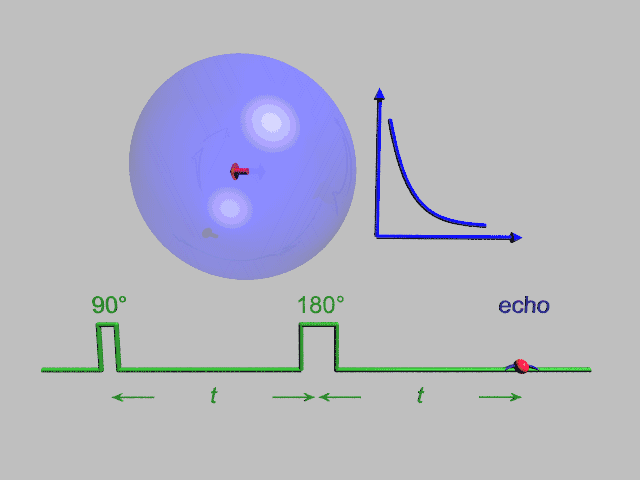
EPR یک تکنیک تشدید مغناطیسی شبیه NMR، تشدید مغناطیسی هسته، است. با این تفاوت که بجای گذارهای هسته ای در نمونه گذارهای الکترون جفتنشده را در میدان مغناطیسی مورد آشکارسازی قرار میدهد. ممان مغناطیسی رفتار الکترون را همانند یک میلة آهنربای کوچک میکند. هنگام فراهم آمدن یک میدان مغناطیسی خارجی، الکترونهای پارامغناطیس میتوانند در یک راستای موازی به صورت هم جهت و خلاف جهت میدان مغناطیسی اعمالی قرار گیرند. بدین سبب دوسطح انرژی مجزا برای الکترونهای جفتنشده به وجود می آید، که در وهلة اول تعداد آنها که در خلاف جهت هستند بیشتر از آنهایی که هم جهت هستند خواهد بود. با به کار بردن یک فرکانس ثابت از تشعشع ماکروویو تعدادی از الکترونهای سطح انرژی پایین به سطح انرژی بالا برانگیخته میشوند. برای اتفاق افتادن این گذار باید میدان مغناطیسی خارجی با یک قدرت خاص وجود داشته باشد . آنچنانکه اختلاف سطح انرژی بین سطح پایین و بالایی دقیقاً با فرکانس ماکروویو هماهنگ باشد . برای رسیدن به چنین شرایطی مقادیر مختلف میدان مغناطیسی را با ثابت نگاه داشتن فرکانس ماکروویو جاروب میکنیم . در شرایطی که میدان مغناطیسی و فرکانس موج ماکروویو کاملاً منطبقند شرایط تشدید محقق میشود.
EPR تنها وسیله ای است که قادر به آشکار سازی الکترون جفتنشده به صورت تمایز ناپذیر میباشد . دیگر روشها مثلاً فلورسانس ممکن است شواهد غیر مستقیمی از رادیکالهای آزاد فراهم آورند ولی EPR دارای توانایی بی مانندی در شناسایی ویژگیی پارامغناطیس میباشد . نمونههای EPR نسبت به شرایط محیطی حساس میباشند، لذا قابلیت مشخص نمودن ساختار مولکولی نزدیک به الکترون جفت نشده را فراهم می آورد. بعضی از مواقع طیف EPR تغییرات شکلی عجیبی را نمایش میدهد که بیانگر فرایندهای دینامیکی همچون حرکت یاجریان مولکولهاست.
کاربرد
تعداد زیادی از مواد، دارای الکترون جفتنشده میباشند که مشتمل بر رادیکالهای آزاد تجزیه و واکنشهای پلیمری هستند . در نتیجه EPR در شاخههای زیادی مورد استفاده قرار میگیرد، از جمله: شیمی، فیزیک، بیولوژی، علم مواد، پزشکی و غیره.. . تکنیک EPR برای آشکارسازی رادیکالهای آزاد فعال با زمان بقای کم درحوزة زیست پزشکی برای شفاف نمودن نقش رادیکالهای آزاد در مسمومیتها و امراض نقش حیاتی دارد.
بیوشیمیستها با برچسب زدن بر مولکولهای بزرگ توسط یک مولکول پارا مغناطیس از طیف EPRارسال شده (بوسیلة علامت گذاری اسپین) به نوع محیطی که در آن علامت گذاری اسپین انجام پذیرفتهاست پی میبرند (PH، جریان، آبدوستی).
ESEEM، ENDOR دو روش EPR هستند که بر همکنش الکترون با هستههای اطراف را اندازه میگیرند و در بررسی ساختار قسمتهای فعال پروتوئینها فوق العاده تکنیکهای قویی میباشند.
دیگر کاربرد مهم EPR در دزیمتری اشعه است که شامل اندازه گیری دز بکار رفته در استرلیزه کردن وسایل پزشکی و آشکار نمودن غذاهای اشعه دیده است.
رادیکالهای آزاد
تمامی مواد یا محلولهایی که در لایة آخر انرژی خود دارای تعداد فردی از الکترون هستند؛ اسپین غیر صفر داشته و به مواد پارامغناطیس معروف میباشند. زیرا هر لایة انرژی یا به عبارت دیگر هر حالت کوانتومی خاص، میتواند دارای دو الکترون با اسپینهای مخالف جهت باشد. به طوریکه اسپین کل آن حالت (طبق اصل طرد پاولی) صفر شود. اما اگر در یک لایة انرژی تعداد فردی الکترون داشته باشیم، یک زیر لایة این حالت دارای تک الکترون خواهد بود واین الکترون دارای اسپین خالص s=۱/۲ و مؤلفه z اسپین Sz =+۱/۲ یا = -۱/۲ Sz خواهد بود. بنابراین اسپین کل سیستم اصطلاحاً صفر نبوده و دارای مقدار خاصی خواهد بود.
رادیکالهای آزاد موادی هستند که این خاصیت را دارند. یک رادیکال آزاد، یک اتم یا گروهی از اتمها یا مولکولها در حالت خاصی میباشند که دارای یک الکترون تک در اربیتال بالایی (نهائی) هستند. برای مثال اتم هیدروژن H، یا هیدروکسیل HO، متیل .H۳C رادیکالهای آزاد معمولاً موادی بسیار فعال میباشند که شدیداً به اشتراک گذاشتن الکترون تک خود و تشکیل ترکیبی جدید علاقهمندند. اما برخی از رادیکالهای آزاد هم مانند نیتروژن مونواکسیدNo ، نیتروژن دی اکسید No۲ و کلر دی اکسیدClo۲، دارای حالت پایدار میباشند.
یک رادیکال دو گانه ماده ای است که دو الکترون زوج نشده در لایة نهائی انرژی خود دارد. مانند O۲،H۲C. یک یون رادیکال، رادیکال آزادی با بار الکتریکی مثبت یا منفی است. مانند یون امونیاکH۳n+ همچنین ماده ای مانند آلانین. این ماده هنگامی که به هر دلیل مثل تابش الکترون یا تابش گاما، یونیزه شده و تبدیل به یون رادیکال اتانوییک اسید CH۳HOO میشود پایداری بسیار طولانی مدت دارد به طوریکه در اندازه گیریهای در حد سال باز هم وجود این رادیکال تشخیص داده شدهاست.
همچنین بعضی از یونهای فلزات میانه دارای الکترون زوج نشده در اربیتالهای داخلی خود میباشند که در نتیجه خواص رادیکالهای آزاد را از خود نشان میدهند. این مواد و ترکیباتشان همگی خاصیت پارامغناطیس داشته و مانند رادیکالهای آزاد رفتار میکنند.
جستارهای وابسته
- امآرآی
- تشدید مغناطیسی هستهای
- تشدید اسپین میون
