تراز انرژی
در مکانیک کوانتومی سیستم یا ذره تنها میتواند میزان معینی انرژی دریافت نماید که این موضوع در مکانیک کلاسیک معکوس است. این میزان معین انرژی تراز انرژی نام دارد. تراز انرژی همچنین برای اشاره به الکترونهای درون اتم که در حوضهٔ الکتریکی هستهٔ اتم قرار دارند نیز اشاره میشود همچنین این عبارت میتواند به معنای تراز انرژی هسته و تراز انرژی لرزشی و چرخشی در مولکولها استفاده شود. بنا به اصل طرد پائولی در یک سیستم با برهمکنش معین هیچ دو الکترونی نمیتوانند دارای حالت کوانتومی یکسان باشند. پس باید ترازهای انرژی مجزا از اتمهای منفرد به ترازهای جدید متعلق به هر دو اتم و نه یکی آنها تقسیم شوند.
اگر انرژی پتانسیل در فاصلهٔ بینهایت از هستهٔ اتم یا مولکول صفر باشد، در این حالت الکترونهای ثابت (به انگلیسی: Bound state) دارای پتانسیل منفی خواهند بود.
اگر بیش از یک حالت کوانتومی کلاسیک انرژی برابر با هم داشته باشند، اصطلاحاً گفته میشود که ترازهای انرژی رو به انحطاط گذاردهاند که منجر به ایجاد چندگانگی میشود.
تبهگنی یا واگنگی(Degenerate): اگر به یک تراز انرژی،دو یا چند تابع موج متمایز،متناظر شود میگوییم تراز انرژی تبهگن است.
برای مثال:اگر(n=n(1)+n(2 و E(n)=(n+1)h*w به ازای (n(1)=1 و n(2)=0) یا (n(1)=0 و n(2)=1) تنها یک مقدار انرژی E=2*h*w بدست میدهد ولی دو تابع متفاوت حاصل میشود، لذا این تراز انرژی تبهگنی دوگانه دارد.
ترازهای انرژی تدریجی حاصل رابطهٔ میان انرژی ذرهها و طول موج آنها است. این رابطه نخستین بار در سال ۱۸۰۰ مشاهده شد و توسط نیلز بور دانشمند دانمارکی در سال ۱۹۱۳ ثبت شد و در سال ۱۹۲۶ توسط دو دانشمند آلمانی کامل گشت.
اتمها
تراز انرژی اربیتالی (یون یا اتم به علاوهٔ الکترون و هسته)
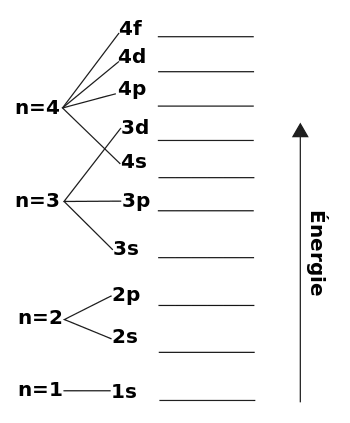
با تصور الکترونی که درون اتم هیدروژن به دور هسته میچرخد. انرژی این الکترون از تأثیر الکترواستاتیکی الکترون منفی و هستهٔ مثبت به دست میآید. تراز انرژی الکترون دور هسته از رابطهٔ زیر به دست میآید:
(معمولاً بین ۱ eV and 10۳ eV)
- is the ثابت ریدبرگ
- Z is the عدد اتمی
- n is the اعداد کوانتومی اصلی
- is ثابت پلانک
- c is the سرعت نور
برای اتمها یا یونها یی مشابه با هیدروژن تراز ریدبرگ تنها به اعداد کوانتومی اصلی () بستگی دارد.
اتمهای چند الکترونی شامل تعامل الکترواستاتیک الکترون با الکترونهای دیگر هستند بنابراین رابطهٔ به دست آوردن تراز انرژی یک الکترون این اتم به این صورت است:
Zeff که عدد اتمی به دلیل وجود الکترونهای بیشتر و اثرات بار مؤثر هسته تغییر کردهاست.
در ساختارهای عالی ترازهای انرژی به صورت متوالی به میزان eV تفییر میکنند.
اثر زیمان
انرژی تعاملی همراه با لحظهٔ دو قطبی مغناطیسی (μL) (به انگلیسی: magnetic dipole moment) وجود داد که به دلیل حرکت زاویهای مداری الکترونیکی (L) (به انگلیسی: orbital angular momentum) به وجود میآید. حرکت زاویهای مداری الکترونیکی از روابط زیر به دست میآیند:
به همراه
نمودارهای سطوح انرژی
انواع گوناگونی از نمودار سطح انرژی برای پیوند بین اتمها در یک مولکول وجود دارد، برای مثال نمودار فرانک-کاندون که مرتبط با اصل فرانک-کاندون است.
در مولکولها
وضعیت انرژی مولکولی (به انگلیسی: molecular energy state) مجموع اجزای الکترونیکی (electronic)، ارتعاشی (vibrational)، چرخشی (rotational)، هستهای (nuclear)، و انتقالی (translational) مولکول است، بهطوریکه طبق رابطهٔ زیر حاصل میشود:
جایگاه الکترون در اتم
الکترونها در جامدات به انرژیهای معینی محدود شده و مجاز به قرار گرفتن در انرژیهای دیگر نیستند. تفاوت اساسی بین الکترون در یک جامد با الکترون در یک اتم جدا شده، این است که در جامد الکترون دارای یک گستره یا تراز از انرژیهای قابل دسترس است. زیرا در جامد توابع موج الکترونی اتمهای همسایه همپوشانی داشته و یک الکترون در یک اتم خاص قرار ندارد. طبیعتاً این تأثیر بر انرژی پتانسیل و شرایط مرزی در معادله موج اثر میگذارد و سبب میشود، انرژیهای مختلفی بدست آورده و دو نوع تراز انرژی به نام تراز ظرفیت و هدایت داشته باشیم، که توسط انرژی شکاف یا باند همسویی از یکدیگر جدا شدهاند.
گذار الکترونی مجاز بین ترازی
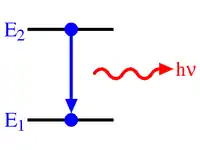
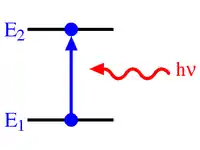
زمانی که یک اتم از خارج انرژی دریافت میکند این انرژی در بستههای دقیقاً معین کوانتا جذب اتم میگردد و الکترونها به مدارهای دورتر از هسته به سطوح انرژی بالاتر جابهجا میشوند و جذب بیشتر کوانتای انرژی به وسیله اتم باعث انتقال بیشتر الکترون از هسته میگردد. این حالت که اتم به صورت تحریک شده درآمده نمیتواند برای مدت طولانی دوام بیاورد و با برگشتن الکترون به حالت قبلی اتم نیز به حالت عادی خود بر میگردد. قسمت زیادی از انرژی الکترون تحریک شده به صورت کوانتایی از اشعه الکترومغناطیس پخش میشود زمانی که این انتقال الکترونی در خارجیترین لایهها انجام گیرد که انرژی اتصال الکترون به هسته کمترین مقدار است، کوانتای اشعه مادون قرمز، نورمرئی یا اشعه ماورای بنفش پخش میگردد. در زمانی که الکترونها به اربیتالهای نزدیک هسته منتقل شوند (برای مثال پرش به یک یا چند مدار) کوانتای پر انرژی تری از تشعشعات الکترومغناطیسی «اشعه ایکس محتوی انرژی چند برابر بیشتر از تابش مادون قرمز و ماورای بنفش) منتشر میشود.
قوانین حاکم بر حرکت الکترون
در طی مطالعات زیاد معلوم شده که قوانین حرکتی اثبات شده برای مواد بزرگ را نمیتواند بهطور کامل برای الکترونهای داخل اتم به کار رود. در اجسامی که یکصد میلیونیم سانتیمتر بعد دارند به کلی قوانین متفاوتی مطرح میشود. در مقایسه با منظومه شمسی یا هر سیستم مکانیکی عظیمالجثهای که میتواند با توجه به سرعت اولیه اش در هر مسیری حرکت کند.
الکترونها در اتم مجبورند که فقط در طول مدارهایی حرکت کنند که مربوط به مقادیر معین انرژی و همان مغناطیسی آنها میشود. بهطوریکه الکترون نمیتواند مقادیر دیگری انرژی را جز مقادیر یادشده داشته باشد. طبیعت منفرد و غیر متوالی مکان الکترونها در مدارها یا بهطور دقیق تر وجود مقادیر دقیقاً معین از انرژی در اتم یکی از خواص اساسی تئوری مکانیک کوانتومی است. بر طبق تئوری کوانتومی انتقال یک الکترون از یک مدار به مدار دیگر یعنی از یک حالت انرژی به حالت دیگری از انرژی در اتم با جذب یا پخش یک بار انرژی دقیقاً معین همراه است. اگر یک حالت معین انرژی به وسیلهٔ یک الکترون اشغال شود، الکترون دیگر نمیتواند آن را اشغال نماید و یک اتم نمیتواند دو الکترون با حالت انرژی یکسان داشته باشد. از تمام حالات ممکنی که یک الکترون میتواند در یک اتم داشته باشد در اولین حالت آن الکترون کمترین مقدار انرژی را داشته در نتیجه به شدت جذب هسته شده و در داخلیترین مدار الکترونی نزدیک به هسته متمرکز میگردد. بنابر این، همه الکترونها نمیتوانند در یک سطح انرژی متمرکز شوند و هر الکترون بعدی سطح انرژی بیشتری را اشغال کرده و بقیه سطوح غیراشغال شده باقی میمانند. این قانون که نشان دهنده پخش الکترون در تمام عناصر به ترتیب افزایش انرژی میباشد، حالت کوانتومی نام دارد. خواص شیمیایی یک اتم بستگی به مقدار و ترتیب الکترونها در مدار الکترونی دارد.
نوار انرژی شبکه اتمی
در شبکه اتمی هر الکترون میتواند فقط در سطوح انرژی باشد، و در ناحیه ممنوعه (ناحیهای که ما بین تراز ظرفیت و تراز هدایت است) هیچ الکترونی یافت نمیشود. یونیزاسیون مکانیسمی است که در آن الکترون میتواند پس از کسب انرژی کافی، از اتم خود جدا شده و در تراز هدایت به الکترونهای آزاد بپیوندد.
نوارهای انرژی عایق
در مواد عایق گاف انرژی بین نوار ظرفیت و نوار هدایت حدود ۵ الکترون ولت یا بیشتر است، و این شکاف عظیم قادر خواهد بود به میزان قابل توجهی از حضور الکترون در تراز هدایت، در دمای اتاق جلوگیری کند.
نوارهای انرژی نیم رسانا
در اجسام نیم رسانا شکاف انرژی برای سیلسیوم ۱٫۱ الکترون ولت و برای ژرمانیوم ۰٫۶۷ الکترون ولت میباشد، یعنی یک الکترون و نوار ظرفیت قادر خواهد بود با کسب این مقدار انرژی باند ظرفیت را ترک نموده، با طی نمودن گاف انرژی خود را به تراز هدایت یا رسانش رسانده و به عنوان الکترون آزاد برای برقراری جریان الکتریکی مؤثر باشد.
نوارهای انرژی رسانا
برای اجسام رسانا بین تراز ظرفیت و تراز هدایت شکافی وجود ندارد، و این ترازها روی هم منطبق شده و دارای باند مشترک میباشند. یعنی یک رسانا حتی در صفر درجه کلوین نیز دارای الکترون در باند هدایت است؛ بنابراین در دمای اتاق تعداد الکترونهای آزاد برای برقراری جریان یا حرکت بارها بیش از حد مورد نیاز موجود میباشد.
بلورها
به مواد معدنی جامدی که اجزای سازندهٔ آنها (مولکول، اتم یا یونها) در سه جهت فضایی به صورت منظمی کنار هم قرار گرفته باشند یا دارای نظم بلورشناسی باشند، کریستال یا بُلور میگویند. ساختارهای بلورین نظم بلند دامنه داشته و میتواند خواص همسانگرد یا ناهمسانگرد داشته باشد. به نظر میرسد که بلورها ترازهای انرژی ندارند بلکه دارای نوارها انرژی هستند که در آن تنها الکترونهایی که نوار خال دارند میتوانند انرژی را جذب کنند.
