ارتعاش مولکولی
ارتعاش مولکولی (به انگلیسی: Molecular vibrations) هنگامی رخ میدهد که اتمها در یک مولکول در حرکت دورهای باشند. در حالی که بهطور کلی مولکولها دارای حرکت ثابت و حرکت چرخشی هستند. فرکانس حرکت دورهای به عنوان فرکانس ارتعاش شناخته میشود. فرکانسهای معمولی از لرزشهای مولکولی از 1013 تا 1014 Hz متفاوت است که مربوط به طول موج حدود ۳۰۰ تا ۳۰۰۰ سانتیمتر است.
بهطور کلی یک مولکول با N اتم دارای 3N-۶ حالت طبیعی ارتعاش است، اما یک مولکول خطی دارای 3N-۵ حالت ارتعاش است. (زیرا چرخش در محور مولکولی آن مشاهده نمیشود) یک مولکول دو اتمی دارای یک حالت عادی ارتعاش است.
ارتعاشات مولکولی هنگامی رخ میدهد که پیوندهای درون یک مولکول و اتمها آن شروع به ارتعاش کنند و این اتفاقات با جذب انرژی توسط مولکول انجام میشود.
ارتعاشات مولکولهای قطبی و ناقطبی متفاوت است. حالتهای عادی ارتعاش مولکولهای قطبی مستقل از یک دیگر هستند، اما هر حالت عادی شامل ارتعاشات همزمان از قسمتهای مختلف مولکول (مانند پیوندهای شیمیایی مختلف) است.
انرژی جذب شده به صورت کوانتومی میباشد، در نتیجه هنگامی که مولکول یک کوانتومانرژی (E) را جذب کند، ارتعاش مولکولی رخ میدهد.E باتوجه به فرکانس لرزش،v، و رابطه پلانک E=hv (در اینجا h،ثابت پلانک) محاسبه میشود.
یک ارتعاش به هنگام جذب انرژی توسط مولکول درحالت پایه اتفاق میافتد. (به حالت پاییه توجه شود). وقتی پیوند دو کوانتوم انرژی جذب میکند، صوت اول پیوند تحریک میشود و به همین ترتیب صوتهای بالاتری تحریک میشوند. تقریباً، حرکت ارتعاشی عادی را میتوان به صورت حرکت نوسانگر هماهنگ ساده در نظر گرفت.
در این تقریب، معادله انرژی ارتعاشی به صورت یک تابع درجه دوم است.
اما در واقعیت این حرکت مانند حرکت نوسانگر هماهنگ ساده نیست و صوت اول این حرکت، فرکانسش کمی کمتر از دو برابر فرکانس اساسی است.
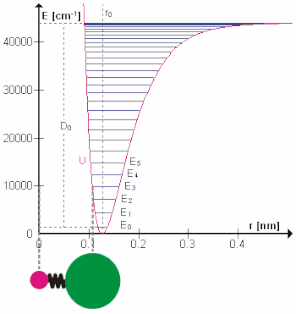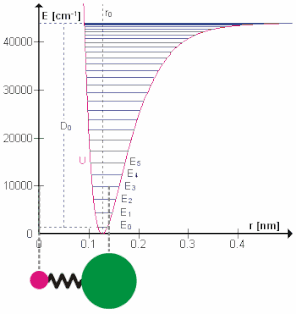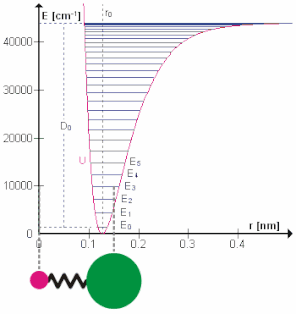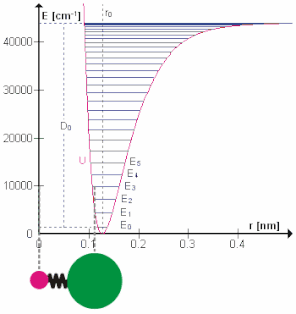
تعداد حالتهای ارتعاشی
برای یک مولکول با N اتم، موقعیت تمام اتمها به مجموع 3N مختصات بستگی دارد، به طوری که مولکول دارای 3N درجه آزادی (از جمله حرکت انتقالی، حرکت چرخشی و حرکت ارتعاشی) است. به این معنی که مرکز جرم دردستگاه مختصات دکارتی سه جهت برای حرکت دارد. هر مولکول غیر خطی، میتواند حول هر کدام از محور هایدستگاه مختصات دکارتی بچرخد، بنابراین دارای ۳ درجه آزادی چرخشی است. برای مولکولهای خطی، در محور مولکول حرکت چرخشی شامل حرکت هستهها نمیشود، بنابراین فقط دو درجه آزادی وجود دارد که میتواند مختصات اتمی را تغییر بدهد. یک معنای دیگ از چرخش مولکولهای خطی را میتوان به این صورت بیان کرد که چرخش یک مولکول خطی زمانی رخ میدهد که جهت محور مولکولی درفضای سه بعدی تغییر پیدا کند. چرخش جهت محور مولکول باعث تغییر در هسته اتمها نمیشود، به همین دلیل دو محور چرخش برای مولکول در حال خطی داریم. در نتیجه تعداد حالتهای ارتعاشی برابر 3N منهای تعداد حالتهای آزاد چرخشی میشود. برای مولکولهای خطی برابر 3N-۵ و برای مولکولهای غیر خطی برابر 3N-۶ میشود. مختصات ارتعاشی مختصات یک ارتعاش طبیعی، ترکیبی از تغییر موقعیت اتمها در مولکول است. هنگامی که ارتعاش اتفاق میافتد، اتمها به صورت سینوسی با فرکانس v شروع به حرکت میکنند.
انواع ارتعاش در مختصات داخلی
انواع حرکتهای ارتعاشی را با توجه به مولکول مسطح اتیلن در زیر توضیح خواهیم داد.
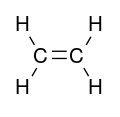
- کشش (stretching): تغییر طول در پیوندها (برای مثال تغییر طول پیوندهای C-H یا C-C)
- خم کردن (bending): تغییر زاویه بین دو پیوند در مولکول (برای مثال تغییر زاویه پیوند HCH در گروه متیلن را میتوان در نظر گرفت)
- تغییر زاویه(rocking):تغییر زاویه بین یک قسمت از مولکول و قسمتهای دیگر (برای مثال تغییر زاویه بین یک گروه متیلن و بقیه مولکول در مولکول متیلن)
- wagging: تغییر زاویه بین سطح یک گروه از اتمها و بقیه مولکول (مانند تغییر زاویه یک گروه متیلن و صفحه بقیه مولکولها)
- پیچش (twisting): تغییر زاویه بین صفحههای دو گروه از اتمها (مانند زاویه بین دو گروه متیلن در مولکول اتیلن)
- خارج از صفحه (out of plane): تغییر زاویه بین یک پیوند و صفحه سایر اتمها (برای مثال تغییر زاویه بین پیوند C-H و صفحه بقیه اتمهای مولکول)
(یک مثال دیگر: حرکت اتم بور به داخل و خارج صفحه در مولکول بور تری فلویورید از این نوع حرکت میباشد)
در نتیجه در مولکول اتیلن ۱۲ ارتعاش در مختصات داخلی وجود دارد که به صورت زیر است.
۴ ارتعاش کششش C-H و یک ارتعاش کششی برای C-C، دو ارتعاش خمشی H-C-H، دو ارتعاش rocking برای CH2 و ۲ ارتعاش wagging برای CH2 و یک پیچش.
توجه کنید که تغییر زاویه H-C-C نمیتواند به عنوان مختصات داخلی استفاده شود، زیرا هر دو اتم کربن همزمان با هم نمیتوانند تغییر زاویه پیدا کنند.
ارتعاشات اتمی در ساختار بلوری مواد جامد
هراتم در ماده جامد به سرعت در حال ارتعاش، در حول موقعیت شبکه ای خود در بلور است. از یک جهت، میتوان ارتعاشات اتمی را به صورت عیب در نظر گرفت. در هر لحظه از زمان، تمامی اتمها با یک فرکانس، دامنه و انرژی ارتعاش نمیکنند. در یک دمای معین، نوعی توزیع انرژی برای اتمهای سازنده در نزدیکی میانگین انرژی وجود دارد. با گذشت زمان، انرژی ارتعاشی هر اتم خاص به صورت تصادفی تغییر میکند. با افزایش دما، این میانگین انرژی افزایش میابد و در واقع دمای یک جامد میتواند به عنوان معیاری جهت اندازهگیری میانگین فعالیت ارتعاشی اتمها و مولکلها در نظر گرفته شود. در دمای اتاق فرکانس ارتعاشی متداول، حدود 1013 ارتعاش در ثانیه بوده و این در حالی است که دامنه ارتعاش تنها چند هزارم نانومتر است. بسیاری از خواص و فرایندها در جامدات در واقع تجلی این حرکت اتمی ارتعاشی هستند. برای مثال، پدیده ذوب هنگامی اتفاق میافتد که ارتعاشات اتمی برای گسیختن تعداد زیادی از پیوندهای اتمی کافی باشد.
مثال برای ارتعاشات اتمی
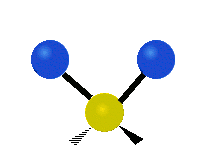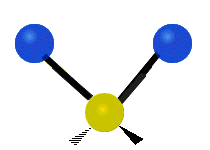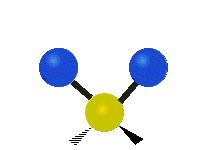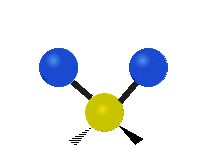
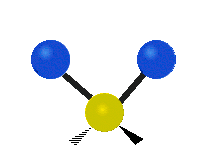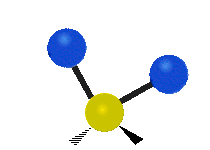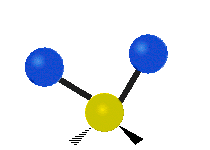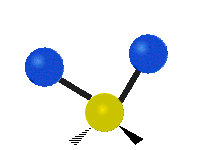
ارتعاش یک گروه متیلن (-CH2-) در یک مولکول به صورت زیر است. اتمها در گروه CH2، که ترکیب آلی محسوب میشود، به صورت ۶ راه متفاوت، ارتعاش میکنند. کشش متقارن و کشش نامتقارن، به صورت برشی و پیچش و تغیر زاویه داخل صفحه (wagging) و تغییر زاویه بین دو قسمت از یک مولکول (rocking).
| کشش متقارن | کشش نامتقارن | خم شدن |
|---|---|---|
 |
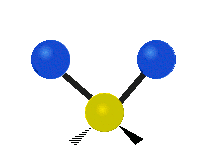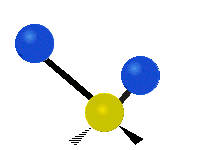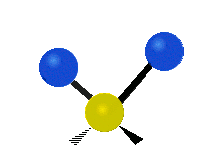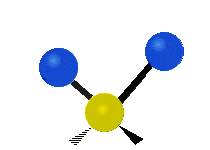 |
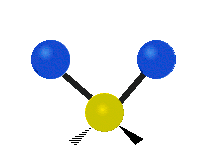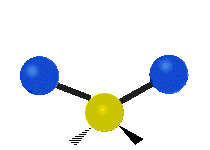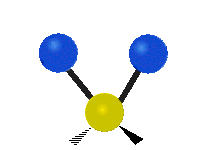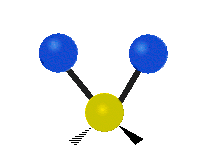 |
| حرکت هماهنگ | چرخشی داخل صفحه | چرخشی خارج از صفحه |
 |
 |
 |
پانویسها و منابع
- material science callister
- «Molecular_vibration». wikipedia.com.
- Sherwood, P. M. A. (1972). Vibrational Spectroscopy of Solids. Cambridge University Press. ISBN 0-521-08482-2.
