هیدرازین
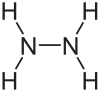
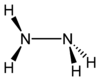
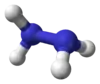
هیدرازین (Hydrazine) یک ترکیب شیمیایی با فرمول مولکولی N۲H۴ است. هیدرازین بیشتر در سوخت موشک و فراوردههای تنباکو کاربرد دارد.
| هیدرازین | |||
|---|---|---|---|
| |||
| |||
 Hydrazine hydrate | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۳۰۲-۰۱-۲ | ||
| پابکم | ۹۳۲۱ | ||
| کماسپایدر | ۸۹۶۰ | ||
| UNII | 27RFH0GB4R | ||
| شمارهٔ ئیسی | 206-114-9 | ||
| شمارهٔ یواِن | 2029 | ||
| KEGG | C05361 | ||
| MeSH | Hydrazine | ||
| ChEBI | CHEBI:15571 | ||
| ChEMBL | CHEMBL۱۲۳۷۱۷۴ | ||
| شمارهٔ آرتیئیسیاس | MU7175000 | ||
مرجع بیلشتین |
878137 | ||
مرجع جیملین |
190 | ||
| 3DMet | B00770 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
SMILES
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | N 2H 4 | ||
| جرم مولی | 32.0452 g·mol-1 | ||
| شکل ظاهری | Colorless fuming oily liquid[3] | ||
| بوی | Ammonia-like[3] | ||
| چگالی | 1.021 g·cm-3 | ||
| دمای ذوب | ۲ درجه سلسیوس؛ ۳۵ درجه فارنهایت؛ ۲۷۵ کلوین | ||
| دمای جوش | ۱۱۴ درجه سلسیوس؛ ۲۳۷ درجه فارنهایت؛ ۳۸۷ کلوین | ||
| انحلالپذیری در آب | Miscible[3] | ||
| log P | 0.67 | ||
| فشار بخار | 1 kP (at 30.7 °C) | ||
| اسیدی (pKa) | 8.10 (N2H5+)[4] | ||
| خاصیت بازی (pKb) | 5.90 | ||
| ضریب شکست (nD) | 1.46044 (at 22 °C) | ||
| گرانروی | 0.876 cP | ||
| ساختار | |||
| شکل مولکولی | Triangular pyramidal at N | ||
| گشتاور دوقطبی | 1.85 D[5] | ||
| ترموشیمی | |||
آنتروپی مولار استاندارد S |
121.52 J·K-1·mol-1 | ||
آنتالپی استاندارد تشکیل ΔfH |
50.63 kJ·mol-1 | ||
| خطرات | |||
| GHS pictograms |  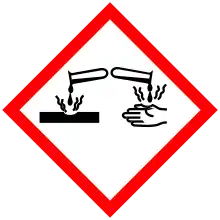    | ||
| سیستم هماهنگ جهانی طبقهبندی و برچسبگذاری مواد شیمیایی | DANGER | ||
| GHS hazard statements | H226, H301, H311, H314, H317, H331, H350, H410 | ||
| GHS precautionary statements | P201, P261, P273, P280, P301+310, P305+351+338 | ||
| لوزی آتش | Error: imagemap_invalid_title | ||
| نقطه اشتعال | |||
| دمای خودآتشگیری | |||
| محدودیتهای انفجار | ۱٫۸–۹۹٫۹۹٪ | ||
| آمریکا Permissible exposure limit (PEL) |
TWA 1 ppm (1.3 mg/m3) [skin][3] | ||
| LD50 | 59–60 mg/kg (oral in rats, mice)[6] | ||
| ترکیبات مرتبط | |||
| دیگر آنیونها | Tetrafluorohydrazine Hydrogen peroxide Diphosphane Diphosphorus tetraiodide | ||
| دیگر کاتیونها | Organic hydrazines | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
فرآوری
تئودور کورتیوس هیدرازین برای نخستین بار در سال ۱۸۸۹ میلادی به دست آورد.
در روش چرخه Atofina-PCUK ، هیدرازین در چند گام از استون، آمونیاک و هیدروژن پراکسید به دست میآید. نخست استون و آمونیاک با هم واکنش میدهند تا ایمین به دست آید که با اکسید کردن آن به کمک هیدروژن پراکسید، اگزادیرین به دست میآید.این حلقهٔ سه هموند(عضو)ی که دارای کربن، اکسیژن وازت میباشداز راه آمونیوکافت که دواتم ازت را به هم پیوند میدهد به هیدرازون دگرگون تبدیل میشود.این هیدرازون با چند برابر استون واکنش داده وآذین به دست میآید که با آبکافتکردن آن میتوان هیدرازین به دست آورد. در این گام استون دوباره آزاد میشود.
کاربرد در شیمی
در بسیاری از واکنشهای ساخت مادههای آلی و به ویژه در ساخت بسیاری از داروها و رنگ کردن بافتهای پارچهای وعکسبرداری کاربرد دارد.
تشکیل هیدرازون
برای نمونه فشردهسازی هیدرازین با یک کربونیل ساده مانند استون یک آذین میدهد. اگر این آذین دوباره با هیدرازین واکنش دهد هیدرازون به دست میآید :
- ۲ (CH۳)۲CO + N۲H۴ → ۲ H۲O + [(CH۳)۲C=N]۲
- [(CH۳)۲C=N]۲ + N۲H۴ → ۲ (CH۳)۲C=NNH۲
در واکنش بالا «استون آذین» یک فراوردهٔ میانجی(حد واسط) بوده و واکنش تا به دست آمدن هیدرازون انجام میشود. مهار واکنش در گام نخست بشتر زمانها شدنی نیست و برای فرآوری آلکیل هیدرازین بهتر است از کاهش فراورده سود جست.
کاهش ولف-کیشنر
هیدرازین در واکنش کاهش ولف-کیشنر نیز به کاربرده میشود. در این واکنش گروه کربونیل کتونها یاآلدهیدها با کمک هیدرازون به گروههای متیلن یا متیل کاهش مییابد .
نمکهای هیدرازینیم
هیدرازین در واکنش با اسیدهای معدنی نمک هیدرازینیوم میدهد که نامورترین نمک آن سولفات آن با فرمول[N۲H۵]HSO۴ است.
سولفون دار کردن
چون هیدرازین یک هسته دوست خوب است میتواند به آسانی یه سولفونیل هالیدها وآسیل هالیدها بتازد(حمله کند).
ساخت ناجورحلقهها
ازهیدرازین با داشتن ۲ آمین میتوان برای ساخت ترکیبهای ناجور حلقه(ناجور حلقه))، از راه چگالش یا فشردهسازی همراه الکترون دوستها، به کار برد. فشردهسازی هیدرازین با ۲٬۴-پنتان دیون، دی متیل پیرازول میدهد.
کاربردهای فیاری(صنعتی) دیگر
هیدرازین در بسیاری از فرایندها ی شیمیایی به کار میرود که برای نمونه باره(مورد)های زیر را آوردهایم:
- ساختاسپاندکس(گونهای از کاموای پلاستیکی)از فیبرها
- برای کاتالیز واکنش هایبسپارسازی(پلیمر کردن).
- باتری سوختی.
- لحیم کاری.
- گسترندهٔ واکنش زنجیری بسپارسازی اورتان.
- حذف اکسیژن در دیگهای بخار و جلوگیری از خوردگی لولههای دیگ بخار
همچنین شاید برای ساخت ترانزیستور پردهای نازک که در نمایشگر کریستال مایع کاربرد دارند؛ کاربرد داشته باشد.
سوخت موشک
هیدرازین درجنگ جهانی دوم تحت خانواده موادّ ب-اشتوف به عنوان سوخت موشک به کار رفت. در آن موشک هیدرات هیدرازین همراه با متانول به کار رفته بود.
ایمنی
هیدرازین بسیار سرطان زا است و هیدرازین بی آب بسیار ناپایدار میباشد.
منابع
- "hydrazine—PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- "NIOSH Guide—Hydrazine". Centers for Disease Control. Retrieved 16 Aug 2012.
- NIOSH Pocket Guide to Chemical Hazards 0329
- Hall HK, et al. (1957). "Correlation of the Base Strengths of Amines1". J. Am. Chem. Soc. 79 (20): 5441. doi:10.1021/ja01577a030.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- Martel B, Cassidy K, et al. (2004). Chemical Risk Analysis: A Practical Handbook. Amsterdam: Butterworth–Heinemann. p. 361. ISBN 9781903996652. OCLC 939257974.
| در ویکیانبار پروندههایی دربارهٔ هیدرازین موجود است. |
- Wikipedia contributors, "Hydrazine", Wikipedia, The Free Encyclopedia, http://en.wikipedia.org/wiki/Hydrazine(accessed ۱۱:۴۷ ب.ظ ۲۰۰۶/۰۸/۲۱)