نیتروژن
نیتروژن (به انگلیسی: Nitrogen) یا ازت (به فرانسوی: Azote) یکی از عنصرهای شیمیایی در جدول تناوبی است که نشان شیمیایی آن N و عدد اتمی آن ۷ است. نیتروژن معمولاً به صورت یک گاز، نافلز، دو اتمی بی اثر، بیرنگ، بیمزه و بیبو است که ۷۸٪ جو زمین را دربر گرفته و عنصر اصلی در بافتهای زنده است. نیتروژن ترکیبات مهمی مانند آمونیاک، اسید نیتریک و سیانیدها را شکل میدهد.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نیتروژن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ظاهر | colorless gas, liquid or جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | (۱۴٫۰۰۶۴۳، ۱۴٫۰۰۷۲۸) conventional: ۱۴٫۰۰۷ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نیتروژن در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | گروه ۱۵ (گروه نیتروژن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | نافلز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [He] 2s2 2p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | گاز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 63.153 K (-210.00 °C, -346.00 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 77.36 K (-195.79 °C, -320.3342 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (در STP) | 1.251 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (در نقطه جوش) | 0.808 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه سهگانه | 63.1526 K, 12.53 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه بحرانی | 126.19 K, 3.3978 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | (N2) 0.72 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | (N2) 5.56 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | (N2) 29.124 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −3, −2, −1, +1, +2, +3, +4, +5 (یک اکسید اسیدی قوی) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 3.04 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 71±1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Color lines in a spectral range | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | دستگاه بلوری ششگوشه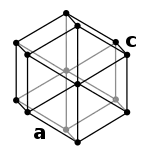 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت | (gas, 27 °C) 353 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 25.83 × 10−3 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | diamagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7727-37-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای نیتروژن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


ویژگیهای درخور نگرش
چرخه نیتروژن
نیتروژن از گروه غیرفلزات بوده و دارای بار الکترون منفی ۳٫۰ میباشد. نیتروژن پنج الکترون در پوسته خود داشته و در نتیجه در اکثر ترکیبات سهظرفیتی است. نیتروژن خالص یک گاز بیاثر و بیرنگ است و ۷۸٪ جو زمین را به خود اختصاص دادهاست. در ۶۳K منجمد شده و در ۷۷K به صورت مایع، به ماده سرمایشی معروف سرمازا (Cryogen) تبدیل میشود.
~به طور کلی چرخه نیتروژن به زبان ساده عبارت است از: نیتروژنِ هوا به هنگام رعد و برق به اکسید نیتروژن تبدیل شده و در باران حل شده و جذب خاک می شود؛ در خاک این ترکیبات، توسط باکتری ها به موادی تبدیل می شوند که بوسیله گیاهان جذب می شوند. حیوانات با خوردن گیاهان، نیتروژن را وارد بدن خود می کنند، با مردن و تجزیه اندام حیوانات، دوباره نیتروژن وارد هوا می شود.
گیاهان با انجام عمل فتوسنتز باعث تولید اکسیژن، انرژی و گلوکز)قند ساده( می شوند؛ حال برای آنکه گیاه بتواند با کمک قند ساخته شده ، پروتئین سازی کند ، نیاز به نیتروژن دارد؛اما نمیتواند این نیتروژن را بطور مستقیم از هوا دریافت کند، بلکه می بایست آن را بصورت یک ماده محلول درآب به نام نیترات توسط ریشه های خود جذب نماید.
کاربردها
مهمترین کاربرد اقتصادی نیتروژن برای ساخت آمونیاک از طریق فرایند هابر (Haber) است. آمونیاک معمولاً برای تولید کود و مواد تقویتی و اسید نیتریک استفاده میشود. نیتروژن همچنین بهعنوان پرکننده بی اثر، در مخزنهای بزرگ برای نگهداری مایعات قابل انفجار، در هنگام ساخت قطعات الکترونیک مانند ترانزیستور، دیود و مدار یکپارچه و همچنین برای ساخت فلزات ضدزنگ استفاده میشود. نیتروژن همچنین به صورت ماده خنککننده، برای هم منجمد کردن غذا و هم ترابری آن، نگهداری اجساد و یاختههای تناسلی (اسپرم و تخمک) و غده های جنسی (بیضه و تخمدان)، و در زیستشناسی برای نگهداری پایدار از نمونههای زیستی کاربرد دارد. نمک اسید نیتریک شامل ترکیبات مهمی مانند نیترات پتاسیوم و سدیم و نیترات آمونیوم است؛ که اولی برای تولید باروت و دومی برای تولید کود به کار میرود. ترکیبات نیترات شده مانند نیتروگلیسرین و تری نیترو تولوئن (تیانتی) معمولاً منفجر شونده هستند.
اسید نیتریک به عنوان ماده اکسیدکننده در مایع سوخت موشکها استفاده میشود. هیدرازین و مشتقات آن نیز در سوخت موشکها بکار میروند. نیتروژن اغلب در سرمازاها (Cryogens)، به صورت مایع (معمولاً LN2) استفاده میشود. نیتروژن مایع با عمل تقطیر هوا به دست میآید. در فشار جو، نیتروژن در دمای -۱۹۵٫۸ درجه سانتیگراد (-۳۲۰٫۴ درجه فارنهایت) مایع میشود.
فراوانی
نیتروژن بیشترین عنصر جو کره زمین از نظر حجم است. (۷۸ درصد ) و برای اهداف صنعتی با عمل تقطیر هوای مایع بدست میآید. ترکیباتی که حاوی این عنصر هستند در فضای بیرونی نیز مشاهده شدهاند. نیتروژن -۱۴ در اثر عمل همجوشی هستهای در ستارگان، تولید میگردد. نیتروژن از ترکیبات عمده ضایعات حیوانی (مانند چلغوز یا کود) بوده و معمولاً به صورت اوره، اسید اوریک و ترکیباتی از محصولات نیتروژنی یافت میشود.
ترکیبات
اصلیترین هیدرید نیتروژن، آمونیاک است (NH3)، البته هیدرازین (N2H4) نیز مشهور است. ترکیب آمونیاک سادهتر از آب بوده و در محلول،یونهای آمونیوم (NH4+) را تشکیل میدهد. آمونیاک مایع در حقیقت کمی آمفیروتیک بوده و آمونیاک و یونهای آمینه (NH2-) را بهوجود میآورد؛ که البته هر دو نمک آمیدها و نیترید شناخته شدهاند، ولی در آب تجزیه میشوند. ترکیبات جانشین آمونیاک به تنهایی یا باهم، آمینها نامیده میشوند. زنجیرهها، حلقهها و ساختارهای بزرگتر هیدریدهای نیتروژنی نیز شناخته شدهاند، ولی در واقع ناپایدار هستند.
گروههای دیگر آنیونهای نیتروژن، آزیدینها (N3-) هستند، که خطی بوده و نسبت به دیاکسید کربن ایزو الکتریک هستند. مولکول دیگر با ساختار مشابه، مونوکسید دی نیتروژن N2O یا گاز خنده است، و یکی از اکسیدهای گوناگون بوده و برجسته تر از مونوکسید نیتروژن (NO) و دیاکسید نیتروژن (NO2) است، که هر دوی آنها الکترون غیر زوج دارند؛ که دومی تمایلی را به دوپارشدن نشان داده و از اجزای تشکیل دهنده هوای آلودهاست.
اکسیدهای استاندارد بیشتری مانند تریاکسید دی نیتروژن (N2O3) و پنتاکسید دی نیتروژن (N2O5) معمولاً تا حدی نا پایدار و قابل انفجار هستند. اسیدهای متناظر آنها نیتروس (HNO2) و اسید نیتریک (HNO3) بوده با نمکهای متناظر که نیتریتها و نیتراتها نامیده میشوند. اسید نیتریک یکی از چند اسیدی است که از هیدرونیوم قوی تر است.
نقش زیستشناختی
نیتروژن عنصر اصلی اسیدهای آمینه و اسیدهای هستهای که نیتروژن را مادهای حیاتی برای ادامه زندگی میکنند، است. لوبیا مانند اکثر گیاهانی که دانههای سبوسی دارند میتواند عمل بازیافت نیتروژن را بهطور مستقیم از هوا انجام دهد، چراکه ریشههای آنها دارای برآمدگیهایی، برای نگهداری میکروبهایی است که عمل تبدیل به آمونیاک را فرایندی به نام تثبیت نیتروژن انجام میدهد، میباشد. این گیاهان آمونیاک را به اکسیدهای نیتروژن و آمینو اسید تبدیل کرده و پروتئین میسازند.
ایزوتوپها
نیتروژن دو ایزوتوپ پایدار دارد: (N-14 , N-15). که مهمترین آن دو N-14 (99.634%) است که در چرخه CNO در ستارگان تولید میشود. مابقی، ایزوتوپ N-15 است. یکی از ده ایزوتوپی که به صورت مصنوعی تولید میشوند دارای نیمه عمر نه دقیقهای داشته و ایزوتوپهای دیگر نیمه عمر چند ثانیه یا کمتر دارند.
واکنشهای زیستشناختی-واسطهای (مانند همانند سازی، جذب و ترکیب نیترات سازی) و … پویایی نیتروژن در خاک را به شدت کنترل میکنند. این ترکیبات معمولاً باعث عمل غنی سازی N-15 لایه زیرین و تخلیه محصول میشود. البته این فرایند سریع اغلب مقادیری از آمونیام و نیترات نیز دربردارد، زیرا آمونیوم به صورت ترجیحی بهوسیله سایبان جو نیترات، نگهداری میشود. خاک نیتراتی نسبت به خاک آمونیومی، توسط ریشه درختان بهتر جذب و ترکیب میشود.
نیتروژن و گیاه
نیتروژن غذای اصلی برای گیاهان است. یکی از اجزای اساسی پروتئین میباشد (برای ساخت اسیدهای آمینه، در کاتالیز واکنشهای شیمیایی و حمل و نقل الکترونها) و کلروفیل (قادر ساختن فتوسنتز) و در بسیاری از بخشهای گیاهان شرکت دارد. نیتروژن نقش مهمی در فرایندهای فیزیولوژیکی مختلف دارد. رنگ سبز تیره را القاء میکند و باعث افزایش رشد برگ، ساقه و سایر بخشهای گیاه و نمو آن میشود. به علاوه باعث تحریک رشد ریشه، بهبود کیفیت میوه، افزایش محتوای پروتئین و همچنین باعث جذب و استفاده مواد مغذی دیگر نظیر پتاسیم و فسفر میشود (۱). کمبود نیتروژن باعث کاهش رشد، کلروز (تغییر رنگ سبز به زرد) ایجاد نقطههای قرمز و صورتی بر روی برگها میشود (۳). کاربرد زیاد آن باعث ایجاد رنگ سبز تیره، اثر منفی روی رشد گیاه و تولید میوه با کمترین کیفیت و کمیت میشود (۴).

بهرهوری نیتروژن در گیاهان و مدیریت آن
فاکتورهای متعددی مانند سن گیاه، ویژگیهای گیاه و وضعیت خاک و فاکتورهای اقلیمی میزان بهرهوری نیتروژن را تحت تأثیر قرار میدهد. گیاه در مراحل اولیه رشد (جوانه زنی و رشد گیاهچه) که سیستم ریشه ای کامل و تعداد برگهای کمی دارد چگونه میتواند بیشترین نیتروژن مورد نیاز خود را با کاربرد برگی یا خاکی جذب نماید؟ کاربرد بالای نیتروژن در این مواقع فقط هدر دادن سرمایه میباشد زیرا پاسخ دلخواه را به دنبال نخواهد داشت. زمانی که سیستم ریشه ای گیاه کامل و سایز و تعداد برگها زیاد میشود استفاده نیتروژن افزایش پیدا میکند. ریشههای عمیق و برگهای بزرگ کارایی استفاده از نیتروژن را بالا میبرد. استفاده برگی نیتروژن در این مرحله که برگ گیاه بزرگتر است مفیدتر از مرحله ای است که برگهای کوچکتری دارد. بیشترین بازده استفاده از نیتروژن در مرحله بلوغ گیاه میباشد بعد از که گیاه به سمت پیری میرود بهتر است که مصرف آن را کاهش دهیم. کارایی مصرف به شدت وابسته به شرایط خاکی و اقلیمی است. شرایطی مانند PH خاک، بافت خاک، ساختار، آبشویی، مواد آلی، رطوبت، حضور دیگر مواد مغذی، اکسیداسیون و احیا، روش مصرف نیتروژن، تراکم خاک و غیره کارایی آن را تحت تأثیر قرار میدهد. PH مورد نیاز برای جذب بهتر آن حدود ۶٫۵–۷ میباشد. به علاوه بافت خاک (درصد شن، سیلت و رس) از لحاظ سیستمی در مدیریت نیتروژن در نظر گرفته میشود به گونه ای که در خاکهایی با بافت شنی و بافت درشت توانایی نگهداری نیتروژن پایین میباشد. از میان عوامل محدودکننده کارایی نیتروژن آبشویی یکی از مشکلات عمده میباشد. با کاربرد نیتروژن در اّب آبیاری، در آن حل میشود و از سطح رویی خاک به قسمتهای پایین برده میشود؛ که این فراید باعث کاهش قابلیت دسترسی نیتروژن میشود. تراکم خاک باعث کاهش اکسیژن و بروز مشکل هوادهی میشود و هوا برای فرایند شکستن نیتروژن و انتشار آن در ناحیه ریشه ظروری میباشد.

فرایند جذب نیتروژن
سه روش مختلف برای جذب مواد مغذی توسط گیاه وجود دارد؛ که شامل جریان توده ای، انتشار و root interception میباشند؛ و نیتروژن عمدتاً توسط جریان توده ای جذب گیاه میشود؛ که قبل از آن باید در آب حل بشود که توانایی عبور از غشاء را داشته باشد. جذب مواد غذایی از طریق تبادل بین آنیونها و کاتیونها صورت میپذیرد؛ که یون هیدروژن از ریشه توسط پمپ پروتون به داخل خاک رانده میشود و یون نیتروژن جایگزین آن در ریشه میشود. به علاوه فرایند ربایش توسط ریشه (Root interception) برای جذب این عنصر صورت میپذیرد. گیاهان دارای دو مسیر فیزیولوژیکی برای انتقال انرژی هستند که شامل آوند آبکش و چوبی میباشند. با کاربرد خاکی نیتروژن؛ این عنصر از طریق آوند چوبی به برگها انتقال داده میشود و با کاربرد برگی آن از طریق آوند آبکش از برگها به ریشهها منتقل میشود. نیترات (NO3-) و آمینواسیدها دو عنصر اصلی هستند که توسط آوند چوبی منتقل میشوند (۵). بافت آوند چوبی در گیاهان به نوع گیاه بستگی دارد و میتواند به صورت تک یا دوتایی در سلولهای مختلف باشد. بعضی از گیاهان مانند سرخسها دارای آوند چوبی Straw هستند. آنها از سلولهای بلند و باریک تشکیل میشوند که به عنوان تریکوئید شناخته میشوند. اما گیاهان دیگر مانند گیاهان گلدار دارای آوندهای بزرگ و بیشتری هستند؛ که در اندازههای بزرگتری هستند و بنابراین دارای سیستم انتقال آبی کاراتر و بهتری میباشند و کاربرد نیتروژن در آنها کارا تر میباشد (۶٬۷). برای بهتر بکاربردن مواد مغذی بهتر است که آگاهی خوبی در مورد سیستمهای آوندی گیاهان مختلف داشته باشیم.
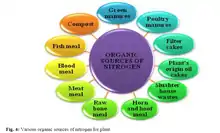
منابع نیتروژن
نیتروژن از منابع مختلفی مانند تثبیت صنعتی، تثبیت اتمسفری آن، تثبیت بیولوژیکی و منابع آلی قابل دسترس است؛ که نیتروژن قابل دسترس صنعتی مهمترین منبع نیتروژن در جهان است. جدول یک
تثبیت صنعی نیتروژن برای اولین بار در جهان توسط Caro در سال ۱۹۰۱ با استفاده از N2 و Ca (CN2) از کلسیم کاربید انجام شد. بعد از آن Harber و Bosh آمونیاک را از گاز نیتروژن و گاز هیدروژن در درجهحرارت بالا ۴۰۰–۶۰۰۰ درجه سانتی گراد و فشار حدود ۲۰۰–۱۰۰۰ اتمسفر تولید کردند.
تثبیت نیتروژن اتمسفری
تثبیت نیتروژن اتمسفری زمانی اتفاق میافتد که گاز نیتروژن (N2) توسط انرژِی نور شکسته میشود و تبدیل به نیتریک اکسید (NO2) میشود و سپس با اکسیژن ترکیب میشود و نیترات را تولید میکند؛ که توسط باران به زمین منتقل میشود. مقدار نیتروژنی که توسط این روش تثبیت میشود کم میباشد.
تثبیت بیولوژیکی نیتروژن
این روش تثبیت نیتروژن توسط میکروارگانیسمها صورت میپذیرد. این میکروارگانیسمها نیتروژن اتمسفری را توسط فرایند آمونیفیکاسیون (توسط باکتری) تبدیل به آمونیم میکنند؛ و سپس توسط باکتریهایی مانند nitrosomonas, nitrosospira و nitrosococcus آمونیوم تبدیل به نیتریک اکسید و سپس توسط باکتریهایی مانند نیتروباکتر، نیتروسپیرا، نیتروسپینا و نیتروکوکوس نیتریک اکسید تبدیل به نیترات میشود که بهترین فرم قابل جذب برای رشد و نمو گیاه شناخته میشود (۸).
تثبیت آلی نیتروژن
انواع مختلفی از کودهای آلی وجود دارد که حاوی نیتروزن میباشد. کودهای متراکمی مانند کودهای مورد استفاده در حیاط خانه (0.5% N)، کود مرغی (3.03 % N)، کمپوست مزرعه (0.5 % N) و کود سبز (G.M).
مدیریت نیتروژن
روش و زمان کاربرد نیتروژن اثر مستقیمی روی میزان محصولات دارد. روشهای جدید کود دهی مانند کود آبیاری (Fertigation) و Flooded Application جایگزین روشهای قدیمی تر مانند کاربرد برگی شدهاند. قبل از استفاده از نیتروژن باید موارد زیر را در نظر گرفت:
الف) نوع گیاه یا محصول و خصوصیات ریشه آن
ب) برآورد نیاز مراحل مختلف رشد گیاه نسبت به نیتروژن
پ) خصوصیات خاک
ت) رطوبت خاک
د) منبع آب مورد استفاده در کشاورزی
تعدادی از روشهای کاربرد مواد مغذی در کشاورزی
روش Broadcasting
این روش کاربرد به صورت افکندن کود در خاک و محصول تعریف میشود. توزیع یکنواخت کود در کل زمین است. این روش بیشترین میزان کود را نیاز دارد. این روش برای کاربرد کود در محصولات متراکم مناسب میباشد.
روش گماشتن (Placement)
یک روشی برای کاربرد نیتروژن است که در آن کود در داخل خاک قرار میگیرد. این روش برای کاربرد نیتروزن زمانی که مقدار نیتروژن در دسترس کم میباشد یا این که به خاطر ویژگیهای نامناسب خاک ریشه گیاه توانایی رشد خوبی ندارد میتواند بکار رود. این روش به سه دسته closely placement, Localizing addition و Deep placement تقسیم میشود.
روش برگی Foliar method
در این روش کود (N حل شده در آب) را داخل آب حل کرده و روی برگها و قسمتهای رویشی توسط پاشندهها میپاشند.
روش کود آبیاری (Fertigation method)
در این روش محلول نیتروژن توسط جریان آب آبیاری به پای گیاهان میرسد. مشاهده شدهاست که این روش برای کاربرد کودهای نیتروژنه بسیار اقتصادی و بسیار ایدئال میباشد. زیرا کمترین مشکل از دست رفتن کود نیتروژن وجود دارد و همچنین میزان جذب توسط گیاه نیز بالا میرود.
روش Starter application of solution
این روش یکی از روشهای مدرن کاربرد کودها میباشد. محلول نیتروژن همراه فسفر و پتاسیم به نسبت (۱:۲:۱) به گیاهان برنج در طول زمان انتقال داده میشود. مزیت اصلی این روش حمایت رشد قوی دانهال میباشد (۹).
هشدارها
کودهای نیتراتی شسته شده منبع اصلی آلودگی رودها و آبهای زیر زمینی است. سیانور (-CN) حاوی ترکیباتی است که (بینهایت سمی) بوده و برای حیوانات و همه پستانداران کشنده است.همچنین نیتروژن به صورت تنهایی باعث ازبین بردن طبیعت شده و بسیار کشنده وسمی است به صورتی که میتواند هر موجودی را از پای در بیاورد همچنین این عنصر 80% اتمسفر را تشکیل می دهد ولی با ترکیب شدن با عناصر ومواد دیگر نقش حیاتی را برای موجودات زنده ایفا می کند.
پیوند به بیرون
| در ویکیانبار پروندههایی دربارهٔ نیتروژن موجود است. |
1. Bloom, A.J. , 2015. The increasing importance of distinguishing among plant nitrogen sources. Current
opinion in plant biology, 25: 10-16.
2. Hemerly, A. , 2016. Genetic controls of biomass increase in sugarcane by association with beneficial
nitrogen-fixing bacteria’’, In Plant and Animal Genome XXIV Conference. Plant and Animal Genome,
during month of January.
3. Bianco, M. S. , A.B. CecílioFilho and L.B. de Carvalho, 2015. Nutritional status of the cauliflower cultivar
Verona grown with omission of out added macronutrients. Plos One, 10(4): e0123500.
4. King, B.J. , M.Y. Siddiqi, A.D.M. Glass, 1992. Studies of the uptake of nitrate in barley. 5. Estimation of
root cytoplasmatic nitrate concentration using reductase-activity – Implications for nitrate influx. Plant
Physiology, 99: 1582-1589.
Agriculture, 10 (2): 1-8.
5. Bollard, E.G. , 1960. Transport in the xylem. Ann. Rev. Plant Physiology, ۱۱: ۱۴۱–۱۶۶.
6. Zimmermann, M.H. and J.A. Milburn, 2012. Transport in plants I: Phloem transport. Springer Science and
Business Media, 1.
7. Boundless, 2015. Vascular tissue: xylem and phloem”, Boundless Biology. Boundless, 21 Jul. 2015.
Retrieved 16 Dec. available from https://www.boundless.com/biology/textbooks/ boundless-biologytextbook/
seedless-plants-25/seedless-vascular-plants-157/ vascular-tissue -]xylem- and-phloem-614- 11834/Nitrogen assimilation in plants, 2010: 00-00 ISBN 978-81-308-0406-4. Editors: TakujiOhyama and
KuniSueyoshi.
8. Nitrifying bacteria, from wikipedia, the free encyclopedia, available at https://en. wikipedia.
org/wiki/Nitrifying_bacteria.
9. Alagappan, S. , and Dr.R.Venkitaswamy. 2016. Impact of different sources of organic manures in
comparison with TRRI practice, RDF and INM on growth, yield and soil enzymatic activities of ricegreengram
cropping system under site-specific organic farming situation. American-Eurasian J. Sustainable
Agriculture, 10 (2): 1-8.

