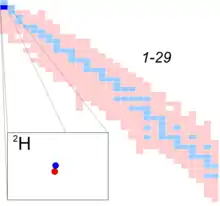
ایزوتوپ
ایزوتوپ (به فرانسوی: Isotope)، اتمهای یک عنصر مشخص هستند که عدد اتمی (Z) یکسان و عدد جرمی (A) متفاوتی دارند. عدد اتمی بیانگر تعداد پروتونهای هسته اتم است؛ بنابراین ایزوتوپهای یک عنصر، تعداد پروتونهای مساوی دارند. اختلاف در عدد جرمی ایزوتوپها از اختلاف تعداد نوترونهای موجود در هسته آنها ناشی میشود. عدد اتمی در سمت چپ و پایین نشانه ی شیمیایی امده وعدد جرمی در سمت چپ و بالای نشانه ی شیمیایی امده در حقیقت به اتم های یک عنصر،که تعداد نوترون متفاوت دارند ایزوتوپ گفته میشود.
| فیزیک هستهای | ||||||||
 | ||||||||
| واپاشی شکافت هستهای گداخت هستهای واپاشیهای کلاسیک | ||||||||
واپاشی آلفا · واپاشی بتا · پرتوزایی گاما · واپاشی کروی
| ||||||||
در توضیح دیگر:ایزوتوپ به عنصر شیمیایی میگویند که در اتم خود، تعداد پروتون و الکترون یکسان و تعداد نوترون متفاوت داشته باشد. به عبارت دیگر، ایزوتوپها به عناصری میگویند که تنها در تعداد نوترون با یکدیگر متفاوت باشند. به طور مثال، کربن ۱۲ و ۱۳ و ۱۴، همگی ایزوتوپهای کربن به شمار میآیند. کربن-۱۴ در مجموع ۸ نوترون و کربن-۱۳ در مجموع ۷ نوترون دارند. برای کربن-۱۲ نیز تعداد ۶ نوترون در هسته اتم آن ذکر شده است و تعداد ایزوتوپ های کل عنصرها به ازای هر عنصر 100 تریلیون میباشد.
نامگذاری
نامگذاری یک ایزوتوپ به صورت نام عنصر مربوطه، خط فاصله و عدد جرمی آن ایزوتوپ انجام میشود (برای نمونه هیدروژن-۲(دوتریوم) و اورانیوم-۲۳۵).[1] هنگامی که از نمادهای شیمیایی استفاده شود، عدد اتمی به صورت زیرنویس و عدد جرمی به صورت بالانویس، هر دو پیش از نماد عنصر نوشته میشوند (مانند O۱۸
۸). البته با توجه به این که نماد یک عنصر، معرف عدد اتمی آن نیز هست؛ معمولاً تنها عدد جرمی نشان داده میشود (مانند O۱۸
). گاهی حرف m نیز به عدد جرمی افزوده میشود که نشان دهنده ایزومر بودن آن ایزوتوپ است (مانند Tc۹۹m
).
انواع ایزوتوپها
ایزوتوپ پایدار
ایزوتوپ پایدار به عنوان ایزوتوپی تعریف میشود که تاکنون هیچ شکلی از واپاشی آن مشاهده نشدهاست. اگر نسبت نوترون به پروتون عنصر کمتر از یک و نیم باشد عنصر بدون واپاشی و پرتو زایی است.تاکنون ۲۵۴ ایزوتوپ پایدار شناسایی شدهاند که مربوط به ۸۲ عنصر اول جدول تناوبی (به جز تکنسیم و پرومتیم) هستند. البته پیشبینی میشود که تنها ایزوتوپهایی از ۴۰ عنصر اول (شامل ۹۰ ایزوتوپ)، نسبت به همه شکلهای واپاشی پایدار باشند و سایر ایزوتوپهایی که اکنون به عنوان ایزوتوپ پایدار خوانده میشوند، در مقابل شکلی از واپاشی، ناپایدار باشند که تاکنون مشاهده نشدهاست.
نوکلید دیرینه
نوکلید دیرینه، به ایزوتوپی گفته میشود که ناپایدار است، ولی نیمعمر آن بیشتر از عمر زمین است و همچنان در پوسته زمین یافت میشود. تاکنون ۳۴ هسته دیرینه، شناسایی شدهاند. عناصر بیسموت، توریوم و اورانیوم، هیچ ایزوتوپ پایداری ندارند؛ ولی ایزوتوپهایی با نیمعمر بسیار زیاد دارند و به همین دلیل، همچنان در پوسته زمین یافت میشوند.
ایزوتوپ پرتوزا
ایزوتوپ پرتوزا، گونهای از ایزوتوپ ناپایدار است که نیمعمر پایینی دارد. اگر نسبت نوترون به پروتون بیش از یک و نیم باشد پر تو زا است.البته هسته دیرینه نیز نوعی ایزوتوپ پرتوزا است، ولی به دلیل پرتوزایی بسیار پایین آن، به عنوان یک گروه جداگانه در نظر گرفته میشود. همه ایزوتوپهای تکنسیوم، پرومتیوم و عناصر با عدد اتمی بیش از ۸۳ (به جز یک ایزوتوپ توریوم و دو ایزوتوپ اورانیوم) در دسته ایزوتوپهای پرتوزا جای میگیرند.
تفاوت در ویژگیهای ایزوتوپها
ویژگیهای شیمیایی ایزوتوپ
از آنجا که ایزوتوپهای یک عنصر ساختار الکترونی مشابهی دارند، بنابراین ویژگیهای شیمیایی آنها نیز یکسان است، اما ویژگیهای هستهای آنها متفاوت است. تنها استثنای این مطلب، سرعت واکنش است. ایزوتوپهای سنگینتر یک عنصر با سرعت کمتری نسبت به ایزوتوپهای سبکتر آن در واکنش شیمیایی شرکت میکنند. افزون بر این، تفاوت وزن ایزوتوپها میتواند با جابجا کردن مرکز جرم یک سیستم اتمی، در رفتار پیوند شیمیایی تأثیر بگذارد. (البته برای عناصر سنگینتر، میتوان از تأثیر اختلاف ایزوتوپها چشم پوشی کرد)
ویژگیهای هستهای
تعداد نوترونها و پروتونهای یک عنصر، تأثیر قابل توجهی بر پایداری آن دارد. اگر تعداد پروتونها بسیار بیشتر از نوترونها باشد، پروتونها یکدیگر را دفع میکنند و واپاشی رخ میدهد. وجود نوترونها باعث افزایش پایداری هسته میشود. زیرا حضور نوترونها باعث فاصله افتادن میان پروتونها و کاهش نیروی دافعه بین آنها و همچنین نیروی جاذبه آنها باعث در کنار هم ماندن ذرات در هسته میشود. برای نمونه در He۳
۲، نسبت نوترونها به پروتونها ۱:۲ است؛ در حالی که در U۲۳۸
۹۲ این نسبت به حدود ۳:۲ میرسد.
تعداد ایزوتوپهای پایدار یک عنصر
همه عناصر در طبیعت دارای بیش از یک ایزوتوپ هستند اما آلومینیوم،فسفر،نیتروژن و سدیم فقط یک ایزوتوپ دارند در بین عناصر بیشترین تعداد ایزوتوپ مربوط به زنون با 26 ایزوتوپ است که البته فقط 8 تا از آنها پایدار هستند در صورتی که بیشترین تعداد ایزوتوپهای پایدار یک عنصر برابر با ده و مربوط به قلع است. پس از آن، چهار عنصر با هفت و هشت عنصر با شش ایزوتوپ پایدار وجود دارند. در نهایت، ۲۶ عنصر تنها یک ایزوتوپ پایدار دارند که عنصر تک نوکلید نامیده میشوند.
عدد جرمی فرد و زوج
| پروتون، نوترون | زز | فف | زف | فز | مجموع |
|---|---|---|---|---|---|
| پایدار | ۱۴۸ | ۵ | ۵۳ | ۴۸ | ۲۵۴ |
| هسته دیرینه | ۲۲ | ۴ | ۳ | ۵ | ۳۴ |
| مجموع | ۱۷۰ | ۹ | ۵۶ | ۵۳ | ۲۸۸ |
فرد یا زوج بودن تعداد پروتونها، نوترونها و مجموع آنها تأثیر زیادی در پایداری هسته دارد. فرد بودن همزمان تعداد پروتونها و نوترونها باعث کاهش انرژی بستگی هستهای میشود؛ بنابراین، تعداد ایزوتوپهای پایدار در این حالت، بسیار کم است (تنها ۵ مورد شامل H۲
۱ و Li۶
۳ و B۱۰
۵ و N۱۴
۷ و Ta۱۸۰m
۷۳). در نقطه مقابل، زوج بودن همزمان تعداد پروتونها و نوترونها یکی از عوامل اصلی پایداری هسته است. حدود ۵۸٪ ایزوتوپهای پایدار در این دسته قرار دارند و به علت جفتشدگی، اسپین همه آنها صفر است. در نیمی از عناصر دارای عدد اتمی زوج، تعداد ایزوتوپهای پایدار، بیشتر یا مساوی شش است.
تعداد ایزوتوپهای پایدار با عدد جرمی زوج نسبت به عدد جرمی فرد بیشتر است. یک دلیل آن، انرژی بستگی هستهای است. در هر عدد جرمی فرد، تنها یک ایزوتوپ پایدار میتواند وجود داشته باشد، در حالی که در یک عدد جرمی زوج، میتواند تا ۳ ایزوتوپ پایدار وجود داشته باشد که البته همه آنها باید دارای عدد اتمی زوج باشند. در واقع، وجود یک ایزوتوپ پایدار با تعداد پروتون و نوترون زوج، باعث میشود که ایزوتوپی با همان عدد جرمی و دارای عدد اتمی فرد، ناپایدار شود.
جرم اتمی ایزوتوپها
جرم اتمی یک ایزوتوپ را میتوان تقریباً معادل با عدد جرمی آن در نظر گرفت. اصلاحات جزئی، ناشی از انرژی بستگی هسته (کاهش جرم)، اختلاف اندک جرم پروتون و نوترون و تعداد الکترونهای آن است. عدد جرمی، یک کمیت بیبعد است. در حالی که جرم اتمی با یکای جرم اتمی اندازهگیری میشود.
جرم اتمی یک عنصر را میتوان بر پایه جرم اتمی ایزوتوپهای پایدار آن به دست آورد. از رابطه زیر برای محاسبه جرم اتمی یک عنصر () با تعداد N ایزوتوپ پایدار استفاده میشود.
که مقادیر تا جرم اتمی ایزوتوپها و مقادیر تا میزان فراوانی هر ایزوتوپ در طبیعت هستند.
منابع
- (کانلی، ان.جی. داموس، تی. هارتشورن، آر. ام؛ و هاتن، ای. تی)، نامگذاری شیمی غیر آلی – IUPAC توصیههای ۲۰۰۵، انجمن سلطنتی شیمی، ۲۰۰۵
- مورتیمر، چارلز (۱۳۸۳). شیمی عمومی ۱. اول. تهران: نشر علوم دانشگاهی. ص. ۲۳، ۲۷. شابک ۹۶۴۶۱۸۶۳۳۵.
- http://www.britannica.com/EBchecked/topic/296583/isotope
پیوند به بیرون
- پرتال شبکه علوم هستهای نوکلئونیکا
- چارت ذراتی کارلسروهه
- مرکز ملی دادههای هستهای دادههای رایگان و برنامههای تحلیلی هستهای از NNDC
- مرکز ملی توسعه ایزوتوپ مدیریت ساخت، دسترسی و توزیع ایزوتوپها و اطلاعات مرجع برای ایزوتوپها
- توسعه و ساخت ایزوتوپ برای پژوهش و کاربرد (IDPRA) برنامه دپارتمان انرژی ایالات متحده آمریکا برای ساخت ایزوتوپ و پژوهش و توسعه ساخت
- آژانس بینالمللی انرژی اتمی صفحه اصلی آژانس بینالمللی انرژی اتمی
- وزن اتمی و ترکیب ایزوتوپها برای همه عناصر (مؤسسه ملی فناوری و استانداردها)
- مرور جدول ایزوتوپها در آزمایشگاه ملی لارنس برکلی
- پژوهش و اطلاعات کنونی ایزوتوپها
- کتاب علوم هشتم دوره ی اول متوسطه
- Atomgewichte, Zerfallsenergien und Halbwertszeiten aller Isotope (آلمانی)
- Emergency Preparedness and Response: Radioactive Isotopes by the CDC (Centers for Disease Control and Prevention)
- Chart of Nuclides Interactive Chart of Nuclides (National Nuclear Data Center)
- Interactive Chart of the nuclides, isotopes and Periodic Table
- The LIVEChart of Nuclides – IAEA with isotope data.
- Annotated bibliography for isotopes from the Alsos Digital Library for Nuclear Issues
| در ویکیانبار پروندههایی دربارهٔ ایزوتوپ موجود است. |