نوکلید
نوکلید (به انگلیسی Nuclide) اتمی است که تعداد پروتونها، تعداد نوترونها و تراز انرژی آن مشخص و منحصر به فرد باشد.[1] به عبارت دیگر، نوکلید اتمی است که با ساختار ویژهٔ هستهٔ خود مشخص شدهباشد. یک عنصر شیمیایی میتواند چند نوکلید مختلف با تعداد نوترونها و ترازهای انرژی گوناگون داشته باشد. حداقل عمر یک نوکلید باید ثانیه باشد تا به عنوان یک نوکلید متمایز شناخته شود.[2]
| فیزیک هستهای | ||||||||||||
| هسته، نوکلئون، نیروی هستهای، انرژی هستهای
مدلهای هسته | ||||||||||||
مدل قطره مایعی هسته، مدل پوستهای هسته، مدل هستهای وحدت یافته
| ||||||||||||
بیش از ۳۳۰۰ نوکلید شناسایی شدهاست[3] که ۳۴۰ عدد از آنها به صورت طبیعی در زمین وجود دارند[4] و مابقی به صورت مصنوعی توسط واکنشهای هستهای در آزمایشگاهها ساخته شدهاند.
این واژه در فارسی به صورتهای نوکلاید، نوکلئید (تلفظ فرانسوی Nucléide)، ویژههسته[4] و گونههسته[2] نیز نوشته شدهاست.
نمایش نوکلیدها
برای نمایش یک نوکلید از نماد شیمیایی عنصر به همراه عدد جرمی (مجموع تعداد پروتونها و نوترونها) آن استفاده میشود. برای مثال C۱۲
که به صورت کربن-۱۲ هم نوشته میشود، نوکلیدی است که ۶ پروتون و ۶ نوترون دارد. در نماد نوکلیدها معمولاً عدد اتمی نوشته نمیشود چرا که عدد اتمی هر عنصر شیمیایی مشخص و ثابت است و نمایش آن کار زائدی است. با این حال در بعضی موارد تعداد نوترونها و پروتونها نیز در کنار نماد شیمیایی عنصر نوشته میشود. مانند که در این حالت تعداد نوترونها در پایین سمت راست نشان داده میشود. این طرز نمایش معمولاً در نوشتن واکنشهای هسته ای و موازنه کردن آنها به کار میرود.[5] از لحاظ سطح انرژی برخی نوکلیدها یک سطح پایه و یک یا چند حالت برانگیخته دارند. حالتهای برانگیخته در نماد نوکلیدها با یک حرف m پس از عدد جرمی مشخص میشود. m حرف اول کلمه metastable[6] به معنی نیمهپایدار یا شبهپایدار است.[7] به عنوان مثال نوکلید تربیم علاوه بر حالت پایدار، چندین حالت برانگیخته نیز دارد که به صورتهای Tb144m1
و Tb144m2
و Tb144m3
و Tb144m4
یا تربیم-144m1، تربیم-144m2، تربیم-144m3 و تربیم-144m4 نشان داده میشوند. روشهای واپاشی و نیمه عمر این نوکلیدها با هم متفاوت است.[8]
حداقل نیمهعمر یک نوکلید
برخی نوکلیدهای مصنوعی که در شتابدهندهها یا رآکتورها ساخته میشوند، نیمهعمر بسیار کوتاهی دارند. به همین دلیل برای نوکلیدها یک نیمهعمر حداقلی تعریف شدهاست تا بتوان آنها را در آشکارسازها شناسایی کرد. این نیمهعمر ثانیه است. همچنین یک «هسته» برای تبدیل شدن به یک «اتم» باید یک آرایهٔ الکترونی به دور خود جذب کند. این کار به زمانی در حدود ثانیه نیاز دارد[9] که کمی کمتر از نیمهعمر حداقلی نوکلیدهاست و تضمین میکند که یک اتم تشکیل شدهاست.
تاریخچه و ریشهشناسی
پس از کشف و مطالعهٔ عنصرهای شیمیایی، دانشمندان به تدریج متوجه تناقضهایی در ویژگیهای آنها شدند. طبق نظریه اتمی دالتون تمام اتمهای یک عنصر باید وزن یکسانی داشته باشند،[10] اما اندازهگیریهای شیمیدانان در قرن نوزدهم نشان میداد که یک عنصر میتواند در شکلهای مختلفی در طبیعت یافت شود که هر کدام از این شکلها نیز جرم اتمی مخصوص به خود را دارند. برای حل این مشکل، شیمیدان انگلیسی فردریک سودی در سال ۱۹۱۳ پیشنهاد کرد که اتمهایی که تنها اختلافشان در وزنشان است، همگی در یک خانه جدول تناوبی قرار داده شوند و برای تمایزگذاری بین آنها از واژه ایزوتوپ (به معنی همخانه) استفاده شود.[4] با ظهور دانش هسته ای و کشف ساختار هستهٔ اتم در قرن بیستم، معلوم شد که اختلاف وزن ایزوتوپها به دلیل تفاوت در تعداد نوترونها است. با پیشرفت دانش هستهای، تعداد زیادی «گونهٔ اتمی» مختلف کشف شد و روشن شد که برای توصیف آنها به مفهومی جامعتر از ایزوتوپ نیاز است. در سال ۱۹۴۷ شیمیدان آمریکایی ترومن پی. کومان (Truman P. Kohman) با انتشار مقالهای در نشریه «آمریکن ژورنال آو فیزیکس» واژه نوکلید را برای اشاره دقیق به یک گونهٔ اتمی خاص پیشنهاد کرد.
وی توضیح داد که این واژه را از ترکیب کلمه لاتین Nucleus (به معنای هسته) و پسوند ide- (به معنای گونه، نوع) ساختهاست.[11]
ضرورت استفاده از واژه نوکلید
استدلال ترومن پی. کومان برای استفاده از این واژه چنین بود: "برای اشاره به اتمی که از نظر ساختمان هسته با اتمهای دیگر تفاوت دارد، در زبان انگلیسی واژه ای وجود ندارد. هم اکنون از اصطلاحهایی مانند "یک گونهٔ اتمی" یا "یک نوع اتم" یا "یک گونهٔ هسته ای" استفاده میکنیم. اما این ترکیبها فاقد سادگی و سرراستی مورد نیاز در متنهای علمی هستند. از سوی دیگر واژهٔ ایزوتوپ نیز مناسب نیست چرا که ایزوتوپ به یک گونهٔ خاص از یک عنصر اشاره میکند و بر رابطهٔ بین ایزوتوپهای یک عنصر تأکید دارد که چیزی شبیه رابطهٔ "برادری" یا "همکاری" است. واژهٔ هسته نیز برای مقصود ما مناسب نیست چرا که مفهوم هسته به ندرت به تنهایی در نظر گرفته میشود و در حالت معمول آن را یکی از اجزای سازندهٔ اتم میدانند".[11]
هم اکنون هنگامی که از واژه نوکلید استفاده میکنیم، سه ویژگی اساسی یک اتم یا هسته را بهطور دقیق مشخص میکنیم:
- تعداد پروتونها (یا عدد اتمیZ)
- تعداد نوترونها
- سطح انرژی یا حالت برانگیختگی.
به این ترتیب از ایجاد هرگونه ابهام جلوگیری میکنیم چرا که تغییر هرکدام از این ویژگیها باعث تغییرات چشمگیری در اتم یا هسته میشود. مثلا:
- تغییر در تعداد پروتونها در واقع به معنای تغییر ماهیت عنصر است. مثلاً اکسیژن و نیتروژن که اولی هشت و دومی نُه پروتون دارد، دو عنصر متفاوت هستند.
- با تغییر تعداد نوترونها، جرم اتمی و خواص هستهای عنصر تغییر میکند. مثلاً اورانیم-۲۳۵ (که۱۴۳ نوترون دارد) شکافت پذیر است ولی اورانیم-۲۳۸ (که ۱۴۶ نوترون دارد) شکافت پذیر نیست.
- با تغییر سطح انرژی یا حالت برانگیختگی هستهها، برخی ویژگیهای مهم آنها مثل نیمه عمر یا چگونگی واپاشی تغییر میکند.
با توجه به این موارد، استفاده از واژههای اتم، عنصر، هسته یا حتی ایزوتوپ به ویژه در علوم هستهای میتوانند باعث ایجاد ابهام شوند.
تفاوت نوکلید و ایزوتوپ
طبق آنچه گفته شد، ایزوتوپها زیرمجموعهای از نوکلیدها هستند. به عبارت دقیقتر ایزوتوپها نوکلیدهایی هستند که تعداد پروتونهایشان با هم برابر است.
ایزوتوپها میتوانند ویژگیهای هستهای گوناگونی داشته باشند. اما ویژگیهای شیمیایی یکسانی دارند. چرا که ویژگیهای شیمیایی یک عنصر را آرایش الکترونهای آن تعیین میکند نه ساختار هسته. حتی در هستههای سبک که اختلاف نسبت نوترون به پروتون بین ایزوتوپهای مختلف زیاد است، تغییر تعداد نوترونها تأثیر محسوسی بر خواص شیمیایی ایزوتوپها ندارد (هرچند استثناءهای معدودی مثل ایزوتوپهای هیدروژن وجود دارد). از سوی دیگر نوکلیدها علاوه بر خواص هستهای متفاوت، ممکن است خواص شیمیایی متفاوتی نیز داشته باشند. چرا که نوکلیدها در واقع «گونههای مختلف اتمها» هستند.[12]
البته واژه ایزوتوپ در مجموع رایجتر از نوکلید است و هنوز هم در جاهایی که نوکلید مناسبتر است، به اشتباه از واژه ایزوتوپ استفاده میشود. مثلاً در پزشکی هستهای، رادیونوکلیدها (نوکلیدهای پرتوزا) را حتی وقتی عددهای اتمی متفاوتی دارند به اشتباه رادیوایزوتوپ میخوانند.[13]
انواع نوکلیدها
نوکلیدها را از نظر روابط میان ذرات تشکیل دهنده و سطوح مختلف انرژی، میتوان به گروههای زیر تقسیم کرد. این تقسیمبندی را نخستین بار ترومن پی. کومان انجام داد.[11]
۱-ایزوتوپها:
نوکلیدهایی که تعداد پروتونهایشان مساوی باشد را ایزوتوپ مینامند. واژه ایزوتوپ به معنی همجا یا همخانه است و به این واقعیت اشاره دارد که ایزوتوپها در واقع نوکلیدهایی هستند که در یک خانه جدول تناوبی قرار دارند. به عبارت دیگر آنها شکلهای مختلف یک عنصر شیمیایی هستند. مانند C۱۲
و C۱۳
و C۱۴
که همه ایزوتوپهای مختلف عنصر کربن هستند.
۲-ایزوتونها:
نوکلیدهایی که نوترونهای برابر ولی تعداد پروتونهای متفاوت دارند، ایزوتون نامیده میشوند. به عنوان مثال K۳۹
۱۹ و Ar۳۸
۱۸ و Cl۳۷
۱۷ و S۳۶
۱۶ همگی ۲۰ نوترون دارند و با هم ایزوتون هستند.
واژه ایزوتون را فیزیکدان آلمانی ک. گوگن هایمر (K. Guggenheimer) در سال ۱۹۳۴ ابداع کرد. وی در کلمه isotope حرف p (به عنوان نماینده پروتون) را با حرف n (به عنوان نماینده نوترون) جایگزین کرد تا به یکسان بودن تعداد نوترونها اشاره کند.[14]
۳-ایزوبارها:
نوکلیدهایی که عدد جرمی یکسان دارند ولی تعداد پروتونهایشان متفاوت است، ایزوبارهای یکدیگر محسوب میشوند. برای مثال F۱۷
۹ و O۱۷
۸ و O۱۷
۷ که عدد جرمی هرکدامشان ۱۷ است، با هم ایزوبار هستند.
واژه ایزوبار نخستین بار توسط شیمیدان بریتانیایی آلفرد والتر استوارت (Alfred Walter Stewart) در سال ۱۹۱۸ پیشنهاد شد. او این واژه را از ترکیب دو کلمه یونانی isos (یکسان) و baros (وزن) ابداع کرد. ایزوبار به معنی هموزن است ولی باید توجه داشت که منظور از هم وزن، یکسان بودن عددهای جرمی این نوکلیدها است. بدیهی است که جرم اتمی ایزوبارها با هم متفاوت است.[15]
هرگاه تعداد نوترونها و پروتونهای یک نوکلید به ترتیب برابر با تعداد پروتونها و نوترونهای یک نوکلید دیگر باشد، آنها را هستههای آینهای (Mirror nuclei) مینامند. مانند نوکلیدهای O۱۴
۸ و C۱۴
۶ یا He۳
۲ و H۳
۱.
همانطور که ملاحظه میشود عدد جرمی این نوکلیدها با هم برابر است و ایزوبار محسوب میشوند. به همین دلیل آنها را ایزوبارهای آینهای نیز مینامند.[16]
۵-ایزودیافرها:
نوکلیدهایی هستند که عدد اتمی و عدد جرمی متفاوتی دارند ولی اختلاف تعداد پروتونها و تعداد نوترونهایشان برابر است. مثلاً در هر دو نوکلید U۲۳۸
۹۲ و Th۲۳۴
۹۰ اختلاف تعداد نوترونها و پروتونها برابر ۵۴ است: N − Z = ۵۴
نوکلیدهایی که تعداد نوترونها و پروتونهایشان با هم برابر است ولی سطحهای انرژی یا حالتهای برانگیختگی متفاوتی دارند، ایزومرهای هستهای نامیده میشوند. برای مثال Tc۹۹m
و Tc۹۹
دارای دو سطح انرژی مختلف هستند؛ بنابراین هرچند از لحاظ شیمیایی ایزوتوپ یکدیگرند، از لحاظ هسته ای دو نوکلید مختلف بهشمار میآیند.[17]
| نام | ویژگی ها | مثال | |
|---|---|---|---|
| ۱ | ایزوتوپها | تعداد پروتونها برابر، تعداد نوترونها متفاوت | C۱۲ و C۱۳ C۱۴ |
| ۲ | ایزوتونها | تعداد نوترونها برابر، تعداد پروتونها متفاوت | K۳۹ ۱۹ و Ar۳۸ ۱۸ و Cl۳۷ ۱۷ |
| ۳ | ایزوبارها | عددهای جرمی یکسان، تعداد پروتونها متفاوت | F۱۷ ۹ O۱۷ ۸ و O۱۷ ۷ |
| ۴ | هستههای آینهای | تعداد نوترونها و پروتونها به صورت ضربدری برابر | He۳ ۲ و H۳ ۱ |
| ۵ | ایزودیافر | اختلاف تعداد نوترونها و پروتونها برابر | U۲۳۸ ۹۲ و Th۲۳۴ ۹۰ |
| ۶ | ایزومرهای هستهای | سطحهای انرژی یا حالتهای برانگیختگی متفاوت | Tc۹۹ و Tc۹۹m |
پایداری نوکلیدها
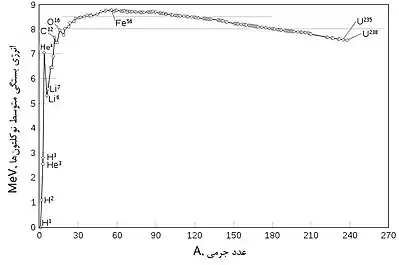
نوکلیدها به دو دستهٔ پایدار و ناپایدار تقسیم میشوند. نوکلیدهای ناپایدار پرتوزا هستند و دچار واپاشی میشوند. منظور از نوکلید پایدار، نوکلیدی است که خودبهخود دچار واپاشی نشود. پایداری یک نوکلید به عوامل متعددی بستگی دارد و هیچ قاعدهٔ دقیقی وجود ندارد که بتوان بر اساس آن پایداری یا ناپایداری یک نوکلید را پیشبینی کرد. اما با استفاده از سه قاعده میتوان پایداری نوکلیدها را تخمین زد:
۱-بالا بودن انرژی بستگی متوسط نوکلئونها.
انرژی لازم برای تجزیهٔ یک هسته به نوکلئونها (پروتونها و نوترونها) را انرژی بستگی هسته مینامند. با تقسیم این انرژی بر تعداد نوکلئونها، «انرژی بستگی متوسط نوکلئونها» به دست میآید. هر قدر این کمیت بیشتر باشد، نوکلید پایدارتر است. با توجه به نمودار مشاهده میشود که انرژی بستگی متوسط نوکلیدهایی که عدد جرمیشان حول و حوش عدد جرمی نوکلید آهن-۵۶ است، بیشترین مقدار را دارد و در نتیجه این نوکلیدها بیشترین پایداری را دارند.
۲-برابر بودن تعداد پروتونها و نوترونها در نوکلیدهای سبک (Z<۲۰).
نوکلیدهایی که عدد اتمیشان کمتر از ۲۰ است و در آنها تعداد نوترونها و پروتونها با هم برابر است، بسیار پایدارند. اما با افزایش عدد اتمی، پایداری نوکلیدها کاهش مییابد چرا که با بیشتر شدن تعداد پروتونها، نیروهای دافعهٔ الکترواستاتیک بین آنها افزایش مییابد و هسته را ناپایدار میکند. برای غلبه بر این نیروها، باید تعداد نوترونها در هسته افزایش یابد تا نیروهای هستهای قوی بر نیروهای دافعهٔ الکترواستاتیک غلبه کنند و موجب پایداری هسته بشوند. با توجه به نمودار مشاهده میشود که با بالا رفتن عدد اتمی (Z>۲۰)، محدودهٔ پایداری نوکلیدها از خط N=Z فاصله میگیرد و به سمت افزایش تعداد نوترونها میرود.
۳-زوج بودن تعداد نوترونها و پروتونها.
نوکلیدهایی که تعداد نوترونها و پروتونهایشان زوج است، بالاترین پایداری را دارند. بین نوکلیدهای شناخته شدهٔ پایدار، ۵۷٪/۸ تعداد پروتون و نوترون زوج دارند. در ۱۹٪/۸ تعداد نوترونها زوج و تعداد پروتونها فرد است. در ۲۰٪/۹ تعداد پروتونها زوج و نوترونها فرد است و فقط در ۱٪/۵ از نوکلیدهای پایدار تعداد نوترونها و پروتونها هر دو فرد است.[18]
نوکلیدهای طبیعی و مصنوعی
تا کنون (سال ۲۰۱۷) ۳۳۸۶ نوکلید شناخته شده که از این میان ۳۴۰ نوکلید در طبیعت یافت میشوند. مابقی نوکلیدها مصنوعی هستند و توسط واکنشهای هستهای ساخته میشوند. تمام نوکلیدهای مصنوعی پرتوزا و ناپایدار هستند و از آن جا که تحقیق و پژوهش در این زمینه ادامه دارد، تعدادشان در آینده افزایش خواهد یافت.
اما نوکلیدهای طبیعی را میتوان به چهار دسته تقسیم کرد:
- نوکلیدهای طبیعی کاملاً پایدار. تعداد آنها حدود ۲۵۸ عدد است. این تعداد تقریبی است چرا که با فناوریهای فعلی هیچگونه واپاشی و پرتوزایی در آنها مشاهده نمیشود اما ممکن است در آینده معلوم شود که اینها نیز ناپایدارند و نیمهعمرهایی فوقالعاده طولانی دارند.
- نوکلیدهای طبیعی ناپایدار با نیمهعمرهای بسیار بالا. تعداد آنها ۲۸ عدد است. این نوکلیدها مربوط به ۸۰ عنصر اول جدول تناوبی هستند (Z<۸۰) و نیمهعمرشان بیش از ۱۰۱۵ سال است.
- نوکلیدهای دیرینهٔ پرتوزا. که عبارتند از U۲۳۸
و U۲۳۵
و Th۲۳۲
. اینها جز نوکلیدهای دیرینه (Primordial nuclides) هستند یعنی از فرایند مهبانگ و پیدایش هستی به وجود آمدهاند. نوکلیدهای دیرینه ناپایدار و پرتوزا هستند اما نیمهعمرشان آنقدر زیاد است که هنوز در زمین یافت میشودند. نوکلیدهای این دسته هماکنون منبع اصلی تولید انرژی هستهای هستند. - نوکلیدهای ثانوی پرتوزا. نوکلیدهایی هستند که حاصل واپاشی نوکلیدهای دیرینهٔ پرتوزا هستند یا از برخورد پرتوهای کیهانی با نوکلیدهای طبیعی، بهطور دائم ساخته میشوند. مانند C۱۴
و Be۱۰
و Be۷
و H۳
.[19]
مرجع اطلاعات جدید دربارهٔ نوکلیدها
نشریه Nuclear Data Sheets[20] یکی از منابع معتبر اطلاعات مربوط به نوکلیدهاست. این نشریه به صورت ماهانه منتشر میشود و نه تنها اطلاعات مربوط به هر دسته از ایزوبارها را منتشر میکند، بلکه خلاصهٔ تمام مقالات منتشر شده در سال را به صورت دستهبندی شده بر حسب نوکلیدها ارائه میکند.[21] ناشر آن آزمایشگاه ملی بروک هِیوِن (Brookhaven National Laboratory) ایالات متحده آمریکا است. دادههای این نشریه توسط گروهی از فیزیکدانان از سراسر جهان تهیه میشود که از اعضای آژانس بینالمللی انرژی اتمی هستند.[22] این نشریه در سایت ساینس دایرکت قابل دسترس است.[23]
جستارهای وابسته
پانویس
- International Union of Pure and Applied Chemistry (1997). "Nuclide". In A. D. McNaught and A. Wilkinson. Compendium of Chemical Terminology. Wiley-Blackwell. doi:10.1351/goldbook.N04257. ISBN 0-632-01765-1.
- کاشیگر، فرهنگ فیزیک، ج۳، ۲۱۱۵
- «Chart of Nuclides Description». دریافتشده در ۱۹ اکتبر ۲۰۱۷.
- لییزر، شیمی هستهای و رادیوشیمی؛ مبانی و کاربردها، ۹
- کرین، آشنایی با فیزیک هستهای، ۱۲
- «Metastability». دریافتشده در ۱۶ اکتبر ۲۰۱۷.
- آرنیکار، اصول و مبانی شیمی هستهای، ۹
- «Isotopes of terbium». دریافتشده در ۱۳ اکتبر ۲۰۱۷.
- Powell، Devin (۱۹ ژانویه ۲۰۱۶). «When Will We Reach the End of the Periodic Table?». Smithsonian Mag. دریافتشده در ۱۷ نوامبر ۲۰۱۷.
- مورتیمر، شیمی عمومی، ج۱، ۲۸
- Truman P. Kohman (1947). "Proposed New Word: Nuclide". American Journal of Physics. 15: 356-357.
- «Isotope vs. nuclide». دریافتشده در ۱۳ اکتبر ۲۰۱۷.
- سیبورگ، گلن تی. شیمی هستهای نوین. ص. ۸.
- Brucer، Marshall. «Nuclear Medicine Begins With a Boa Constrictor» (PDF). ص. ۵۹۰.
- «(Isobar (nuclide». دریافتشده در ۱۶ اکتبر ۲۰۱۷.
- «Mirror nuclei». دریافتشده در ۱۷ اکتبر ۲۰۱۷.
- «Nuclear isomer». دریافتشده در ۱۶ اکتبر ۲۰۱۷.
- اسموت و دیگران، شیمی عمومی با نگرش کاربردی، ج۳، ۷۶۱–۷۶۴
- لییزر، شیمی هستهای و رادیو شیمی، ۱۲
- «Nuclear Data Sheets». دریافتشده در ۱۹ اکتبر ۲۰۱۷.
- کرین، آشنایی با فیزیک هستهای، ۱۴
- «INTERNATIONAL NETWORK OF NUCLEAR STRUCTURE AND DECAY DATA EVALUATORS (NSDD)». دریافتشده در ۱۹ اکتبر ۲۰۱۷.
- «Science Direct: Nuclear Data Sheets». دریافتشده در ۱۹ اکتبر ۲۰۱۷.
منابع
- کاشیگر، لطیف (۱۳۹۴). فرهنگ فیزیک. ۳. تهران: فرهنگ معاصر. شابک ۹۷۸-۶۰۰-۱۰۵-۱۰۳-۶.
- سیبورگ، گلن تی و دیگران (۱۳۹۲). شیمی هستهای نوین. ترجمهٔ رضا قلی پور پیوندی، محمد قنادی مراغه. تهران: پژوهشگاه علوم و فنون هستهای. شابک ۹۷۸-۶۰۰-۹۲۵۷۹-۵-۹.
- لییزر، کارل هاینریخ (۱۳۸۲). شیمی هستهای و رادیوشیمی-مبانی و کاربردها. ترجمهٔ محمد قنادی مراغه. تهران: سازمان انرژی اتمی ایران. شابک ۹۶۴-۸۲۳۴-۰۷-۸.
- کرین، کنت (۱۳۷۱). آشنایی با فیزیک هستهای. ۱. ترجمهٔ ابراهیم ابوکاظمی، منیژه رهبر. تهران: مرکز نشر دانشگاهی. شابک ۹۷۸-۹۶۴-۰۱-۰۶۲۴ مقدار
|شابک=را بررسی کنید: length (کمک). - آرنیکار، اچ. جی (۱۳۷۲). اصول و مبانی شیمی هستهای. ترجمهٔ محمد قنادی مراغه. تهران: سازمان انرژی اتمی ایران. شابک ۸۱-۲۲۴-۰۲۵۵-۰.
- مورتیمر، چارلز (۱۳۷۶). شیمی عمومی. ۱. ترجمهٔ علی پورجوادی و دیگران. تهران: مرکز نشر دانشگاهی. شابک ۹۶۴-۰۱-۰۷۳۴-۴.
- Truman P. Kohman (1947). "Proposed New Word: Nuclide". American Journal of Physics. 15: 356-357.
- Brucer، Marshall. «Nuclear Medicine Begins With a Boa Constrictor» (PDF). دریافتشده در ۱۶ اکتبر ۲۰۱۷.
- اسموت، رابرت و دیگران (۱۳۹۰). شیمی عمومی با نگرش کاربردی. ۳. ترجمهٔ علی سیدی، مرتضی خلخالی. تهران: انتشارات فاطمی. شابک ۹۶۴-۳۱۸-۲۸۰-۰.
پیوند به بیرون
- The Live Chart of Nuclides at The International Atomic Energy Agency
