جرم اتمی
جرم اتمی (به انگلیسی: Atomic mass) یا جرم نسبی، جرم یک ذرهٔ اتمی، زیراتمی یا یک مولکول است. یکای جرم اتمی، یکدوازدهم جرم ایزوتوپ کربن-۱۲ (مطابق با جرم مطلق ۱٫٫۶۶۰۵۴۰۲*۱۰−۲۷ کیلوگرم) است.[1]
شیمیدانها در سدههای ۱۸ و ۱۹ میلادی موفق شدند به روش تجربی جرم اتمهای بسیاری از عنصرهای شناختهشده تا آن زمان را بهطور نسبی اندازهگیری کنند. چنین آزمایشهایی نشان داد که برای مثال جرم یک اتم اکسیژن ۱٫۳۳ برابر جرم یک اتم کربن و جرم یک اتم کلسیم ۲٫۵ برابر جرم یک اتم اکسیژن است. استفاده از این نسبتها در محاسبههای آزمایشگاهی کاری بسیار دشوار بود. از این رو، شیمیدانها ناگزیر شدند جرم خاصی را به یک عنصر معین نسبت دهند و سپس به کمک نسبتهای اندازهگیری شده، جرم عنصرهای دیگر را محاسبه کنند. سرانجام فراوانترین ایزوتوپ کربن یعنی کربن-۱۲ برای این منظور انتخاب شد.
تاریخچه
نخستین تلاشها برای تعیین جرم اتمی نسبی در دهههای آغازین قرن نوزدهم توسط جان دالتون، توماس تامسون و یاکوب برسلیوس انجام شد. در ابتدا جرم اتمی نسبی (وزن اتمی) نسبت به سبکترین عنصر (هیدروژن) با ورن اتمی برابر ۱٫۰۰ در نظر گرفته میشد. در دهه ۱۸۲۰، فرضیه پروت بیان نمود که جرم اتمی همه عناصر باید ضریبی از جرم اتمی هیدروژن باشد؛ ولی برسلیوس نشان داد که این فرضیه برای همه عناصر درست نیست (مانند کلر با جرم اتمی نسبی ۳۵٫۵). هرچند که بعداً مشخص شد، این مطلب به دلیل وجود مخلوطی از ایزوتوپهای مختلف یک عنصر است و جرم اتمی هر ایزوتوپ، به تنهایی، تقریباً برابر با ضریبی از جرم هیدروژن (با اختلاف نزدیک ۱٪) است.
یکای واحد
تا دههٔ ۱۹۶۰، فیزیکدانها و شیمیدانها از دو مقیاس مختلف برای محاسبه جرم اتمی بهره میبردند. فیزیکدانها جرم اتمی ایزوتوپ اکسیژن-۱۶ را برابر ۱۶ در نظر میگرفتند؛ در حالی که شیمیدانها این عدد را برای جرم اتمی مخلوط طبیعی ایزوتوپهای اکسیژن (که شامل اکسیژن-۱۷ و اکسیژن-۱۸ نیز میشود) لحاظ میکردند. با تعریف جرم اتمی برپایه ایزوتوپ کربن-۱۲، هم نظر فیزیکدانها برای پایهگذاری بر یک ایزوتوپ خالص رعایت شد و هم مقدار آن به مقیاس شیمیدانها نزدیک بود.[2]
کاهش جرم در جرم اتمی
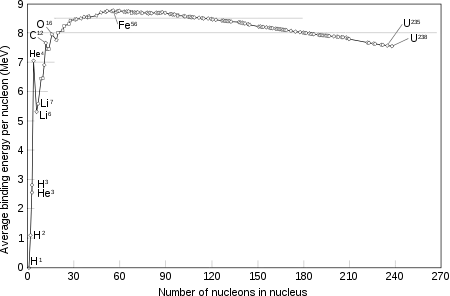
جرم اتمی یک ایزوتوپ، اندکی با عدد جرمی آن تفاوت دارد. این تفاوت، در ابتدا مثبت است. یعنی جرم اتمی ایزوتوپ هیدروژن-۱ اندکی از ۱ بیشتر است. سپس کاهش مییابد تا آن که در هلیم-۴ به یک کمینه نسبی میرسد. پس از آن، مجدداً در لیتیم، بریلیم و بور افزایش مییابد. دلیل این افزایش، کاهش انرژی بستگی هستهای در این سه عنصر است و نتیجه آن، عدم تشکیل این عناصر در همجوشی هیدروژن در ستارهها میباشد. در کربن-۱۲، مقدار جرم اتمی با عدد جرمی دقیقاً برابر است. پس از آن، نسبت جرم اتمی به عدد جرمی تا آهن-۵۶ کاهش مییابد و سپس دوباره افزایش مییابد تا آن که در عناصر سنگین، از مقدار واحد بیشتر میشود.
در واقع، شکافت هستهای در عناصر سنگینتر از زیرکونیم انرژیزا و در عناصر سبکتر از نیوبیم، انرژیگیر است. از سوی دیگر، همجوشی دو اتم از عناصر سبکتر از اسکاندیم، انرژیزا و همجوشی عناصر سنگینتر از کلسیم، انرژیگیر است. (به استثنای هلیم که همجوشی دو اتم آن یا یک اتم آن با یک اتم سبکتر، نیاز به انرژی دارد و تنها در فرایند آلفای سهگانه میتواند همجوشی کند و به کربن-۱۲ تبدیل شود)
برای نمونه، نسبت جرم اتمی به عدد جرمی برای چند ایزوتوپ در جدول زیر آورده میشود.[3]
| ایزوتوپ | جرم اتمی | نسبت جرم اتمی به عدد جرمی |
|---|---|---|
| هیدروژن-۱ | ۱٫۰۰۷۸۲۵ | ۱٫۰۰۷۸۲۵ |
| هلیم-۴ | ۴٫۰۰۲۶۰۲ | ۱٫۰۰۰۶۵۱ |
| کربن-۱۲ | ۱۲ | ۱ |
| نیتروژن-۱۴ | ۱۴٫۰۰۳۰۷۴ | ۱٫۰۰۰۲۲۰ |
| اکسیژن-۱۶ | ۱۵٫۹۹۴۹۱۵ | ۰٫۹۹۹۶۸۲ |
| آهن-۵۶ | ۵۵٫۹۳۴۹۳۸ | ۰٫۹۹۸۸۳۸ |
| نیکل-۶۲ | ۶۱٫۹۲۸۳۴۵ | ۰٫۹۹۸۸۴۴ |
| سرب-۲۰۸ | ۲۰۷٫۹۷۶۶۵۲ | ۰٫۹۹۹۸۸۸ |
| رادیم-۲۲۶ | ۲۲۶٫۰۲۵۴۱۰ | ۱٫۰۰۰۱۱۲ |
| اورانیم-۲۳۸ | ۲۳۸٫۰۵۰۷۸۸ | ۱٫۰۰۰۲۱۳ |
اندازهگیری جرم اتمی
برای اندازهگیری جرم اتمی از روش طیفسنجی جرمی استفاده میشود که شامل جداسازی یونهای یک یا چند اتمی بر پایهٔ نسبت جرم به بار (m/z) و اندازهگیری m/z و فراوانی یونها در فاز گازی است. به عبارت دقیقتر طیفسنجی جرمی به بررسی نسبت جرم به بار مولکولها با استفاده از میدانهای الکتریکی و مغناطیسی میپردازد.[4]
جرم مولکولی
به صورت مشابه جرم اتمی، جرم مولکولی نیز قابل محاسبه است. کافی است که ترکیب شیمیایی مولکول شناخته شدهباشد. سپس با جمع کردن جرم اتمی اجزای تشکیل دهنده آن، جرم مولکولی برای مولکول مورد نظر به دست میآید. برای نمونه، متان (با ترکیب شیمیایی CH4) از یک اتم کربن با جرم اتمی ۱۲٫۰۱۱ و چهار اتم هیدروژن با جرم اتمی ۱٫۰۰۸ تشکیل شدهاست؛ بنابراین جرم مولکولی متان برابر است با:
تبدیل به یکاهای استاندارد جرم
یکای استاندارد جرم برای اندازهگیری مقدار یک ماده در بزرگمقیاس، مول است. مقدار آن برای یک ماده برابر است با جرم تعدادی از اتمهای آن ماده که برابر با تعداد اتمهای موجود در ۱۲ گرم ایزوتوپ کربن-۱۲ باشد. این تعداد با عنوان عدد آووگادرو تعریف میشود و مقدار آن تقریباً برابر ۱۰۲۳×۶٫۰۲۲ است.
مقدار یک مول از هر ماده تقریباً برابر با جرم اتمی یا جرم مولکولی آن ماده است. رابطه تبدیل بین یکای جرم اتمی و یکای جرم استاندارد (گرم) برای یک اتم به صورت زیر است:
که در آن ثابت جرم مولی و عدد آووگادرو هستند.
جستارهای وابسته
منابع
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "atomic mass".
- De Bievre، P.؛ Peiser، H. S. (۱۹۹۲). «'Atomic weight': The name, its history, definition, and units» (PDF). Pure&App. Chem. ۶۴ (۱۰): ۱۵۳۵. doi:10.1351/pac199264101535.
- وزن اتمی و ترکیب ایزوتوپی برای همه عناصر
-
- Physical and Biophysical Chemistry Division Commission on Molecular Structure and Spectroscopy, Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991), Pure and Applied Chemistry, 1991, Vol. 63, No. 10, pp. 1541-1566 doi:10.1351/pac199163101541
