قانون شارل
قانون شارل (که همچنین با نام قانون حجم نیز شناخته میشود)، قانونی تجربی از قوانین گاز است که درباره منبسط شدن گاز در هنگام دادن حرارت به آن، توضیح میدهد. این قانون ابتدا در سال ۱۸۰۲ توسط فیلسوف فرانسوی، ژوزف لویی گیلوساک مطرح شد.[1]
| مکانیک محیطهای پیوسته | |||||||
|---|---|---|---|---|---|---|---|
|
قوانین
|
|||||||
|
|||||||
|
|||||||
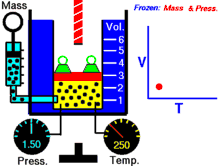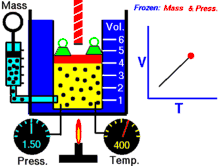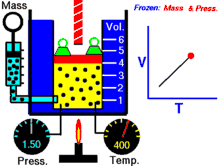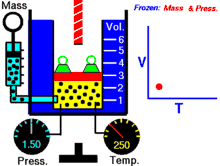
انیمیشنی در رابطه با رابطه بین حجم و دمای یک گاز.
قانون شارل به این امر اشاره دارد که در یک فشار ثابت، حجم یک گاز با دمای آن رابطهٔ مستقیم دارد که این را میتوانیم بدین صورت نیز بنویسیم:[2]
وقتی که V حجم گاز باشد و T نیز دمای مطلق گاز باشد؛ این قانون را به صورت دیگری نیز میتوان نوشت:[2]
در ۱۸۳۴، بنویت پال امیل کلاپیرون، فیزیکدان فرانسوی، با ترکیب قانون بویل و قانون شارل به عبارتی دست یافت که امروزه با نام قانون گاز ایدهآل شناخته میشود.[3] عبارتی که کلاپیرون به آن دست یافته بود، این بود:[2]
.
مفاهیم مول | |
|---|---|
| ثابتها | |
| کیفیتهای فیزیکی | |
| قوانین | |
پزشکی غواصی، فیزیولوژی، فیزیک و محیط زیست | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| پزشکی غواصی |
|  | ||||||||||||||
| فیزیولوژی غواصی |
| |||||||||||||||
| فیزیک غواصی |
| |||||||||||||||
| محیط زیست غواصی |
| |||||||||||||||
| پژوهشها درباره پزشکی غواصی, فیزیولوژی |
| |||||||||||||||
| Diving medical research organisations |
| |||||||||||||||
| ||||||||||||||||
علوم غواصی | |||||
|---|---|---|---|---|---|
| فیزیک غواصی |
|  | |||
| فیزیولوژی غواصی |
| ||||
| غواصی |
| ||||
| |||||
منابع
- Gay-Lussac, J. L. (L'An X – 1802), "Recherches sur la dilatation des gaz et des vapeurs", Annales de chimie, XLIII: 137 Check date values in:
|year=(help). English translation (extract). - Wikipedia contributors, "Charles's law," Wikipedia, The Free Encyclopedia, http://en.wikipedia.org/w/index.php?title=Charles%27s_law&oldid=493243537 (accessed May 18, 2012)
- Clapeyron, E. (1834), "Mémoire sur la puissance motrice de la chaleur", Journal de l'École Polytechnique, XIV: 153–90. Facsimile at the Bibliothèque nationale de France (pp. 153–90).
مفاهیم مول | |
|---|---|
| ثابتها | |
| کیفیتهای فیزیکی | |
| قوانین | |
پزشکی غواصی، فیزیولوژی، فیزیک و محیط زیست | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| پزشکی غواصی |
|  | ||||||||||||||
| فیزیولوژی غواصی |
| |||||||||||||||
| فیزیک غواصی |
| |||||||||||||||
| محیط زیست غواصی |
| |||||||||||||||
| پژوهشها درباره پزشکی غواصی, فیزیولوژی |
| |||||||||||||||
| Diving medical research organisations |
| |||||||||||||||
| ||||||||||||||||
علوم غواصی | |||||
|---|---|---|---|---|---|
| فیزیک غواصی |
|  | |||
| فیزیولوژی غواصی |
| ||||
| غواصی |
| ||||
| |||||
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
