پایستگی جرم
قانون پایستگی جرم یا پایستگی ماده:(Conservation of mass / matter) یکی از قوانین بنیادین فیزیک و شیمی است، بیان میکند که جرم و تعداد عناصر موجود در هر گونه شیمیایی در یک سیستم بسته صرف نظر از فرایندهایی که در درون آن در حال وقوع است، ثابت و تغییرناپذیر باقی میماند).البته در واکنش های هسته ای اینگونه نیست و پایستگی جرم نقض میشود که با تلفیق این قانون و قانون پایستگی انرژی به قانون پایستگی جرم و انرژی میرسیم که با توجه به فرمول E=ms^2 در تمامی مثال ها پایدار است)
| مکانیک محیطهای پیوسته |
|---|
اولین فردی که به صورت جدی این قانون را معرفی کرد آنتوان لاووازیه بود. هر چند پیش از لاووازیه افرادی از جمله حکیم مجریطی این قانون را توضیح دادند[1] اما این کار آنتوان لاووازیه بود که با به کارگیری ترازو به شکل تجربی انقلابی در شیمی پدید آورد و تعدادی از پدیدههای شیمیایی را از طریق این قانون توجیه کرد.[2] این نظریه در شیمی، مکانیک و دینامیک سیالات کاربردهای فراوانی دارد.
تاریخچه
نظریه ای مهم در یونان باستان موجود بود که بر طبق آن «هیچ از هیچ پدید نمیآید». بنابراین آنچه که امروز موجود است همواره وجود داشتهاست. پس موادی که قبلاً وجود نداشتهاند نمیتوانند به وجود بیایند. امپدوکلس در حدود چهار سده قبل از میلاد بیان میکند: «بوجود آمدن چیزها از ناچیز غیرممکن است و انسان نمیتواند در مورد عدم صحبت نموده یا آن را باعث شود.»[3]

سپس اپی کور در حدود سده سوم قبل از میلاد در تشریح طبیعت کائنات مینویسد:«کمیت چیزها همیشه به همین میزان بوده و به همین میزان نیز باقی خواهد ماند.»[4] فلسفه جانیسم نیز که بر عقاید مهاویرا (قرن ششم قبل از میلاد) استوار است در این زمینه اعتقاد دارد که هر چه در کائنات است از جمله ماده، نمیتواند نابود شده یا پدید آید.[5] خواجه نصیر طوسی نیز در قرن سیزدهم اصلی را بیان میکند که بر اساس آن «ماده نمیتواند کاملاً ناپدید شود بلکه تنها از شکلی به شکلی، از رنگی به رنگی تغییر حالت داده و خواص خود را از دست میدهد و به مواد اولیه یا موادی جدید تغییر حالت میدهد.»[6]
درستی نظریه
به موازات شکل گرفتن نظریه نسبیت خاص در ابتدای قرن بیستم قانون پایستاری جرم به عنوان خواهرخوانده قانون پایستگی انرژی همواره مد نظر بود. برای شرایط محیطی کره زمین و واکنش های غیر هسته ای این قانون همواره درست است. برای واکنش های هسته ای تغییرات جرم با معکوس تغییرات نوع دیگری از انرژی متناظر است. (در اینجا بحث پیرامون جرم در حال سکون ماده است. نسبیت به ما این اجازه را می دهد که انرژی جنبشی در ارتباط با تغییرات جرم نسبی را نیز توضیح دهیم، که البته تنها در مورد سرعت های نزدیک به سرعت نور کاربرد دارد.)
قوانین دیگر مانند پایستگی باریونیک و پایستگی بار رنگی در کنار پایستگی انرژی و همچنین قانون لاووازیه حالت های خاص دیگر این قانون می باشند.
قانون یا اصل لاووازیه
.jpg.webp)
پزشکی به نام ژان ری در سال ۱۶۳۰ اثری زیر عنوان مقاله ای در باب تحقیق پیرامون دلیل افزایش وزن سرب و قلع در هنگام تکلیس پدید می آورد که برای مدتی مدید مورد توجه قرار نمیگیرد.[7] در ۱۷۵۶ میخائیل لومونوسف با آزمایش هایی تجربی ثابت کرد که تئوری های موجود در مورد پدید آمدن و از بین رفتن مواد در واکنش های شیمیایی اشتباه بوده و این امر را پیش از سال ۱۷۷۴در نامه نگاری های خود برای لئونارد اولر توضیح می دهد. هر چند نظرات وی در برخی موارد چالش پذیر است.[8] و سرانجام لاووازیه در آکادمی علوم نظریه ای را ارائه داد که تا امروز به نام وی ثبت شده است:
«نه در کارهای هنری و نه در طبیعت هیچ چیز خلق نمیشود. و از آنجایی که کیفیت و کمیت مواد اصلی در هر واکنشی ثابت است می توان میزان ماده را پیش و پس از واکنش ها وزن نمود و دید که هیچ چیز نه به وجود می آید و نه از بین می رود. بلکه فقط از صورتی به صورت دیگر تبدیل می شود.»[9]
قانون پایستگی ماده در شیمی
این اظهار نظر لاوازیه که در واقع نسخه ای بهینه شده از نظریه فیلسوف یونانی آناگزاگُر دُ کلازُمِن (Anaxagore de Clazomènes) است با مثالی به شکل زیر قابل توضیح میباشد :
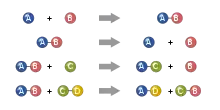
Ag++ Cl- → AgCl
در این واکنش یون نقره (+Ag) و یون کلر (-Cl) در سمت دیگر واکنش نه ناپدید نشده و نه پدید می آیند بلکه با یکدیگر پیوند شیمیایی حاصل نموده به هم متصل میشوند. اگر وزن کلی مواد سمت چپ واکنش ۱۰ گرم باشد وزن کلرید نقره حاصل نیز ۱۰ گرم است. آزمایشها لاووازیه تئوری فلوژیستُن که قائل به از بین رفتن یا به دست آوردن جرم در هنگام سوختن مواد بود را برای همیشه منقرض نمود.
قانون بقای جرم برای مدت چندین هزار سال به دلیل تأثیر نیروی شناوری اتمسفر زمین بر روی وزن گازها از نظر دور مانده بود. برای مثال وقتی یک قطعه چوب می سوزد و وزن خود را از دست میدهد به نظر میرسد که مقداری از جرم آن ناپدید شدهاست. در حالیکه در یک سیستم بسته مانند یک محفظه شیشه ای گاز بندی شده که هوای آن توسط تلنبه خارج شدهاست، (آنگونه که در قرن هفدهم صورت گرفت) میتوان نشان داد که آن مقدار از وزن چوب که در خاکستر آن قابل ردیابی نیست به گاز تبدیل شدهاست. درک این مساله به قدری مهم بود که دانش شیمی را در دویست سال بعد از آن به اندازه تمام دوهزار سال قبل گسترش داد. در پی این امر بود که بشر متوجه شد اندیشه تبدیل یک عنصر به عنصری دیگر از راه واکنشهای شیمیایی اندیشه ای عبث است و همین موضوع شیمی مدرن را جایگزین کیمیاگری نمود.
سپس ژان استاس با تعقیب کارهای لاووازیه و انجام آزمایشهایی دقیق و طاقت فرسا دقت این اصل را در واکنشهای شیمیایی نشان داد و همچنین نشان داد که در برخی واکنشها میزان جرم از دست رفته یا کسب شده نمیتواند بیش از ۰/۰۰۰۲ تا ۰/۰۰۰۴ جرم اولیه باشد.[10] تفاوت در میزان دقت آزمایشها لاووازیه از یک سو و استاس و مورلی از سوی دیگر بسیار زیاد است. [11]

انرژی واکنش
امروز میدانیم که آن چیزی که ما انرژی واکنش در یک واکنش شیمیایی می نامیم مربوط به ظبیعت کوانتومی ساختار الکترونی ماده است. این طبیعت کوانتومی ساختارهای الکترونی ممکن را محدود کرده و سطح انرژی متناظر با آنها را توضیح میدهد. یک واکنش شیمیایی در واقع تبدیل از یک ساختار به ساختار دیگری است. (حرکت از یک سطح انرژی به سطح انرژی دیگر)
برای اینکه سطح انرژی محصولات در سمت راست واکنش از سطح انرژی اولیه در سمت چپ واکنش بیشتر باشد، باید به واکنش انرژی داد. این واکنش اندوترمیک یا گرماگیر نامیده میشود.
اگر تراز انرژی محصولات در سمت راست واکنش از تراز انرژی اولیه در سمت چپ واکنش کمتر باشد، مقداری انرژی آزاد میشود. در این صورت واکنش اگزوترمیک یا گرمازا نامیده میشود که باعث گرم شدن دمای محیط خواهد شد.
در واکنش های هسته ای (همجوشی یا شکافت) جرم هسته مواد سمت راست و چپ واکنش با یکدیگر متفاوت است. این تفاوت جرم که خود را به صورت انرژی نشان میدهد با فرمول آشنای قابل محاسبه است. در این نظریه (نظریه نسبیت آینشتاین) انرژی آزاد شده (E) در واکنش به میزان جرم ماده در حالت اولیه (m) و سرعت نور (c) در خلا وابسته است.
انرژی آزاد شده در یک واکنش هسته ای بسیار بیشتر از انرژی آزاد شده در یک واکنش شیمیایی است. به عنوان مثال همجوشی یک پروتون و یک نوترون برای تشکیل یک هسته دوتریوم ۳/۳۶x۱۰-۱۳ j انرژی آزاد میکند در حالی که ترکیب هیدروژن و اکسیژن به ازای هر مولکول آب تنها ۴/۷۵x۱۰-۱۹ j انرژی آزاد می نماید که چیزی در حدود ۷۰۰۰۰۰ برابر کمتر از انرژی آزاد شده در تشکیل دوتریوم است. در واقع به جز واکنشهای هسته ای میزان انرژی وارد شده یا آزاد شده به صورت گرما، کار مکانیکی یا تابش الکترومغناطیس معمولاً به قدری کوچک است که تفاوت جرم در دو طرف واکنش قابل اندازهگیری نیست. (جرم ثابت میماند)
قانون پایستگی ماده در فیزیک مدرن
قانون پایستگی جرم با پیدایش نظریه نسبیت خاص به چالش کشیده شد. آینشتاین در یکی از دست نوشتههای خود در سال ۱۹۰۵ معادله ای برای برقراری رابطه بین ماده و انرژی ارائه میدهد که دارای چندین بخش از جمله ایده تبدیل انرژی درونی سیستم به جرم کل سیستم و یا تبدیل جرم به تابش الکترومغناطیس میباشد . همانطور که پیش تر هم اشاره شد ماکس پلانک بر این عقیده بود که میزان تغییر در جرم در نتیجه جذب یا استخراج انرژی شیمیایی به قدری کوچک است که اندازهگیری آن با ابزار در دسترس در آن زمان ممکن نبود و در نتیجه نمیتوانست به عنوان سندی دال بر آزمون نظریه نسبیت خاص قرار گیرد.
در حالیکه آینشتاین عقیده داشت که انرژی مرتبط با تابش رادیواکتیو به اندازه ای است که، قابل مقایسه با جرم سیستم تولیدکننده آن بوده و در صورتی که از سیستم خارج شود اندازهگیری تغییرات جرم آن ماده را ممکن میسازد. بعداً توسط کاکرافت و والتون مشخص شد که این پیشبینی درست بوده و نظریه آینشتاین در مورد کاهش جرم در صورت کاهش انرژی آزمون شد.
قانون پایستگی ماده در مکانیک سیالات به زبان ریاضی
بقای جرم قضیه انتقال رینولدز رابطه ای بین نرخ تغییرات سیستم و سطح کنترل و انتگرالهای حجم ایجاد میکنند ولی مشتقهای سیستم به معادلات اساسی مکانیک مربوطند.متغیر کمکیB به ترتیب جای جرم، اندازهٔ حرکت خطی، اندازه حرکت زاویه ای و انرژی را میگیرد. برای بقای جرم B=m میباشد .
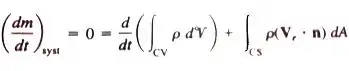
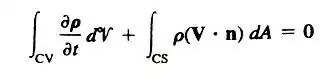
اگر جریان یک بعدی و حجم کنترل دارای چند ورودی و خروجی باشد آنگاه:
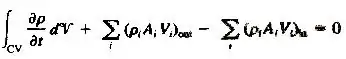
این حالات بیانگر لزوم معادل بودن جرم ورودی و خروجی در جریان پایدار است.علاوه بر این چنانچه ورودیها و خروجیها یک بعدی نیز باشند برای جریان پایدار خواهیم داشت:
اگر جریان در حجم کنترل پایدار باشد شارهای ورودی با خروجی موازنه میشود:
کمیت را می نامیم پس داریم:
بهطور کلی جریان پایدار بقای جرم به صورت زیر است:
جستارهای وابسته
منابع
- http://www.encyclopedia.com/doc/1G2-2830902778.html. پارامتر
|عنوان= یا |title=ناموجود یا خالی (کمک); پارامتر|پیوند=ناموجود یا خالی (کمک) - مورتیمر، چارلز (۱۳۷۳). شیمی عمومی. تهران: مرکز نشر دانشگاهی. صص. ۴.
- J. E. Raven; Malcolm Schofield (۱۹۸۳). The Presocratic Philosophers. Cambridge: Cambridge University Press. صص. ۲۹۱–۲۹۲. شابک ۹۷۸-۰-۵۲۱-۲۷۴۵۵-۵.
- Long, A. A.; D. N. Sedley (۱۹۸۷). (1987). "Epicureanism: The principals of conservation". The Hellenistic Philosophers. Vol 1:. Cambridge. صص. ۲۵–۲۶. شابک ۰-۵۲۱-۲۷۵۵۶-۳.
- Dundas, Paul; John Hinnels (۲۰۰۲). The Jains. London: London: Routledge. صص. ۲۴. شابک ۰-۴۱۵-۲۶۶۰۶-۸.
- Farid Alakbarov (Summer 2001). A 13th-Century Darwin? Tusi's Views on Evolution, Azerbaijan International 9 (2). پارامتر
|عنوان= یا |title=ناموجود یا خالی (کمک); پارامتر|پیوند=ناموجود یا خالی (کمک) - ", "An Historical Note on the Conservation of Mass", , 52, 10, 658-659, Oct 75". Journal of Chemical Education (به English). Robert D. Whitaker. Oct 1975. ISSN 10, 658-659 52, 10, 658-659 Check
|issn=value (help). - «Lomonosov and the Discovery of the Law of the Conservation of Matter in Chemical Transformations». Ambix. Pomper, Philip. اکتبر ۱۹۶۲.
- Lavoisier، Antoine (۱۷۸۹). Traité élémentaire de chimie. صص. p٫ ۱۴۰/۱۴۱.
- Ehret, William F. (1927-12). "A Course in General Chemistry. Third edition (McPherson, William; Henderson, William Edwards)". Journal of Chemical Education. 4 (12): 1561. doi:10.1021/ed004p1561. ISSN 0021-9584. Check date values in:
|date=(help) - Stokes, H. N. (1906-02). "THE STUDY OF CHEMICAL COMPOSITION, AN ACCOUNT OF ITS METHOD AND HISTORICAL DEVELOPMENT, WITH ILLUSTRATIVE QUOTATIONS". Journal of the American Chemical Society. 28 (2): 282–284. doi:10.1021/ja01968a016. ISSN 0002-7863. Check date values in:
|date=(help)