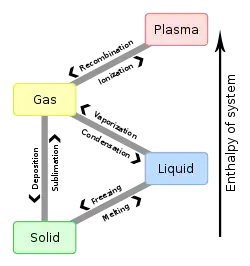
نقطه ذوب
نقطهٔ ذوب (به انگلیسی: Melting point) یا دمای ذوب به دمایی که در آن، ماده بهطور کامل از حالت جامد به مایع (یا بالعکس) تبدیل میشود، دمای ذوب (یا دمای انجماد) میگویند. دمای ذوب/انجماد در نمودارهای فازی بهعنوان نقطهٔ ذوب/نقطه انجماد مطرح میشود. تمامی نقاطی که روی خط میان فاز مایع و جامد قرار دارند، همگی بیانگر نقطهٔ انجماد/ذوب هستند. معروفترین نقطهٔ ذوب/نقطهٔ انجماد مربوط به آب است. نقطهٔ ذوب و انجماد همیشه برای مواد خالص در نظر گرفته میشود. ناخالصی و فشار روی نقطهٔ ذوب/انجماد تأثیر میگذارد. درحین ذوبشدن/منجمدشدن، دمای جسم ثابت میماند. وجود ناخالصی سبب کاهش نقطه ذوب میگردد
تفسیر میکروسکوپیِ ذوبشدن
در یک جسم جامد، مولکولهای تشکیلدهندهٔ آن در جای خود نوسان میکنند، ولی هنوز حالت کریستالی خود را حفظ کردهاند. اگر به جسم سخت گرما داده شود، این نوسانها بیشتر میشوند، تا زمانی که ساختار کریستالی از هم میپاشد و جسم مایع میشود.
نقطهٔ ذوب متجانس
موادی که دارای نقطهٔ ذوب متجانس هستند، در یک دمای خاص ذوب یا منجمد میشوند و تا پایان استحاله دمای آنها ثابت باقی میماند.
نقطهٔ ذوب نامتجانس
مواد دارای نقطهٔ ذوب نامتجانس در یک محدودهٔ دماییِ مشخص ذوب یا منجمد میشوند و در این محدوده با پایینرفتن دما مقدار فازِ جامد بیشتر شده و از مقدار فاز مایع کاسته میشود.
دمای انجماد
تعریف یک دما بهعنوان دمای ذوب یا دمای انجماد به دیدگاه ما از رژیم حرارتی بستگی دارد. هنگام گرم کردن، این نقطه، نقطهٔ ذوب، و هنگام سرد کردن، نقطهٔ انجماد است.

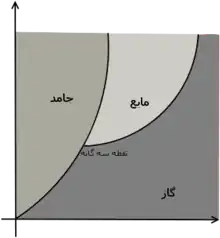
تأثیر فشار
فشار بر نقطهٔ ذوب/نقطهٔ انجماد مواد تأثیرگذار است. با بالارفتن فشار نقطهٔ ذوب/انجماد نیز بالا میرود. (البته یک استثنا وجود دارد: آب، که با فشار بالاتر، نقطهٔ ذوب آن پایین میآید).
با افزایش فشار، نقطهٔ ذوب یخ کاهش مییابد.
نمونهها
| فهرست مواد شیمیایی رایج | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ماده شیمیایی[upper-roman 1] | چگالی (گرمسانتیمتر مکعب) | نقطه ذوب (کلوین)[1] | نقطه جوش (K) | |||||||||
| آب در STP | 1 | ۲۷۳ | ۳۷۳ | |||||||||
| لحیم (Pb60Sn40) | ۴۵۶ | |||||||||||
| کره کاکائو | ۳۰۷٫۲ | - | ||||||||||
| پارافین | ۰٫۹ | ۳۱۰ | ۶۴۳ | |||||||||
| هیدروژن | ۰٫۰۰۰۰۸۹۸۸ | ۱۴٫۰۱ | ۲۰٫۲۸ | |||||||||
| هلیوم | ۰٫۰۰۰۱۷۸۵ | —[upper-roman 2] | ۴٫۲۲ | |||||||||
| بریلیم | ۱٫۸۵ | ۱۵۶۰ | ۲۷۴۲ | |||||||||
| کربن | ۲٫۲۶۷ | —[upper-roman 3][2] | ۴۰۰۰[upper-roman 3][2] | |||||||||
| نیتروژن | ۰٫۰۰۱۲۵۰۶ | ۶۳٫۱۵ | ۷۷٫۳۶ | |||||||||
| اکسیژن | ۰٫۰۰۱۴۲۹ | ۵۴٫۳۶ | - | |||||||||
| سدیم | ۰٫۹۷۱ | ۳۷۰٫۸۷ | ۱۱۵۶ | |||||||||
| منیزیم | ۱٫۷۳۸ | ۹۲۳ | ۱۳۶۳ | |||||||||
| آلومینیوم | ۲٫۶۹۸ | ۹۳۳٫۴۷ | ۲۷۹۲ | |||||||||
| گوگرد | ۲٫۰۶۷ | ۳۸۸٫۳۶ | ۷۱۷٫۸۷ | |||||||||
| کلر | ۰٫۰۰۳۲۱۴ | ۱۷۱٫۶ | ۲۳۹٫۱۱ | |||||||||
| پتاسیم | ۰٫۸۶۲ | ۳۳۶٫۵۳ | ۱۰۳۲ | |||||||||
| تیتانیم | ۴٫۵۴ | ۱۹۴۱ | ۳۵۶۰ | |||||||||
| آهن | ۷٫۸۷۴ | ۱۸۱۱ | ۳۱۳۴ | |||||||||
| نیکل | ۸٫۹۱۲ | ۱۷۲۸ | ۳۱۸۶ | |||||||||
| مس | ۸٫۹۶ | ۱۳۵۷٫۷۷ | ۲۸۳۵ | |||||||||
| روی | ۷٫۱۳۴ | ۶۹۲٫۸۸ | ۱۱۸۰ | |||||||||
| گالیم | ۵٫۹۰۷ | ۳۰۲٫۹۱۴۶ | ۲۶۷۳ | |||||||||
| نقره | ۱۰٫۵۰۱ | ۱۲۳۴٫۹۳ | ۲۴۳۵ | |||||||||
| کادمیم | ۸٫۶۹ | ۵۹۴٫۲۲ | ۱۰۴۰ | |||||||||
| ایندیم | ۷٫۳۱ | ۴۲۹٫۷۵ | ۲۳۴۵ | |||||||||
| ید | ۴٫۹۳ | ۳۸۶٫۸۵ | ۴۵۷٫۴ | |||||||||
| تانتال | ۱۶٫۶۵۴ | ۳۲۹۰ | ۵۷۳۱ | |||||||||
| تنگستن | ۱۹٫۲۵ | ۳۶۹۵ | ۵۸۲۸ | |||||||||
| پلاتین | ۲۱٫۴۶ | ۲۰۴۱٫۴ | ۴۰۹۸ | |||||||||
| طلا | ۱۹٫۲۸۲ | ۱۳۳۷٫۳۳ | ۳۱۲۹ | |||||||||
| جیوه | ۱۳٫۵۳۳۶ | ۲۳۴٫۴۳ | ۶۲۹٫۸۸ | |||||||||
| سرب | ۱۱٫۳۴۲ | ۶۰۰٫۶۱ | ۲۰۲۲ | |||||||||
| بیسموت | ۹٫۸۰۷ | ۵۴۴٫۷ | ۱۸۳۷ | |||||||||
یادداشتها
| ||||||||||||
جستارهای وابسته
منابع
- Holman, S. W.; Lawrence, R. R.; Barr, L. (1 January 1895). "Melting Points of Aluminum, Silver, Gold, Copper, and Platinum". Proceedings of the American Academy of Arts and Sciences. 31: 218–233. doi:10.2307/20020628. JSTOR 20020628.
- "Carbon". rsc.org.
مشارکتکنندگان ویکیپدیا. «Gefrierpunkt». در دانشنامهٔ ویکیپدیای آلمانی، بازبینیشده در آوریل ۲۰۱۰.
Horst Kuchling (۲۰۰۱)، «Wärmelehre»، Taschenbuch der Physik، Leipzig: Fachbuchverlag Leipzig، ص. ۲۶۹-۲۷۰، شابک ۳-۴۴۶-۲۲۸۸۳-۷