خواص کولیگاتیو
خواص کولیگاتیو(به انگلیسی: Colligative properties) خواصی از یک محلول می باشد که به غلظت ذرات حل شده در آن بستگی داشته باشد نه به نوع و ماهیت این ذرات.این خواص عبارت اند از:فشار بخار،دمای انجماد،دمای جوش و فشار اسمزی.[1]
اثر افزایش غلظت بر خواص کولیگاتیو
چون خواص کولیگاتیو وابسته به غلظت هستند متاثر از آن نیز هستند.
اثر افزایش غلظت بر فشار بخار
تبخیر سطحی به معنی جدا شدن مولکولهای مایع از سطح آن است که میتواند بر اثر آن به دیواره های ظرف،مولکولهای هوا و.... فشار وارد شود،فشار ناشی از حضور مولکولهای بخار مایع در بالای سطح آن را فشار بخار میگویند،این فشار در دمای معین ثابت است
در اثر افزایش غلظت به جای تعدادی از مولکولهای حلال مولکولهای حل شونده قرار میگیرند اگر حل شونده غیر فرار باشد آن گاه به خاطر کاهش تعداد مولکولهای تبخیر شده فشار بخار مایع کاهش میابد[2][3]
اثر افزایش غلظت بر دمای جوش
تبخیر زمانی رخ میدهد که فشار بخار مایع با فشار هوای محیط برابر شود،چون افزایش غلظت فشار بخار محلول را کاهش میدهد در نتیجه انرزی بیشتری نیاز است تا مولکولهای عمقی تر محلول بر اثر جنب و جوش خود به سطح آمده تبخیر شده و باعث افزایش فشار بخار شوند در نتیجه افزایش غلظت باعث افزایش نقطه ی جوش(میعان)هستند[2][3]
محاسبه ی نقطه ی جوش محلول ها
به طور کلی از فرمول زیر محاسبه میشود:
Tb = Kb X m∆ در این معادله Tb∆ صعود نقطه جوش بر حسب درجه سیلسیوس ، m مولالیته و Kb ثابت مربوط به حلال مورد نظر است[4] (در بخش پیوست برخی Kb هایی را برای نمونه ذکر کرده ایم).
میزان افزایش دمای نقطهٔ جوش برای محلولهای آبی
از آن جا که Kb برای آب ۰٫۵۲ درجه میباشد[3][4] از فرمول زیر محاسبه میگردد
میزان افزایش دمای نقطهٔ جوش=۰/۶۲*تعداد مول حاصل از انحلال یک مول حل شونده*غلظت مولال[3] .
اثر افزایش غلظت بر دمای ذوب
1.برای خود به خودی بودن واکنش نیاز است عوامل آنتالپی و آنتروپی بررسی شوند
2.زمانی عامل آنتروپی مساعد است که تغییرات آنتروپی مثبت باشد
3.زمانی عامل آنتالپی مساعد است که تغییرات آن منفی باشد
4.آنتروپی یخ از آب کمتر است
5.آنتروپی محلول هاز از مایع خالص بیشتر است
6.به طور کلی امکان خود به خودی بودن یا نبودن واکنش از طریق فرمول انرژی آزاد گیبس بررسی میشود پس واکنش هایی که عامل آنتروپی نا مساعد دارند برای انجام نیاز به عامل آنتاپی مساعد دارند .
چون حالت جامد آنتروپی کمتری نسبت به مایع دارد فرآیند انجماد باید با کاهش آنتالپی همراه باشد،چون آنتروپی محلول بیشتر از مایع خالص است پس تغیرات آنتروپی آن برای انجماد شدید تر است(یشتر کاهش میاد)پس برای اینکه از نظر ترمودینامیکی وقوع آن ممکن شود لازم است تغییرات آنتالپی آن نیز شدید تر باشد(بیشتر کاهش یابد)پس افزایش غلظت موجب کاهش یافتن دمای انجماد(ذوب) میشود.[2][3]
محاسبه ی نقطه ی انجماد محلول ه
فرمول کلی برای این محاسبه عبارت است از:Tf = Kf x m∆ در این معادله Tf∆ نزول نقطه ی جوش بر حسب درجه سیلسیوس ، m غلظت مولال و Kf ثابت مربوط به حلال مورد نظر است.[4](در بخش پیوست برخی Kf هایی را برای نمونه ذکر کرده ایم)
میزان کاهش دمای نقطه ی انجماد برای محلول های آبی
از آن جا که Kf برای آب 1/86- میباشد[4][5] میزان کاهش نقطه ی انجماد محلول های آبی از فرمول زیر محاسبه می گردد:
میزان کاهش دمای نقطه ی انجماد=1/86–*تعداد مول حاصل از انحلال یک مول حل شونده*غلظت مولال[3]
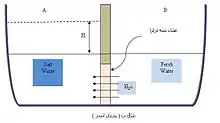
اثر افزایش غلظت بر فشار اسمزی
هرچه غلظت افزایش یابد فشار اسمزی هم افزایش می یابد
محاسبه ی اثر غلظت بر فشار اسمزی
π = MRT
در این معادله ، π فشار اسمزی بر حسب اتمسفر ، M مولاریته ، R [null ثابت جهانی گازها] (0.0821Lit.atm/mol˚K) و T دمابر حسب کلوین میباشد.
چون M = n/V که در آن n تعداد مولها و V حجم هستند، بنابراین πV = nRT . [4]
کاربردها
برای کاربرد های اثر افزایش غلظت بر تغییرات خواص کولیگاتیو نمونه های متعددی وجود دارد که از آن جمله میتوان به استفاده از ضد یخ برای افزایش نقطه ی جوش و و کاهش نقطه ی ذوب و در نتیجه افزایش گستره ی مایع بودن آب درون رادیاتور خودروها اشره کرد
پیوست
1.فهرست دمای جوش و انجماد حلالها[5]
| حلال | دمای جوش (°C) | Kb(°C/(mol kg−۱)) | دمای انجماد (°C) | Kf (°C/(mol kg−۱)) | منبع داده ها |
|---|---|---|---|---|---|
| آنیلین | ۱۸۴٫۳ | ۳٫۶۹ | –۵٫۹۶ | –۵٫۸۷ | Kb & Kf |
| لوریک اسید | ۲۹۸٫۹ | ۴۴ | –۳٫۹ | ||
| استیک اسید | ۱۱۸٫۱ | ۳٫۰۷ | ۱۶٫۶ | –۳٫۹۰ | Kb Kf |
| استون | ۵۶٫۲ | ۱٫۶۷ | –۹۴٫۸ | Kb | |
| بنزن | ۸۰٫۱ | ۲٫۶۵ | ۵٫۵ | –۵٫۱۲ | Kb & Kf |
| برموبنزن | ۱۵۶٫۰ | ۶٫۲۶ | |||
| کافور | ۲۰۴٫۰ | ۵٫۹۵ | ۱۷۹ | –۴۰ | Kf |
| کربن دیسولفید | ۴۶٫۲ | ۲٫۳۴ | –۱۱۱٫۵ | –۳٫۸۳ | |
| کربن تتراکلرید | ۷۶٫۸ | ۴٫۸۸ | –۲۲٫۸ | –۲۹٫۸ | Kb & Kf |
| کلروفرم | ۶۱٫۲ | ۳٫۸۸ | –۶۳٫۵ | –۴٫۹۰ | Kb & Kf |
| سیکلوهگزان | ۸۰٫۷۴ | ۲٫۷۹ | ۶٫۵۵ | –۲۰٫۲ | |
| دیاتیل اتر | ۳۴٫۵ | ۲٫۱۶ | –۱۱۶٫۲ | –۱٫۷۹ | Kb & Kf |
| اتانول | ۷۸٫۴ | ۱٫۱۹ | –۱۱۴٫۶ | –۱٫۹۹ | Kb |
| ۲،۱-دیبرمواتان | ۱۳۰٫۰ | ۶٫۴۳ | ۹٫۹۷۴ | –۱۲٫۵ | Kb & Kf |
| فرومیک اسید | ۱۰۱٫۰ | ۲٫۴ | ۸٫۰ | –۲٫۷۷ | Kb & Kf |
| نفتالین | ۲۱۷٫۹ | ۸۰٫۲ | –۶٫۸۰ | ||
| نیتروبنزن | ۲۱۰٫۸ | ۵٫۲۴ | ۵٫۷ | –۷٫۰۰ | |
| فنول | ۱۸۱٫۷۵ | ۳٫۶۰ | ۴۳٫۰ | –۷٫۲۷ | Kf Kb |
| آب | ۱۰۰٫۰۰ | ۰٫۵۱۲ | ٤٫۰ | –۱٫۸۶ | Kb & Kf |
جستارهای وابسته
منابع
- مورتیمر، چارلز.شیمی عمومی۱.تهران:نشر علوم دانشگاهی،۱۳۸۳
- هییت تالیف کتب درسی (۱۳۹۴). کتب دبیرستان.
- سپهری، نیما (۱۳۹۲). شیمی سه. خیلی سبز. صص. ۵۵۱،۵۵۲،۵۵۷،۵۶۰،. شابک ۹۷۸-۶۰۰-۵۵۰۶-۷۳-۰.
- «خواص کولیگاتیو».
- هییت تالیف کتب درسی (۱۳۹۴). شیمی3 و آزمایشگاه. شرکت چاپ و نشر کتابهای درسی ایران. صص. ۹۴. شابک ۹۶۴-۰۵-۱۳۵۵-۵.