نفتالین
نفتالین که به نامهای «آلبوکربن»، «کافور قیر»، «قیر سفید» یا «نفتالن» نیز گفته میشود؛ یک هیدروکربن آروماتیک است که به شکل گلولههای کوچک به بازار میآیند و حالت جامد و رنگ سفیدی دارد. نفتالین به تندی تصعید می شود و بخاری بسیار آتش زا دارد. مولکول نفتالین از دو حلقهٔ جوش خوردهٔ بنزن ساخته شدهاست. از زغال سنگ به دست میآید و به فتالیک انیدرید برای ساخت پلاستیکها، رنگها و حلکنندهها به کار میرود. نفتالین برای گندزدایی و حشره کشی (بیشتر حل شده در متانول) کاربرد فراوانی دارد. نفتالین را برای جلوگیری از بید زدن فرش و پارچههای پشمی نیز به کار میبرند.
| نفتالین | |
|---|---|
| align="center" colspan="۲ | |
| شناسنامه | |
| نامگذاری آیوپاک | نفتالین |
| نامهای دیگر | قیر سفید،سیکلودکن، کافورقیر قرص بید () |
| فرمول مولکولی | C۱۰H۸ |
| SMILES | C۱(C=CC=C۲)=C۲C=CC=C۱ |
| جرم مولی | ۱۲۸٫۱۷ g/mol |
| نما (ظاهر) | قرص/بلورهای جامد سفید |
| CAS number | [۹۱-۲۰-۳] |
| ویژگیها | |
| چگالی و حالت فیزیکی | ۱٫۱۴ g/cm۳ |
| حلالیت در آب | حل نشدنی درآب |
| دمای ذوب | ۸۰٫۲۶ °C |
| دمای جوشش | ۲۱۸ °C |
| ایمنی | |
| لوزی آتش | |
| دمای فلش | ۷۹–۸۷ °C |
| دمای اشتعال خودبه خودی | ۵۲۵ °C |
| R/S statement | R: ۲۰، ۲۱، ۲۲، ۳۶، ۳۷، ۳۸، ۴۳، ۴۵ S: ۱۶، ۲۶، ۳۶، ۳۷، ۳۹، ۴۵ |
| آرتیایسیاس شمارهٔ | QJ۰۵۲۵۰۰۰ |
| ترموشیمی | |
| ΔfH۰گاز | ۹۵٫۳۵ kJ/mol |
| ΔfH۰مایع | ۵۰٫۶۳ kJ/mol |
| ΔfH۰جامد | ۳۷٫۶۳ kJ/mol |
| ΔHsub | ۷۲٫۹ kJ/mol |
| ΔHFus | ۱۹٫۰۵ kJ/mol |
| ΔHVap | ۴۴٫۷ kJ/mol |
| S۰گاز، ۱ بار | ۲۳۸٫۶۶ J/mol·K |
| S۰مایع، ۱ بار | ۱۲۱٫۵۲ J/mol·K |
| S۰جامد | ? J/mol·K |
| ظرفیت گرمایی (C) | ۱۶۵٫۷۲ J/mol·K |
| ساختار | |
| نمای مولکولی | هرمی در N |
| گشتاور دوقطبی | ?D |
| ترکیبهای وابسته | |
| هیدراتهای وابسته | هیدروژن پراکسید |
| ترکیبهای وابسته | آمونیاک، منو متیل هیدرازین، دی متیل هیدرازین، فنیل هیدرازین |
| راهنمای مواد خطرناک | |
| به جز بجشهای گفته شده، دادههای داده شده درباره ی مادهها در شرایط استاندارد(در ۲۵°C, ۱۰۰ کیلو پاسکال) بستهٔ دادههای شیمیایی وسرزدنیها (مرجعها) ی ویکیپدیا | |
تاریخچه
سال ۱۸۱۹ و ۱۸۲۰، دست کم دو شیمیدان مادهٔ جامد سفیدی با بوی زننده گزارش کردند که از تقطیر زغال سنگ به دست میآید. سال ۱۸۲۱، جان کید(John Kidd) بسیاری از ویژگیهای این مادهها و روشهای فرآوری آنها پیدا کرد و نام نفتالین را برای این ماده پیشنهاد کرد (چون این ماده از گونهای نفتا -که نام گستردهای که برای آمیختهای از هیدروکربنهای فرار و آتشگیر که زغال سنگ را نیز دربرمی گیرند؛ میشود. - به دست آمده بود) در ادامه فرمول شیمیایی آن توسط مایکل فارادی (Michael Faraday) در سال ۱۸۲۶ کشف شد. ساختار مولکولل آن نیز در سال ۱۸۶۶ توسط امیل ارلنمایر (Emil Erlenmeyer) کشف و سه سال بعد توسط کارل گریب (Carl Gräbe) تأیید شد. همچنین این ماده بهطور اتفاقی از روی میز داروخانه چی بر روی زمین افتاد و فردا صبح وی با جسد کشته شدهٔ چند سوسک مواجه شد. از آن پس در گند زدایی و دفع حشرات نیز مورد استفاده قرار میگیرد.
هشدار
طبق نظر «آژانس مواد شیمیایی اروپا»، نفتالین ماده ایست بسیار سمی. نفتالین به پوست انسان صدمه سنگینی میزند. ایست تنفسی، صدمههای جبرانناپذیر به کبد، کلیه، چشم و روده از دیگر عوارض خطرناک نفتالین هستند.[1]
منابع تولید
گذشته از قطران زغال سنگ، مقدار بسیار کم از نفتالین توسط magnolias و انواع خاصی از آهو و هم چنین توسط موریانه قنات در برابر مورچهها و قارچهای سمی تولید میشود. نفتالین در شهاب سنگها نیز یافت میشود.[2]
ساختار شیمیایی
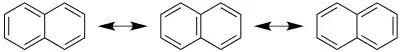
نفتالن (نفتالین) مادهای مولکولی با فرمول C10H8 است که در گروه مواد آلی آروماتیک قرار میگیرد. مولکولهای این ماده از دو حلقهٔ بنزنی ساخته شدهاند که در یک پیوند C-C مشترک هستند (به هم جوش خوردهاند). بنابراین این مولکول هم مانند بنزن دارای «رزونانس» است[3]. سه ساختار رزونانسی این مولکول به شکل زیر هستند:
به خاطر وجود این ساختارها، نفتالن دارای دو طول مختلف برای پیوندهای C-C است[4].
واکنشهای شیمیایی
نفتالن در واکنشهای کلی و عمومی ترکیبهای آروماتیک شرکت میکند. این واکنشها از نوع جانشینی الکتروندوستی هستند که طی آن یک گونهٔ کمالکترون (الکتروندوست)، جانشین یکی از هیدروژنها در مولکول نفتالن میشود و دو نوع محصول ایزومری تولید میکند[5].
دیگر واکنشی که نفتالن در آن شرکت میکند، واکنش سوختن است که مشترک بین تقریباً تمام مواد آلی است. نفتالن مانند بیشتر مواد آروماتیک، هنگام سوختن، علاوه بر آب و دی اکسید کربن، دوده هم تولید میکند (سوختن ناقص).
منابع
- متن پیوند، متن اضافی.
- General Chemistry, Chapter 28; Charles E. Mortimer
- Organic Chemistry, Chapter 14; Morrison & Boyd; 6th Edition
- Organic Chemistry, Chapter 15; Morrison & Boyd; 6th Edition
| در ویکیانبار پروندههایی دربارهٔ نفتالین موجود است. |
- مشارکتکنندگان ویکیپدیا. «Naphthalene». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۳ می ۲۰۱۱.