آمونیوم
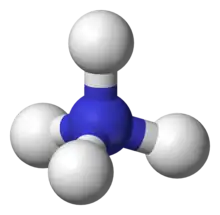
آمونیوم (به انگلیسی: ammonium یا aminium) با فرمول شیمیایی NH۴+ یک کاتیون چنداتمی با یک بار مثبت است. این کاتیون با از دست دادن یک الکترون از ساختار آمونیاک (NH۳) بدست آمدهاست. همچنین آمونیوم یک نام عمومی است که برای مواد دارای بار مثبت یا آمینهای پروتون گرفته یا کاتیونهای چهارتایی آمونیوم (N+R۴) که در آن یک یا تعداد بیشتر ی از اتمهای هیدروژن با رادیکالهای آزاد آلی (R) جایگزین شدهاند، به کار میرود.
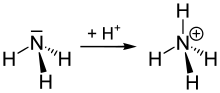
آیوپاک برای NH۴+ نام آزانیوم (azanium) را به جای آمونیوم برگزیدهاست. همچنین به آمونیوم، «آمونیاک یونیزه شده» نیز میگویند.
ویژگیهای پایهٔ اسیدی

4 is 9.25.
با توجه به رابطهٔ زیر میتوان گفت که آمونیوم به صورت میانه اسید است:
- NH۴+ + :B- → HB + NH۳
بنابراین محلول غلیظ نمکهای آمونیوم با بازهای قوی تولید آمونیاک میکند. هنگامی که آمونیاک در آب حل میشود مقدار کمی از آن به یون آمونیوم تبدیل میگردد:
- H۳O+ + NH۳
 H۲O + NH۴+
H۲O + NH۴+
اینکه آمونیاک تبدیل به یون آمونیوم شود بستگی به pH محلول آن دارد. اگر pH پایین باشد تعادل به سمت راست متمایل میشود و مولکولهای آمونیاک بیشتری تبدیل به یون آمونیوم میگردد ولی اگر pH بالا باشد (غلظت یون هیدروژن کم باشد) تعادل به سمت چپ متمایل میشود و یون هیدروکسید پروتون آمونیوم را نگه میدارد و ما بیشتر آمونیاک خواهیم داشت.
ترکیبهای آمونیوم میتوانند در حالت بخار روی میدهند. برای نمونه: هنگامی که بخار آمونیاک در تماس با بخار کلرید هیدروژن قرار گیرد، ابر سفیدی از آمونیوم تشکیل میشود که خیلی زود به صورت یک لایهٔ نازک جامد روی سطح تهنشین میگردد.
بازگشت آمونیوم به آمونیاک بسیار آسان است و با اضافه کردن یک محلول قلیایی قوی انجام میشود.
نمکهای آمونیوم
کاتیون آمونیوم را میتوان در میان نمکهای گوناگون پیدا کرد، مانند آمونیوم کربنات، آمونیوم کلرید و آمونیوم نیترات. بیشتر نمکهای آمونیوم به آسانی در آب حل میشوند ولی هگزاکلروپلاتینات آمونیوم تنها نمکی است که این گونه نیست. نخستین بار هدف از تشکیل این نمک در یک آزمایش برای آمونیوم بود. نمکهای آمونیوم که از نیترات و به ویژه پرکلرات درست شدهاند به شدت انفجاریاند. در این موردها آمونیوم نقش عامل کاهنده را دارد.
در یک فرایند غیر معمول، یونهای آمونیوم تشکیل ملغمه میدهند. این فراوردهها بوسیلهٔ برقکافت یک محلول آمونیوم با استفاده از یک کاتد جیوه ای ایجاد میشوند.[1] این ملغمه سرانجام تجزیه میشود تا آمونیوم و هیدروژن تولید کند.[2]
ساختار و پیوندها
جفت الکترون آزاد (جفت لون) روی اتم نیتروژن (N) در آمونیاک که به صورت دو نقطهٔ توپر نمایش داده شدهاست، با یک پروتون (+H) پیوند برقرار میکند؛ بنابراین هر چهار پیوند N-H در تعادل قرار میگیرند (پیوند کوالانسی). در بحث اندازه، کاتیون آمونیوم (rionic = ۱۷۵ pm) شبیه کاتیون سزیم (rionic = ۱۸۳ pm) است.
یونهای آلی آمونیوم
- نگاه کنید به: آمین
فلز آمونیوم
انتظار میرود تا آمونیوم در فشارهای بسیار بالا مانند یک فلز رفتار کند (یون NH۴+ در دریای الکترونها) مانند آنچه که در سیارههای غول گازی رخ میدهد. دو پیوند زیر را نگاه کنید:

