ملغمه
به هر آلیاژی از جیوه، مَلغَمه یا آمالگام (به انگلیسی: Amalgam) گفته میشود.[1] بسته به نسبت جیوه، ممکن است مایع، خمیر نرم یا جامد باشد. این آلیاژها از طریق پیوند فلزی،[2] با نیروی جاذبه الکترواستاتیک الکترونهای رسانایی که برای اتصال همه یونهای فلزی با بار مثبت به یکدیگر در یک ساختار شبکه بلوری ایجاد میشوند، تشکیل میشوند.[3] تقریباً تمام فلزات میتوانند با جیوه، امالگام تشکیل دهند. موارد استثناء آهن، پلاتین، تنگستن و تانتالوم هستند. آمالگامهای جیوه - نقره در دندانپزشکی مهم هستند و از آمالگام جیوه - طلا در استخراج طلا از سنگ معدن استفاده میشود. در دندانپزشکی از آلیاژهای جیوه با فلزاتی مانند نقره، مس، ایندیوم، قلع و روی استفاده میکنند.

آمالگامهای مهم
آمالگام روی
آمالگام روی در سنتز آلی استفاده میشود (به عنوان مثال، برای کاهش Clemmensen).[4] این آلیاژ عامل کاهنده در کاهنده جونز است که در شیمی تحلیلی استفاده میشود. در گذشته صفحات روی در باتریهای خشک را با مقدار کمی جیوه ترکیب میکردند تا از خرابی آنها در زمان نگهداری جلوگیری کنند. این یک محلول مایع-جامد از جیوه و روی است.
آمالگام پتاسیوم
برای فلزات قلیایی، فرایند تولید آمالگام گرمازا است و آمالگام پتاسیوم اشکال شیمیایی متفاوتی مانند KHg و KHg2 دارد.[5] KHg یک ترکیب طلایی رنگ با نقطه ذوب ۱۷۸ درجه سانتیگراد و KHg2 یک ترکیب نقره ای رنگ با نقطه ذوب ۲۷۸ درجه سانتیگراد است. این آمالگامها به هوا و آب بسیار حساس هستند، اما میتوان با آنها تحت نیتروژن خشک کار کرد. فاصله Hg-Hg حدود ۳۰۰ پیکومتر و فاصله Hg-K حدود ۳۵۸ پیکومتر است.
فازهای K5Hg7 و KHg11 نیز شناخته شدهاند. آمالگام سدیم (NaHg2) ساختار متفاوتی دارد، به طوری که اتمهای جیوه لایههای شش ضلعی تشکیل میدهند و اتمهای سدیم یک زنجیره خطی تشکیل میدهند که در سوراخهای لایههای شش ضلعی قرار میگیرد، اما اتم پتاسیم برای کارکرد در ساختار KHg2 خیلی بزرگ است.
آمالگام سدیم
آمالگام سدیم به عنوان محصول جانبی فرایند کلرآلکالی تولید میشود و به عنوان یک عامل کاهنده مهم در شیمی آلی و غیرآلی استفاده میشود. بوسیله آب، آن را به محلول غلیظ سدیم هیدروکسید، هیدروژن و جیوه تجزیه میکنند، سپس میتواند دوباره به فرایند کلرالکالی برگردد. اگر به جای آب از الکل کاملاً بدون آب استفاده شود، به جای محلول قلیایی، نمک سدیم و الکل تولید میشود.
آمالگام آلومینیوم
آلومینیوم میتواند از طریق واکنش با جیوه، آمالگام ایجاد کند. آمالگام آلومینیوم را میتوان با ساییدن گلولههای آلومینیوم یا سیم در جیوه، یا اجازه دادن به سیم یا فویل آلومینیوم برای واکنش با محلول کلرید جیوه، تهیه کرد. این آمالگام به عنوان معرف برای کاهش ترکیبات مانند کاهش ایمینها به آمینها استفاده میشود. آلومینیوم اهدا کننده نهایی الکترون است و جیوه به عنوان واسطه در انتقال الکترون عمل میکند.[6] واکنش خود آلومینیوم و زبالههای حاصل از آن حاوی جیوه است، بنابراین احتیاطهای ویژه و روشهای دفع مورد نیاز است. به عنوان یک گزینه سازگار با محیط زیست، از هیدریدها یا سایر عوامل کاهنده اغلب میتوان برای رسیدن به همان نتیجه استفاده کرد. یکی دیگر از گزینههای سازگار با محیط زیست، آلیاژ آلومینیوم و گالیوم است که به همین ترتیب با جلوگیری از تشکیل یک لایه اکسید، آلومینیوم را واکنش پذیرتر میکند.
آمالگام قلع
آمالگام قلع در اواسط قرن نوزدهم به عنوان پوشش آینه ای بازتابنده استفاده میشد.[7]
آمالگامهای دیگر
انواع آمالگامها شناخته شدهاند که بیشتر در زمینه تحقیق مورد توجه هستند.
- آمالگام آمونیوم یک توده خاکستری، نرم و اسفنجی است که در سال ۱۸۰۸ توسط همفری دیوی و یونس جاکوب برزلیوس کشف شد. به راحتی در دمای اتاق یا در تماس با آب یا الکل تجزیه میشود:
- آمالگام تالیم دارای نقطه انجماد ۵۸- درجه سانتیگراد است، که کمتر از جیوه خالص (۳۸٫۸ − درجه سانتیگراد) است، بنابراین در دماسنجهای دمای پایین کاربرد پیدا کردهاست.
- آمالگام طلا: طلای تصفیه شده، در صورت تمیز شدن و تماس با جیوه در جایی که سطح هر دو فلز تمیز باشد، به راحتی و به سرعت ترکیب میشود و آلیاژهایی از AuHg2 تا Au8Hg تشکیل میدهد.[8]
- سرب تشکیل آمالگام میدهد درصورتی که برادههای آن با جیوه مخلوط شوند و همچنین در طبقهبندی نیکل - استرانز به عنوان آلیاژ طبیعی به نام آمالگام قلع ذکر شدهاست.[9]
آمالگام دندانی
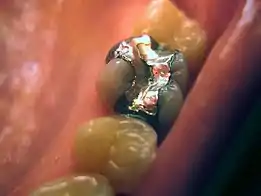
دندانپزشکی از آلیاژهای جیوه با فلزاتی مانند نقره، مس، ایندیوم، قلع و روی استفاده کردهاست. آمالگام یک ماده ترمیم کننده عالی است و به چند دلیل در دندانپزشکی استفاده میشود. استفاده و دستکاری آن در هنگام قرار دادن ارزان و نسبتاً آسان است. برای مدت کوتاهی نرم میماند بنابراین میتواند بستهبندی شود تا هر حجم نامنظمی را پر کند و سپس یک ترکیب سخت تشکیل میدهد. آمالگام در مقایسه با سایر مواد ترمیم کننده مستقیم، مانند کامپوزیت، طول عمر بیشتری دارد. با این حال، این تفاوت با توسعه مداوم رزینهای کامپوزیت کاهش یافتهاست.
آمالگام معمولاً با کامپوزیتهای پایه رزین مقایسه میشود زیرا بسیاری از کاربردها مشابه هستند و بسیاری از خصوصیات و هزینههای فیزیکی قابل مقایسه هستند. در ژوئیه ۲۰۱۸ اتحادیه اروپا آمالگام را برای درمان دندانپزشکی کودکان زیر ۱۵ سال و زنان باردار یا شیرده ممنوع کرد.[10]
استفاده در استخراج
به دلیل راحتی و سهولت ادغام جیوه و فلزات گرانبها، از جیوه در استخراج طلا و نقره استفاده شدهاست. در استخراج طلا، که در آن ذرات معدودی از طلا از ذخایر شن و ماسه شسته میشود، از جیوه اغلب برای جدا کردن طلا از سایر مواد معدنی سنگین استفاده میشد.
پس از خارج شدن تمام فلزات عملیاتی از سنگ معدن، جیوه در یک ماسوره مس طولانی توزیع میشود، که در قسمت خارجی آن یک پوشش نازک از جیوه تشکیل میشود. پس از آن زباله سنگ معدن به داخل دهانه انتقال داده میشود و طلای موجود در زباله با جیوه ترکیب میشود. سپس این پوشش برای از بین بردن جیوه، تصفیه میشود و تا حدودی طلای با خلوص بالا را به جا میگذارد.
برای اولین بار با توسعه فرایند پاسیو در مکزیک در سال ۱۵۵۷ از ترکیب جیوه در سنگ معدن نقره استفاده شد. همچنین فرآیندهای آمیختگی برای پردازش سنگ معدن نقره ایجاد شدهاست، از جمله فرایند واشو.
استخراج
آمالگام طلا در مواقعی که نمیتوان طلا را از سنگ معدن آن، بوسیله روشهای هیدرو مکانیکی استخراج کرد، کاربردی است. مقادیر زیادی جیوه در استخراج طلا از رسوبات مورد استفاده قرار میگیرد. آمالگام تشکیل شده در این فرایند یک توده جامد سنگین از رنگ خاکستری مات است. (استفاده از جیوه در استخراج مواد از رسوبات در قرن نوزدهم در کالیفرنیا که اکنون ممنوع است، باعث ایجاد مشکلات آلودگی گسترده در محیطهای رودخانه ای شده بود که تا به امروز ادامه دارد)
فرآوری سنگ معدن
در بخشی از فرایند فرآوری سنگ معدن طلا از جیوه و صفحات مسی مرطوب استفاده میشود.
پالایش
آماگام حاصل از هردو فرایند در یک محفظه پلایش تقطیری گرما داده میشود تا جیوه را برای استفاده مجدد بازیابی کنند و طلا را بدست آورند. از آنجایی که این فرایند بخارهای جیوه را به اتمسفر منتقل میکند، این روند میتواند اثرات نامطلوبی بر سلامتی داشته باشد و آلودگی طولانی مدت ایجاد کند.
امروزه در کشورهای پیشرفته، فرایند بازیابی نقره و طلا بوسیله امالگام جیوه با روشها دیگر جایگزین شدهاست. خطرات زبالههای سمی جیوهای نقشی اساسی در حذف تدریجی فرآیندهای استخراج بوسیله آمالگام جیوه، داشتهاند. با این حال، ادغام جیوه هنوز هم توسط معدنچیان در مقیاس کوچک برای استخراج طلا از رسوبات (اغلب بهطور غیرقانونی)، به ویژه در کشورهای در حال توسعه استفاده میشود.
شناساگر آمالگام

نمکهای جیوه در مقایسه با فلز جیوه و آمالگامها به دلیل حلالیت در آب بسیار سمی هستند. وجود این نمکها در آب را میتوان با شناساگر که از تمایل یونهای جیوه برای تشکیل آمالگام با مس استفاده میکند، تشخیص داد. محلول نیتریک اسید از نمکهای تحت بررسی، روی یک تکه فویل مس اعمال میشود و هر جا یون جیوه وجود داشته باشد لکههایی از آمالگام نقرهای رنگ به جا میگذارد. یونهای نقره نقاط مشابهی را به جا میگذارند، اما به راحتی شسته میشوند، و این روشی برای جدا کردن نقره از جیوه است.
واکنش اکسایش در جایی که جیوه مس را اکسید میکند:
+Hg2+ + Cu → Hg + Cu2
مسمومیت
آمالگام دندان مورد مطالعه قرار گرفتهاست و بهطور کلی برای انسان بی خطر تلقی میشود،[11][12] اگرچه اعتبار برخی از مطالعات و نتیجهگیری آنها زیر سؤال رفتهاست.[13] در ژوئیه ۲۰۱۸ اتحادیه اروپا آمالگام را برای درمان دندانپزشکی کودکان زیر ۱۵ سال و زنان باردار یا شیرده ممنوع کرد.[14]
جستارهای وابسته
منابع
- افضلی، محمدرضا (۱۳۸۶)، فرهنگ تشریحی متالورژی و مواد، تهران: دانشیار، شابک ۹۷۸-۹۶۴-۷۰۱۵-۴۸-۶
- Callister, W. D. "Materials Science and Engineering: An Introduction" 2007, 7th edition, John Wiley and Sons, Inc. New York, Section 4.3 and Chapter 9.
- «mine-engineer.com/mining/minproc/MercAmal.htm».
- . Ham, Peter "Zinc amalgam" in e-EROS Encyclopedia of Reagents for Organic Synthesis (2001). doi:10.1002/047084289X.rz003.
- E J Duwell; N C Baenziger (1955). «"The Crystal Structures of KHg and KHg2"».
- . Emmanuil I. Troyansky and Meghan Baker "Aluminum Amalgam" in e-EROS Encyclopedia of Reagents for Organic Synthesis 2016. doi:10.1002/047084289X.ra076.pub2.
- Archived from the original on 17 April 2009. Retrieved 2009-04-24. «"Die Sendung mit der Maus, Sachgeschichte vom Spiegel"».
- «"Mercury Amalgamation"».
- «webmineral.com/data/Leadamalgam.shtml».
- «"Mercury Regulation EU"». www.europa.eu.
- «"The "Mercury Toxicity" Scam:: How Anti-Amalgamists Swindle People"».
- «"Statement on Dental Amalgam"».
- «"Is dental amalgam safe for humans? The opinion of the scientific committee of the European Commission"».
- «"Mercury Regulation EU"».
| در ویکیانبار پروندههایی دربارهٔ ملغمه موجود است. |
