پیوند فلزی
پیوند فلزی نوعی از پیوند های شیمیایی بین اتمی است که میان فلزات دیده میشود. چون فلزات نمیتوانند پیوند کووالانسی برقرار کنند، در یک گروه هشتتایی قرار میگیرند و الکترون در آنها به راحتی حرکت میکند. فلزهایی مانند لیتیم، سدیم و آهن اینگونه اند.
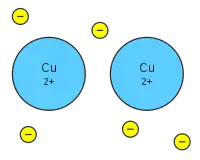
در فلزات ما مراکز اتم ها را به صورت هسته هایی با بار مثبت در نظر می گیریم که در کنار یکدیگر واقع شده اند. این هسته های مثبت، الکترون های لایه ظرفیت خود را به صورت آزادانه در بین کلیه اتم ها رها می کنند و به این ترتیب یک توده ای از الکترون های آزاد مابین اتم ها جریان می یابد که به آن ابر الکترونی (دریای الکترونی) گفته می شود.
لذا اتم های یک فلز در الکترون های ظرفیت همدیگر شریک می باشند، این الکترون ها با یون به خصوصی پیوند برقرار نمی کنند، بلکه در سطوح معین انرژی بین یون های مثبت فلز آزادانه حرکت می کنند. یون های مثبت فلزی بعلت وجود نیروی جاذبه بین خود و ابر الکترونی در کنار همدیگر قرار می گیرند. می توان گفت که پیوند فلزی همان پیوند کووالانسی است که بین تعداد اتم های بیشماری برقرار می شود.
جستارهای وابسته
توجیه خواص فلزات با پیوند فلزی
- رسانایی الکتریکی: جریان الکتریکی در واقع جریان الکترون هاست، زمانی که دو سر سیم برق DC(برق باتری) را به یک تکه فلز متصل میکنیم تعداد زیادی الکترون به سمت قطب مثبت جاری میشوند و به وسیلهٔ سیم از فلز خارج میشوند، این اتفاق باعث کمبود الکترون در فلز میشود و الکترونهای غیر مستقر قسمتهای دیگر فلز را به سمت خود میکشد و الکترونهای از دست رفته به وسیلهٔ جریانی از الکترونها جبران میشود، با تکرار این روند جریان الکتریکی ایجاد میشود.
- رسانایی گرمایی: دما جنبش الکترونهای غیر مستقر را افزایش داده و به دلیل پیوستگی این الکترونها، دما به تمام قسمتهای فلز منتقل میشود.
- درخشندگی و جلای فلزات: تابش نور به الکترونهای غیر مستقر به آسانی باعث برانگیخته شدن آنها میشود و بازگشت آنها به حالت پایه باعث تابش نور مرئی میشود، بعضی فلزات به این خاطر رنگی متمایز دارند که الکترونهایشان حالتهای ایستادهٔ متفاوتی نسبت به بقیهٔ فلزات دارند.
- پدیدهٔ فوتوالکتریک: انرژی دادن به الکترونهای غیر مستقر (به صورت گرمایی یا تابشی) ممکن است به حدی آنها را برانگیخته کند که آنها را از فلز جدا کرده، و در صورت نیاز میتوان این الکترونها را در مداری به جریان درآورده و جریان الکتریکی تولید کنیم.
- چکش خواری: وقتی ضربه ای به فلز وارد میشود یونهای مثبت فلزی در دریای الکترون منفی جابجا میشوند اما این دریای الکترون با حفظ پیوستگی یونهای مثبت فلزی جلوی شکستگی فلز را میگیرند.
منابع
- عربشاهی، باهره، مبانی شیمی، ص. صص ۵۴ و ۵۵
