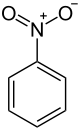
نیتروبنزن
نیتروبنزن (به انگلیسی: Nitrobenzene) با فرمول شیمیایی C۶H۵NO۲ یک ترکیب شیمیایی با شناسه پابکم ۷۴۱۶ است. که جرم مولی آن ۱۲۳٫۰۶ g/mol است. شکل ظاهری این ترکیب، مایع مایل به زرد است و بویی شبیه بوی بادام دارد. پس از انجماد به شکل بلورهایی برنگ زرد-سبز در میآید. نیتروبنزن در مقیاس کلان به عنوان پیشماده ای برای تهیه آنیلین، از بنزن به دست می آید.در آزمایشگاه؛ از آن به عنوان حلال، به ویژه برای واکنشگرهای الکتروفیل، استفاده میشود.
| Nitrobenzene | |||
|---|---|---|---|
| |||
 | |||
دیگر نامها Nitrobenzol | |||
| شناساگرها | |||
| شماره ثبت سیایاس | 98-95-3 | ||
| پابکم | 7416 | ||
| کماسپایدر | 7138 | ||
| UNII | E57JCN6SSY | ||
| KEGG | C06813 | ||
| ChEBI | CHEBI:27798 | ||
| ChEMBL | CHEMBL15750 | ||
| شمارهٔ آرتیئیسیاس | DA6475000 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
SMILES
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | C6H5NO2 | ||
| جرم مولی | 123.06 g/mol | ||
| شکل ظاهری | yellowish liquid | ||
| چگالی | 1.199 g/cm3 | ||
| دمای ذوب | 5.7 °C | ||
| دمای جوش | 210.9 °C | ||
| انحلالپذیری در آب | 0.19 g/100 ml at 20 °C | ||
| خطرات | |||
| طبقهبندی ئییو | Toxic (T) کارسینوژن Repr. Cat. 3 Dangerous for the environment (N) Flammable(F) | ||
| کدهای ایمنی | R۱۰, R23/24/25, R40, R48/23/24, R51/53, R62 | ||
| شمارههای نگهداری | (S1/2), S۲۸, S36/37, S45, S61 | ||
| لوزی آتش | |||
| نقطه اشتعال | |||
| دمای خودآتشگیری | |||
| ترکیبات مرتبط | |||
| ترکیبات مرتبط | آنیلین Benzenediazonium chloride نیتروس بنزن | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
تهیه
نیتروبنزن را به عنوان پیشماده ای برای ساخت آنیلین، از نیتراسیون بنزن با مخلوطی از سولفوریک اسید غلیظ، آب و نیتریک اسید، که گاهی اوقات "اسید مختلط" نامیده میشود، تهیه میکنند. تهیه نیتروبنزن یکی از خطرناکترین فرایندها در صنایع شیمیایی است چرا که واکنش آن بسیار گرمازا است (ΔH = −117 kJ/mol).
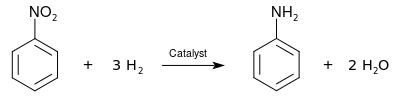
مکانیسم نیتراسیون
مسیرواکنش شامل تولید یک افزوده بین بنزن و یون نیترونیوم (NO2+) که یک اسید لویس است، است . یون نیترونیوم به صورت درجا از واکنش نیتریک اسید و یک واکنشگر اسیدی آب گیر مانند سولفوریک اسید تهیه میشود:
- HNO3 + H+
 NO2+ + H2O
NO2+ + H2O
موارد استفاده
تقریباً %95 نیتروبنزن برای تهیه آنیلین، که پیشماده ای در ساخت مواد شیمیایی لاستیکی، آفتکشها، رنگها، مواد منفجره و مواد دارویی است، مصرف میشود.
موارد مصرف ویژه
نیتروبنزن به عنوان ماده ای برای کاهش بوهای نامطبوع در پولیش کفپوش و کفش، مصنوعات چرمی، حلال رنگها و مواد دیگر استفاده میشود. نیتروبنزن تقطیرمجدد شده را به عنوان ماده معطر ارزان قیمتی در ساخت صابون استفاده میکنند. یک بازار تجاری ویژه نیتروبنزن در ساخت استامینوفن است. همچنین نیتروبنزن به علت بالا بودن غیرعادی ثابت کِر آن، در سلول کر (به انگلیسی: Kerr cell) استفاده میشود.
واکنشهای آلی
نیتروبنزن، علاوه بر تبدیل به آنیلین، به مشتقات مشابه دیگری مانند آزوبنزن، نیتروزوبنزن و فنیل هیدروکسیل آمین تبدیل میشود. گروه نیترو- کاهش دهنده فعالیت است لذا جانشینی تمایل دارد در موقعیت متا انجام شود.
ایمنی
نیتروبزن به شدت سمّی است (حدآستانه 5 mg/m3 ) و به آسانی توسط پوست جذب میشود. تماس مداوم با آن میتواند منجر به صدمه دیدن سیستم عصبی مرکزی، تطابق بینایی، آسیب کبدی و کلیوی، کم خونی و التهاب ریه شود. تنفس بخار آن باعث سردرد، تهوع، احساس خستگی، سرگیجه، ایجاد اشک و سستی دست و پا شده در پاره ای موارد میتواند مهلک باشد. جذب پوشتی آن اسان است و میتواند باعث افزایش ضربان قلب، تشنج و به ندرت مرگ شود. خوردن آن نیز میتواند بهطور مشابه به وجود آورنده سردرد، سرگیجه، تهوع، ناراحتی معده و خونریزی داخلی شود.