دوره (جدول تناوبی)
در جدول تناوبی عناصر شیمیایی، عنصرها در ردیفهایی به نام دوره یا تناوب یا پریود مرتب میشوند تا عناصر با خواص شیمیایی مشابه در ستونهای عمودی زیر یکدیگر قرار بگیرند. عنصرهای موجود در هر دسته تعداد لایههای الکترونی یکسانی دارند. در عنصرهای یک دوره، هر عنصر از عنصر قبلیاش (از نظر شمارهٔ گروه) یک پروتون و یک الکترون بیشتر دارد و خاصیت فلزی کمتر و الکترونگاتیوی و بار مؤثر هستهٔ بیشتری دارد.
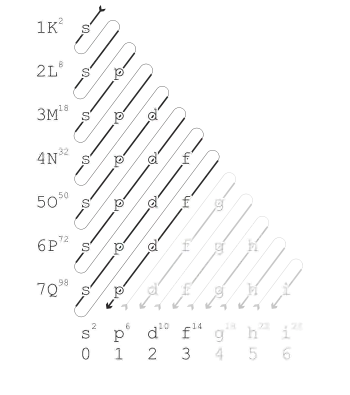
با افزایش عدد اتمی، لایههای اتم تقریباً به ترتیبی که در تصویر سمت راست نشان داده شدهاست از الکترون پر میشوند. پرشدن هر لایه به معنی رفتن به دورهٔ بعدی در جدول تناوبی است.
در بلوک اس و بلوک پی عناصر هر دوره خواص نسبتاً مشابهی ندارند و شباهت در خواص، بیشتر در عناصر یک گروه دیده میشود. اما در بلوک دی در خواص عناصر هر دوره نیز شباهت وجود دارد و در بلوک اف نیز، بهخصوص در عناصر دستهٔ لانتانیدها شباهیت بسیاری در خواص عناصر هر دوره دیده میشود.
با دستهبندی عناصری که بهطور طبیعی در زمین وجود دارند در جدول تناوبی ۷ دوره تشکیل میشود.
دورهٔ یکم
| گروه | ۱/۱۷ | ۲/۱۸ |
|---|---|---|
| # نام |
۱ H |
۲ He |
دورهٔ نخست با ۲ عنصر هیدروژن و هلیوم کمترین تعداد عناصر را دارد. این دو عنصر از قاعده هشتتایی (اکتت) پیروی نمیکنند. هلیوم مانند یک گاز نجیب رفتار میکند و بنابراین جزو گروه هجدهم (گازهای نجیب) بهشمار میرود و از طرفی هم به علت ساختار هستهایاش به بلوک اس تعلق دارد و بنابراین گاه به عنوان عنصر عضو گروه دوم (قلیایی خاکی) بهشمار میرود، و گاه هر دو. هیدروژن بهآسانی یک الکترون میدهد و میگیرد و بنابراین میتوان آن را جزو هر دو گروه نخست و هفدهم (هالوژنها) بهشمار آورد.
- هیدروژن (H) فراوانترین عنصر از میان عناصر است و حدود ۷۵٪ جرم جهان را تشکیل میدهد.[1] هیدروژن یونیدهشده (بار منفی) در واقع یک پروتون است. ستارگان رشتهٔ اصلی در حالت پلاسما عمدتاً از هیدروژن تشکیل شدهاند. هیدروژن در حالت عنصر در زمین بسیار کمیاب است و به صورت صنعتی از متان و دیگر هیدروکربنها ساخته میشود. هیدروژن با بیشتر عناصر ترکیب میشود و در آب و بیشتر ترکیبهای زیستی وجود دارد.[2]
- هلیوم (He) معمولاً در حالت گاز است مگر شرایط خیلی خاص.[3] دومین عنصر سبک و دومین عنصر فراوان در گیتی است.[4] بیشتر هلیوم جهان در طی انفجار بزرگ پدید آمد، لیک همواره از راه همجوشی هستهای در ستارگان نیز در حال پدیدآمدن است.[5] هلیوم در زمین بسیار کمیاب است و فقط بهطور طبیعی بر اثر واپاشی برخی عناصر رادیواکتیو زمین ساخته میشود.[6]
دورهٔ دوم
| گروه | ۱ | ۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ |
|---|---|---|---|---|---|---|---|---|
| # نام |
۳ Li |
۴ Be |
۵ B |
۶ C |
۷ N |
۸ O |
۹ F |
۱۰ Ne |
در عنصرهای دورهٔ دوم اربیتالهای درون زیرلایههای ۲s و ۲p در حال پرشدن هستند. این دوره شامل عنصرهای مهم زیستی کربن، نیتروژن و اکسیژن است.
- لیتیم (Li) سبکترین و کمچگالیترین عنصر فلز و جامد است.[7] به علت واکنشپذیری زیاد این عنصر فقط به صورت ترکیب در طبیعت یافت میشود.
- بریلیم (Be) از میان فلزهای سبک یکی از بیشترین نقطههای ذوب را دارد. بخش کمی از بریلیم جهان در طی انفجار بزرگ ترکیب شد، و سپستر در ستارگان بیشتر آن واپاشید یا وارد واکنش شد و کربن، نیتروژن و اکسیژن را ایجاد کرد. سازمان IARC آن را در گروه نخست سرطان زاها ردهبندی کردهاست.[8] بین 1 تا 15 درصد از افراد به بریلیم حساس هستند و ممکن است در دستگاه تنفسی و پوست آنها یک واکنش التهابی ایجاد کنند که بیماری مزمن بریلیوم نامیده می شود.
- بور (B) به طور طبیعی به عنوان یک عنصر آزاد رخ نمی دهد ، بلکه در ترکیباتی مانند بورات وجود دارد. این یک ریز مغذی گیاهی ضروری است که برای استحکام و رشد دیواره سلولی ، تقسیم سلولی ، رشد دانه و میوه ، انتقال قند و رشد هورمون لازم است ، اگرچه مقدار بالای آن سمی است.
- کربن (C) چهارمین عنصر فراوان گیتی بر پایهٔ جرم پس از هیدروژن، هلیوم و اکسیژن[9] و دومین عنصر فراوان در بدن انسان پس از اکسیژن،[10] و سومین عنصر فراوان بر پایهٔ تعداد اتمها در جهان است.[11] به خاطر توانایی کربن در تشکیل زنجیرههای طویل پایدار C-C تقریباً به تعداد بینهایت نوع ترکیب از کربن قابل ایجاد است.[12][13] تمام ترکیب آلی ها حداقل دارای یک اتم کربن هستند. کربن با ترکیب هیدروژن ، اکسیژن ، نیتروژن ، گوگرد و فسفر اساس هر ترکیب مهم بیولوژیکی است. راه شناسایی کربن دمیدن آن در آب آهک است.
- نیتروژن (N) عمدتا به عنوان گاز بی اثر مولکول دو اتمی ، (N2)یافت می شود ، که 78٪ جو زمین و هوا را تشکیل می دهد.نیتروژن مهم ترین عنصر زیستی است وعدد اتمی آن7 است.
- اکسیژن (O) شامل 21٪ از جو است و برای تنفس توسط همه حیوانات و پسدانداران و گیاهان و همچنین تنفس سلولی ضروری است همچنین به عنوان اصلی ترین جزء آب مورد نیاز است. اکسیژن سومین عنصر فراوان در زمین است و ترکیبات اکسیژن بر پوسته زمین غالب هستند.
- فلوئور (F) واکنش پذیرترین عنصر در حالت غیر یونیزه است و بنابراین هرگز به صورت خالص در طبیعت یافت نمی شود.
- نئون (Ne) گازی نجیب است که در لامپهای نئون به کار میرود.
دورهٔ سوم
| گروه | ۱ | ۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ |
|---|---|---|---|---|---|---|---|---|
| # نام |
۱۱ Na |
۱۲ Mg |
۱۳ Al |
۱۴ Si |
۱۵ P |
۱۶ S |
۱۷ Cl |
۱۸ Ar |
- سه عنصر دوره در طبیعت رخ می دهد و حداقل یک ایزوتوپ پایدار دارد. همه به جز گاز نجیب آرگون ، برای زمین شناسی و زیست شناسی اساسی ضروری هستند. سدیم (Na) یکی از فلزهای قلیایی است. در اقیانوس های کره زمین به مقدار زیاد به شکل سدیم کلرید (NACL = نمک خوراکی) وجود دارد. منیزیم (Mg) یک فلزهای قلیایی خاکی است. یون های منیزیم در سبقت یافت می شود.
آلومینیم(Al) این فلز فراوان ترین پوسته زمین است. از آلومینیوم در صنایع هواپیمایی استفاده می شود. سیلیسیم (Si) سیلیسیم یا سیلیکن یک شبهفلزات است. این یک نیمه رسانا است و رسانش گرمایی خوبی دارد. سیلیسیم دیاکسید سازنده اصلی ماسه است و هشتمین عنصر فراوان روی زمین است. سیلیسیم برای ساخت تراشه(ورقه ورقه شدن) مناسب است. فسفر (P) یک نافلز ضروری برای DNA(دئو کسی ریبو نوکلوئیک اسید) است. بسیار واکنش پذیر است و به همین دلیل هرگز در طبیعت به عنوان یک عنصر آزاد و خالص یافت نمی شود. گوگرد (S) یک نافلز است. این ماده در دو اسید آمینه وجود دارد: سیستئین و متیونین. این ماده در پروتوئین ها نیز موجود است. از گوگرد در ساخت باروت، کبریت ،کود ها و حشره کش ها و ... استفاده می شود. کلر (Cl) یک هالوژن است. به ویژه در آب و استخرهای شنا به عنوان ضد عفونی کننده استفاده می شود. آرگون (Ar) یک گاز نجیب است و تقریباً کاملاً غیرفعال است. لامپهای رشته ای اغلب به منظور حفظ رشته ها در دمای بالا با گازهای نجیب مانند آرگون پر می شوند.
دورهٔ چهارم
| گروه | ۱ | ۲ | ۳ | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| عدد اتمی نام |
۱۹ K |
۲۰ Ca |
۲۱ Sc |
۲۲ Ti |
۲۳ V |
۲۴ Cr |
۲۵ Mn |
۲۶ Fe |
۲۷ Co |
۲۸ Ni |
۲۹ Cu |
۳۰ Zn |
۳۱ Ga |
۳۲ Ge |
۳۳ As |
۳۴ Se |
۳۵ Br |
۳۶ Kr |
دوره چهارم شامل عناصر ضروری از نظر بیولوژیکی مانند پتاسیم و کلسیم است .
پتاسیم(K)از فلزات قلیایی است. با آب واکنش می دهد.به همین دلیل در نفت نگه داری می شود.از فلزات نرم است.
پتاسیم در عملکرد اعصاب بسیار مهم است.
کلسیم(ca)از عناصر مهم برای بدن انسان است.
آهن (Fe) اولین فلز واسطه است. فراوان ترین عنصر سازنده ی زمین آهن است.آهن در صنایع کاربرد بسیاری دارد.
تقریبا تمام عناصر دوره چهارم، برای جانوران ضروری اند.
دورهٔ پنجم
| گروه | ۱ | ۲ | ۳ | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| عدد اتمی نام |
۳۷ Rb |
۳۸ Sr |
۳۹ Y |
۴۰ Zr |
۴۱ Nb |
۴۲ Mo |
۴۳ Tc |
۴۴ Ru |
۴۵ Rh |
۴۶ Pd |
۴۷ Ag |
۴۸ Cd |
۴۹ In |
۵۰ Sn |
۵۱ Sb |
۵۲ Te |
۵۳ I |
۵۴ Xe |
دوره 5 شامل سنگین ترین عناصر است که دارای نقش های بیولوژیکی هستند:مولیبدن و ید. (تنگستن، تنها عنصر سنگین تر است که نقش بیولوژیکی دارد.) این دوره شامل تکنسیوم ، سبک ترین عنصر رادیواکتیو است.
دورهٔ ششم
| گروه | ۱ | ۲ | ۳ (Lanthanides) | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| # نام |
۵۵ Cs |
۵۶ Ba |
۵۷ La |
۵۸ Ce |
۵۹ Pr |
۶۰ Nd |
۶۱ Pm |
۶۲ Sm |
۶۳ Eu |
۶۴ Gd |
۶۵ Tb |
۶۶ Dy |
۶۷ Ho |
۶۸ Er |
۶۹ Tm |
۷۰ Yb |
۷۱ Lu |
۷۲ Hf |
۷۳ Ta |
۷۴ W |
۷۵ Re |
۷۶ Os |
۷۷ Ir |
۷۸ Pt |
۷۹ Au |
۸۰ Hg |
۸۱ Tl |
۸۲ Pb |
۸۳ Bi |
۸۴ Po |
۸۵ At |
۸۶ Rn |
دوره 6 اولین دوره ای است که شامل فلزات واسطه داخلی ، با لانتانیدها (همچنین به عنوان عناصر کمیاب زمین شناخته می شود) ، و شامل سنگین ترین عناصر پایدار است. بسیاری از این فلزات سنگین سمی و برخی رادیواکتیو هستند ، اما پلاتین و طلا تا حد زیادی بی اثر هستند.
دورهٔ هفتم
| گروه | ۱ | ۲ | ۳ (اکتینیدها) | ۴ | ۵ | ۶ | ۷ | ۸ | ۹ | ۱۰ | ۱۱ | ۱۲ | ۱۳ | ۱۴ | ۱۵ | ۱۶ | ۱۷ | ۱۸ | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| # نام |
۸۷ Fr |
۸۸ Ra |
۸۹ Ac |
۹۰ Th |
۹۱ Pa |
۹۲ U |
۹۳ Np |
۹۴ Pu |
۹۵ Am |
۹۶ Cm |
۹۷ Bk |
۹۸ Cf |
۹۹ Es |
۱۰۰ Fm |
۱۰۱ Md |
۱۰۲ No |
۱۰۳ Lr |
۱۰۴ Rf |
۱۰۵ Db |
۱۰۶ Sg |
۱۰۷ Bh |
۱۰۸ Hs |
۱۰۹ Mt |
۱۱۰ Ds |
۱۱۱ Rg |
۱۱۲ Cn |
۱۱۳ Nh |
۱۱۴ Fl |
۱۱۵ Mc |
۱۱۶ Lv |
۱۱۷ Ts |
۱۱۸ Og |
همه عناصر دوره 7 دارای واپاشی هسته ای هستند. این دوره شامل سنگین ترین عنصری است که پرتوزایی طبییعی دارد: اورانیم. تمام عناصر بعدی در این دوره به طور مصنوعی ساخته شده اند. در حالی که برخی از اینها (به عنوان مثال پلوتونیم) اکنون به مقدار تن در دسترس هستند ، بیشتر آنها بسیار نادر هستند ، فقط در مقادیر میکروگرم یا کمتر تهیه شده اند. برخی از عناصر بعدی فقط در آزمایشگاه ها با مقادیر چند اتم در یک زمان شناسایی شده اند.
اگرچه نادر بودن بسیاری از این عناصر به این معنی است که نتایج تجربی بسیار گسترده نیستند ، اما به نظر می رسد روند دوره ای و گروهی رفتار برای دوره 7 نسبت به دوره های دیگر کمتر تعریف شده باشد. در حالی که فرانسیم و رادیم به ترتیب خواص معمول گروههای 1 و 2 را نشان می دهند ، آکتینیدها تنوع رفتار و اکسیداسیون بسیار بیشتری نسبت به لانتانیدها نشان می دهد. مطالعات اولیه نشان می دهد که عنصر گروه 14 فلروویوم به جای فلز ضعیف ، یک گاز نجیب است و عنصر گروه 18 اوگانسون احتمالاً یک گاز نجیب نیست. این ویژگی های دوره 7 ممکن است به عوامل مختلفی از جمله میزان زیادی از اتصال مدار چرخشی و اثرات نسبی گرایی مربوط شود که در نهایت ناشی از بار الکتریکی مثبت بسیار بالای هسته عظیم آنها است.
دورهٔ هشتم
هنوز هیچ عنصری از دوره هشتم ساخته نشده است. یک بلوک g پیش بینی شده است. مشخص نیست که آیا تمام عناصر پیش بینی شده برای دوره هشتم در واقع از نظر جسمی امکان پذیر هستند. بنابراین ممکن است دوره نهم وجود نداشته باشد.
منابع
- Palmer, David (November 13, 1997). "Hydrogen in the Universe". NASA. Retrieved 2008-02-05.
- "hydrogen". Encyclopædia Britannica. 2008.
- "Helium: physical properties". WebElements. Retrieved 2008-07-15.
- "Helium: geological information". WebElements. Retrieved 2008-07-15.
- Cox, Tony (1990-02-03). "Origin of the chemical elements". New Scientist. Retrieved 2008-07-15.
- "Helium supply deflated: production shortages mean some industries and partygoers must squeak by". Houston Chronicle. 2006-11-05.
- Lithium at WebElements.
- "IARC Monograph, Volume 58". International Agency for Research on Cancer. 1993. Retrieved 2008-09-18.
- «Ten most abundant elements in the universe, taken from The Top 10 of Everything, 2006, Russell Ash, page 10. Retrieved October 15, 2008». بایگانیشده از اصلی در ۱۰ فوریه ۲۰۱۰. دریافتشده در ۲ سپتامبر ۲۰۱۱.
- Chang, Raymond (2007). Chemistry, Ninth Edition. McGraw-Hill. p. 52. ISBN 0-07-110595-6.
- Freitas Jr., Robert A. (1999). Nanomedicine,. Landes Bioscience. Tables ۳–۱ & ۳–۲. ISBN 1-57059-680-8. External link in
|title=(help) - "Structure and Nomenclature of Hydrocarbons". Purdue University. Retrieved 2008-03-23.
- Alberts, Bruce. Molecular Biology of the Cell. Garland Science. Unknown parameter
|coauthors=ignored (|author=suggested) (help)
https://ptable.com/#Properties
- توجه: ارجاعات دستدوماند. منبع اصلی:
- Wikipedia contributors, "Period (periodic table)," Wikipedia, The Free Encyclopedia, http://en.wikipedia.org/w/index.php?title=Period_(periodic_table)&oldid=446731854 (accessed September 2, 2011).
| فلزات | شبهفلزها | نافلزها | نامعلوم | |||||||
| فلزات قلیایی | فلزات قلیایی خاکی | فلزات واسطه درونی | فلزات واسطه | دیگر فلزات | دیگر نافلزات | هالوژنها | گازهای نجیب | |||
| لانتانیدها | اکتینیدها | |||||||||

