کبالت
کُبالت (به انگلیسی: Cobalt) یک عنصر شیمیایی با نماد Co و عدد اتمی ۲۷ است. مانند نیکل، کبالت در پوسته زمین فقط به صورت ترکیبات شیمیایی یافت میشود، به جز رسوبات اندکی که در آلیاژهای آهن متوریک طبیعی وجود دارد. کبالت خالص که توسط گدازگری احیائی تولید میشود، فلزی سخت، براق، و خاکستری-نقره ای است.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کبالت | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | hard lustrous gray metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | ۵۸٫۹۳۳۱۹۴(۳)[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کبالت در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 27 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | گروه ۱۲ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Transition metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Ar] 3d7 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2, 8, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| metallic gray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 1768 K (1495 °C, 2723 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 3200 K (2927 °C, 5301 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | 8.90 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (at m.p.) | 7.75 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | 16.06 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 377 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | 24.81 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −3, −1, 0, +1, +2, +3, +4, +5[3] (an amphoteric اکسید) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 1.88 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع اتمی | empirical: 125 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 126±3 (low spin), 150±7 (high spin) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Color lines in a spectral range | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | دستگاه بلوری ششگوشه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت thin rod | 4720 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | 13.0 µm/(m·K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 100 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | 62.4 n Ω·m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | ferromagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول یانگ | 209 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول برشی | 75 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول حجمی | 180 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبت پواسون | 0.31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی موس | 5.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی ویکرز | 1043 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی برینل | 700 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7440-48-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای کبالت | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

از رنگدانههای آبی پایه کبالت (آبی کبالت) از زمانهای بسیار قدیم برای جواهرات و رنگها، و دادن رنگ متمایز آبی به شیشه استفاده میشدهاست، اما بعداً تصور میشد که این رنگ به دلیل بیسموت فلزی شناخته شده باشد. معدنچیان مدتها بود که از نام سنگ معدن کوبولد برای برخی از مواد معدنی تولیدکننده رنگدانههای آبی استفاده میکردند. این نامگذاری به این دلیل بود که دارای فلزات شناخته شده کمی بودند و هنگام ذوب شدن آنها بخارات سمی آرسنیک تولید میشد. در سال ۱۷۳۵ مشخص شد که چنین سنگ معدنی قابل تبدیل به فلز جدید (کشف برای اولین بار از زمان باستان) است و در نهایت این سنگ معدن کوبولد نامگذاری شد.
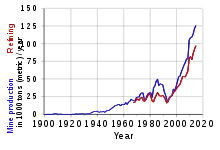
امروزه، بخشی از کبالت تولید شده در جهان بهطور خاص از کبالتیت (CoAsS) تولید میشود. این عنصر معمولاً بیشتر به عنوان محصول جانبی استخراج مس و نیکل تولید میشود. کمربند مس در جمهوری دموکراتیک کنگو (DRC) و زامبیا بیشترین تولید جهانی کبالت را به همراه دارد. تولید جهانی در سال ۲۰۱۶ برابر ۱۱۶۰۰۰ تن متریک (طبق منابع طبیعی کانادا) بود و DRC فقط بیش از ۵۰٪ را به خود اختصاص داد.[4]
کبالت در درجه اول در باتریهای یون لیتیوم و در ساخت آلیاژهای مغناطیسی، مقاوم در برابر سایش و مقاومت بالا استفاده میشود. ترکیبات سیلیکات کبالت و آلومینات کبالت(II) (CoAl2O4، آبی کبالت) به شیشهها، سرامیکها، جوهرها، رنگها و لعابها یک رنگ آبی متمایز میدهند. کبالت بهطور طبیعی تنها به عنوان یک ایزوتوپ پایدار، کبالت-۵۹ ظاهر میشود. کبالت-۶۰ یک رادیوایزوتوپ تجاری مهم است که به عنوان یک ردیاب رادیواکتیو و برای تولید پرتوهای گاما انرژی بالا استفاده میشود.
کبالت مرکز فعال گروهی از کوآنزیمها به نام کوبالامین است. ویتامین B12، معروفترین نمونه از این نوع، یک ویتامین ضروری برای همه حیوانات است. کبالت به شکل غیرآلی نیز ریز مغذی باکتریها، جلبکها و قارچها است.
سازمان زمینشناسی ایالات متحده ذخایر جهانی کبالت را ۷۱۰۰۰۰۰ متریک تن تخمین زدهاست.[5] در حال حاضر جمهوری دموکراتیک کنگو (DRC) 63% از کبالت جهان را تولید میکند. اگر توسعه برنامهریزی شده توسط تولیدکنندگان معدن مانند Glencore Plc طبق انتظار انجام شود، این سهم بازار ممکن است تا سال ۲۰۲۵ به ۷۳٪ برسد. انرژی جدید مالی بلومبرگ تخمین زدهاست که تقاضای جهانی تا سال ۲۰۳۰ میتواند ۴۷ برابر بیشتر از سال ۲۰۱۷ باشد.[6]
مشخصات

کبالت یک فلز فرومغناطیسی با وزن مخصوص ۸٫۹ است. دارای دمای کوری ۱۱۱۵ درجه سلسیوس[7] و گشتاور مغناطیسی آهنربا ۱٫۶–۱٫۷ مگنتون بور در هر اتم است.[8] نفوذپذیری نسبی کبالت دو سوم آهن است.[9] کبالت فلزی به صورت دو ساختار کریستالوگرافی رخ میدهد: hcp و fcc. دمای انتقال ایدهآل بین ساختارهای hcp و fcc برابر ۴۵۰ درجه سلسیوس است، اما در عمل اختلاف انرژی بین آنها به قدری کم است که رشد متوسط تصادفی این دو معمول است.[10][11][12]
کبالت یک فلز کاهنده ضعیف است و توسط یک لایه غیرفعال در برابر اکسایش محافظت میشود. این عنصر توسط هالوژنها و گوگرد مورد حمله قرار میگیرد. گرمایش آن در اکسیژن باعث تولید Co3O4 میشود که اکسیژن را در دمای ۹۰۰ درجه سلسیوس از دست میدهد تا به کبالت(II) اکسید، CoO برسد.[13] این فلز با فلورین (F2) در ۵۲۰ کلوین واکنش میدهد تا CoF3 تولید شود؛ و با کلرین (Cl2)، برمین (Br2) و ید (I2)، تولید هالیدهای دوتایی معادل میدهد. حتی در صورت گرم کردن با گاز هیدروژن (H2) یا گاز نیتروژن (N2) واکنش نشان نمیدهد اما با بور، کربن، فسفر، آرسنیک و گوگرد واکنش نشان میدهد.[14] در دماهای معمولی، به آرامی با اسیدهای معدنی و بسیار آرام با هوای مرطوب، اما نه با هوای خشک، واکنش نشان میدهد.
تولید
سنگ معدنهای اصلی کبالت شامل کبالتیت، اریتریت، گلوکودوت و اسکوترودیت است، اما بیشتر کبالت با کاهش محصولات جانبی کبالت در استخراج و گدازگری نیکل و مس بدست میآید.[15][16]
از آنجا که کبالت معمولاً به عنوان محصول جانبی تولید میشود، تأمین کبالت تا حدود زیادی به امکان اقتصادی استخراج مس و نیکل در یک بازار معین بستگی دارد. پیشبینی شده بود که تقاضا برای کبالت در سال ۲۰۱۷ به میزان ۶٪ رشد کند.[17]
| کشور | تولید | ذخایر |
|---|---|---|
| ۶۴٬۰۰۰ | ۳٬۵۰۰٬۰۰۰ | |
| ۵٬۶۰۰ | ۲۵۰٬۰۰۰ | |
| ۵٬۰۰۰ | ۱٬۲۰۰٬۰۰۰ | |
| ۴٬۳۰۰ | ۲۵۰٬۰۰۰ | |
| ۴٬۲۰۰ | ۵۰۰٬۰۰۰ | |
| ۴٬۰۰۰ | ۲۸۰٬۰۰۰ | |
| ۳٬۸۰۰ | ۱۵۰٬۰۰۰ | |
| ۳٬۲۰۰ | ۵۱٬۰۰۰ | |
| ۲٬۹۰۰ | ۲۷۰٬۰۰۰ | |
| ۲٬۸۰۰ | - | |
| ۲٬۵۰۰ | ۲۹٬۰۰۰ | |
| ۱٬۵۰۰ | ||
| ۶۵۰ | ۲۳٬۰۰۰ | |
| سایر کشورها | ۵٬۹۰۰ | ۵۶۰٬۰۰۰ |
| کل جهان | ۱۱۰٬۰۰۰ | ۷٬۱۰۰٬۰۰۰ |
روشهای مختلفی برای جداسازی کبالت از مس و نیکل وجود دارد که به غلظت کبالت و ترکیب دقیق سنگ معدن بستگی دارد. یک روش، شناورسازی کف است که در آن سورفاکتانتها به اجزای سنگ متصل میشوند و منجر به غنی سازی سنگ معدن کبالت میشوند. تفت دادن بعدی، سنگ معدن را به سولفات کبالت تبدیل میکند و مس و آهن به اکسید، اکسایش مییابند. شسته شدن با آب، سولفات را به همراه آرسنات استخراج میکند. باقیماندهها بیشتر با اسید سولفوریک شسته میشوند و محلول سولفات مس تولید میشود. کبالت را میتوان از سرباره گدازگری مس نیز جدا کرد.[19]
فرایندهای فوقالذکر به اکسید کبالت (Co3O4) تبدیل میشوند. این اکسید در اثر واکنش آلومینوترمی یا کاهش در کربن در کوره بلند به فلز تبدیل میشود.[13]
تغییراتی که کنگو در قوانین معدن در سال ۲۰۰۲ ایجاد کرد، سرمایهگذاریهای جدیدی را در پروژههای مس و کبالت کنگو به همراه داشت. معدن موتانا گلنکور در سال ۲۰۱۶ مقدار ۲۴۵۰۰ تن کبالت، یعنی ۴۰٪ از تولید کنگو و تقریباً یک چهارم تولید جهانی را عرضه کرد. پس از عرضه بیش از حد، گلنکور اواخر سال ۲۰۱۹ موتاندا را به مدت دو سال تعطیل کرد.[20][21] پروژه معدن کاتانگا از گلنکور نیز از سر گرفته شدهاست و طبق گفته گلنکور تا سال ۲۰۱۹ باید ۳۰۰۰۰۰ تن مس و ۲۰۰۰۰ تن کبالت تولید کند.[17]
کاربردها
در سال ۲۰۱۶، مقدار ۱۱۶۰۰۰ تن کبالت استفاده شد.[4] از کبالت در تولید آلیاژهای با کارایی بالا استفاده شدهاست.[15][16] همچنین میتوان از آن برای ساخت باتریهای قابل شارژ استفاده کرد و ظهور وسایل نقلیه الکتریکی و موفقیت آنها در بازار احتمالاً ارتباط زیادی با تولید فزاینده جمهوری دموکراتیک کنگو دارد. سایر عوامل مهم که باعث تشویق تولید کبالت در کنگو شدهاست، قانون استخراج معدن در سال ۲۰۰۲ بود که سرمایهگذاری شرکتهای خارجی و فراملی مانند گلنکور را افزایش داد و پایان جنگهای اول و دوم کنگو بود.
آلیاژها
در گذشته سوپرآلیاژهای پایه کبالت بیشتر مصرف کبالت تولید شده را به خود اختصاص میدادند.[15][16] پایداری دمایی این آلیاژها آنها را برای ساخت پرههای توربین، توربینهای گازی و موتورهای جت هواپیما مناسب میکند، اگرچه آلیاژهای تک کریستال مبتنی بر نیکل از عملکرد آنها پیشی میگیرند.[22]
منابع
- Oxford English Dictionary, 2nd Edition 1989.
- Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. pp. 1117–1119. ISBN 0080379419.
- Danielle Bochove (November 1, 2017). "Electric car future spurs Cobalt rush: Swelling demand for product breathes new life into small Ontario town". Vancouver Sun. Bloomberg. Archived from the original on 2019-07-28.
- "Cobalt" (PDF). United States Geological Survey, Mineral Commodity Summaries. January 2016. pp. 52–53.
- Thomas Wilson (October 26, 2017). "We'll All Be Relying on Congo to Power Our Electric Cars".
- Enghag, Per (2004). "Cobalt". Encyclopedia of the elements: technical data, history, processing, applications. p. 667. ISBN 978-3-527-30666-4.
- Murthy, V. S. R (2003). "Magnetic Properties of Materials". Structure And Properties Of Engineering Materials. p. 381. ISBN 978-0-07-048287-6.
- Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (2008-05-01). Electromagnetic Shielding. p. 27. ISBN 978-0-470-05536-6.
- Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). "Surface structures of the two allotropic phases of cobalt". Physical Review B. 17 (4): 1510–1520. Bibcode:1978PhRvB..17.1510L. doi:10.1103/PhysRevB.17.1510.
- "Properties and Facts for Cobalt". American Elements. Archived from the original on 2 اكتبر 2008. Retrieved 2008-09-19. Check date values in:
|archive-date=(help) - Cobalt, Centre d'Information du Cobalt, Brussels (1966). Cobalt. p. 45.
- Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). "Cobalt". Lehrbuch der Anorganischen Chemie (به آلمانی) (102nd ed.). de Gruyter. pp. 1146–1152. ISBN 978-3-11-017770-1.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. p. 722. ISBN 978-0131755536.
- Shedd, Kim B. "Mineral Yearbook 2006: Cobalt" (PDF). United States Geological Survey. Retrieved 2008-10-26.
- Shedd, Kim B. "Commodity Report 2008: Cobalt" (PDF). United States Geological Survey. Retrieved 2008-10-26.
- Henry Sanderson (March 14, 2017). "Cobalt's meteoric rise at risk from Congo's Katanga". Financial Times.
- Cobalt Statistics and Information (PDF), U.S. Geological Survey, 2018
- Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. p. 347. ISBN 0-87170-685-7.
- "Glencore's cobalt stock overhang contains prices despite mine suspension". Reuters. 8 August 2019.
- Intelligence, Benchmark Mineral (28 November 2019). "Glencore closes Mutanda mine, 20% of global cobalt supply comes offline". Benchmark Mineral Intelligence.
the mine would be placed on care and maintenance for a period of no less than two years
- Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9.
| در ویکیانبار پروندههایی دربارهٔ کبالت موجود است. |
