آنتیموان
آنتیموان (به انگلیسی: Antimony) از عنصرهای شیمیایی جدول تناوبی است. نماد شیمیایی آن Sb و عدد اتمی آن ۵۱ است.[4]این عنصر در متنهای کهن فارسی به نام روی سخته یا روی سخته مصری نامیده شدهاست.[5] نام آنتیموان از واژه یونانی "anti-monos" گرفته شدهاست که معنای "غیر تنهاً میدهد چرا که در گذشته شخصی به اسم باسط مصری ان را کشف و به عشقش که او را دوست داشت هدیه داد البته تصور بر این بود که این عنصر به صورت خالص وجود ندارد.[6]
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتیموان | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | توسی نقرهای | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | ۱۲۱٫۷۶۰(۱)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتیموان در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 51 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | گروه ۱۵ (گروه نیتروژن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Metalloid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Kr] 4d10 5s2 5p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2, 8, 18, 18, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 903.78 K (630.63 °C, 1167.13 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 1860 K (1587 °C, 2889 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | 6.697 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (at m.p.) | 6.53 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | 19.79 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 193.43 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | 25.23 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −3, −2, −1, 0,[2] +1, +2, +3, +4, +5 (an amphoteric اکسید) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 2.05 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع اتمی | empirical: 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 139±5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | 206 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Color lines in a spectral range | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | دستگاه بلوری ششگوشه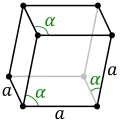 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت thin rod | 3420 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | 11 µm/(m·K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 24.4 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | 417 n Ω·m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | دیامغناطیس[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول یانگ | 55 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول برشی | 20 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول حجمی | 42 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی موس | 3.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی برینل | 294 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7440-36-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای آنتیموان | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
آنتیموان نیز همچون آلوتروپ، شبه فلزش دارای جلای فلزی سفید مایل به آبی و بسیار شکننده است. همچنین ساختار بلورین دارد و بلافاصله پوسته پوسته میشود. آنتیموان خالص و ترکیباتش بسیار سمی است؛ پس باید در کار با آنها احتیاط لازم را به کار بست. منبع اصلی آنتیموان کانی به نام استیبنیت است که سولفیدی از آن عنصر است. همچنین در کانیهای دیگر از جمله آلمینیت و گهگاهی به صورت خالص یافت میشود گر چه تا قرن هفدهم کسی نتوانسته بود آن را به شکل خالص از کانی جدا کند. آنتیموان در دمای اتاق با هوا واکنش نمیدهد اما روی شعله بلافاصله با نور درخشانی میسوزد و مقادیر فراوانی گازهای سفید تولید میکند. آنتیموان رسانایی ضعیف برای گرما و الکتریسیته است و به همین دلیل جز سازنه مناسبی در مواد نیمه رسانای میکروالکترونیکهاست.
مشخصات
خواص
آنتیموان عضوی از گروه 15 جدول تناوبی است ، یکی از عناصری که شبه فلز است و دارای الکترونگاتیوی 2.05 است. آنتیموان در دمای اتاق در هوا پایدار است ، اما در صورت گرم شدن با اکسیژن واکنش می دهد و تری اکسید آنتیموان ، تولید می کند.
آنتیموان یک فلز خاکستری نقره ای و براق با سختی موس 3 است که برای ساخت اجسام سخت خیلی نرم است. سکه های آنتیموان در استان گوئیژو چین در سال 1931 صادر شد اما دوام آن ضعیف بود و ضرب آن به زودی متوقف شد. [7] آنتیموان در برابر حمله اسیدها مقاوم است.
چهار آلوتروپ آنتیموان شناخته شده است: یک شکل فلزی پایدار و سه فرم قابل جبران (انفجاری ، سیاه و زرد). آنتیموان عنصری یک فلز براق شکننده و سفید نقره ای است. آنتیموان مذاب هنگامی که به آرامی خنک می شود ، در یک سلول مثلثی متشکل می شود ، هم شکل با آلبوم خاکستری آرسنیک. یک شکل انفجاری نادر از آنتیموان می تواند از الکترولیز تری کلرید آنتیموان تشکیل شود. هنگامی که با استفاده از یک تیز خراشیده می شود ، یک واکنش گرمازایی رخ می دهد و بخارهای سفید به صورت فرم های آنتیموان فلزی داده می شوند. هنگامی که با یک گلدان در هاون مالیده می شود ، یک انفجار شدید اتفاق می افتد. آنتیموان سیاه با خنک شدن سریع بخار آنتیموان تشکیل می شود. ساختار بلوری آن همانند فسفر قرمز و آرسنیک سیاه است. در هوا اکسید می شود و ممکن است خود به خود شعله ور شود. در دمای 100 درجه سانتیگراد ، به تدریج به شکل پایدار تبدیل می شود. آلوتروپ زرد آنتیموان بی ثبات ترین است. این تنها با اکسیداسیون استیبین () در دمای 90 درجه سانتی گراد تولید شده است. بالاتر از این دما و در نور محیط ، این آلوتروپ متاستاز به آلوتروپ سیاه پایدارتر تبدیل می شود.[8][9]
ایزوتوپ ها
آنتیموان دارای دو ایزوتوپ پایدار است: 121Sb با فراوانی طبیعی 57.36٪ و 123Sb با فراوانی طبیعی 42.64٪. همچنین دارای 35 رادیوایزوتوپ است که طولانی ترین عمر آن 125Sb با نیمه عمر 2.75 سال است. علاوه بر این ، 29 حالت قابل تبدیل شدن مشخص شده است. پایدارترین آنها 120m1Sb با نیمه عمر 5.76 روز است. ایزوتوپ هایی که سبک تر از 123Sb پایدار هستند ، با پوسیدگی β + متلاشی می شوند و آنهایی که سنگین تر هستند ، با برخی استثنا ها ، با پوسیدگی β− متلاشی می شوند.
رخداد
فراوانی آنتیموان در پوسته زمین 0.2 تا 0.5 قسمت در میلیون تخمین زده می شود ، قابل مقایسه با تالیم 0.5 قسمت در میلیون و نقره در 0.07 ppm. حتی اگر این عنصر فراوان نباشد ، در بیش از 100 گونه معدنی یافت می شود. آنتیموان گاهی خالص یافت می شود ، اما بیشتر در سولفید استیبنیت یافت می شود که ماده معدنی غالب است. [10]
کاربرد
حدود ۶۰٪ آنتیموان در بازدارندههای شعله مصرف می شود و ۲۰٪ در آلیاژهای باتری ، یاتاقان های ساده و لحیم ها استفاده می شود. [11]
بازدارندههای شعله
آنتیموان عمدتاً به عنوان تری اکسید برای ترکیبات ضد شعله استفاده می شود ، همیشه در ترکیب با بازدارندههای شعله هالوژنه به جز در پلیمرهای حاوی هالوژن. اثر بازدارندهٔ شعله تری اکسید آنتیموان در اثر تشکیل ترکیبات آنتیموان هالوژنه ، [12] که با اتم های هیدروژن و احتمالاً با اتم های اکسیژن و رادیکال های OH واکنش نشان می دهند ، باعث مهار آتش می شود. [13]بازارهای این بازدارنده های شعله شامل لباس کودکان ، اسباب بازی ها ، هواپیماها و روکش صندلی های اتومبیل است. همچنین برای مواردی مانند روکش موتور هواپیمای سبک به رزین های پلی استر در کامپوزیت های فایبرگلاس اضافه می شوند. این رزین در حضور شعله ای از خارج می سوزد ، اما با برداشته شدن شعله خارجی خاموش می شود. [14][15]
آلیاژها
آنتیموان آلیاژی بسیار مفیدی با سرب تشکیل می دهد و سختی و مقاومت مکانیکی آن را افزایش می دهد. برای بیشتر برنامه های کاربردی شامل سرب ، مقادیر مختلف آنتیموان به عنوان فلز آلیاژ استفاده میشود. در باتریهای اسید سرب، این افزودنی باعث بهبود مقاومت صفحات و ویژگیهای شارژ می شود. [16] برای قایق های بادبانی ، از پیچ های سربی به عنوان وزنه مقابل استفاده می شود ، از 600 پوند تا بیش از 8000 پوند. برای بهبود سختی و مقاومت کششی پیچ سرب ، آنتیموان با سرب بین 2 تا 5 درصد حجمی مخلوط می شود. از آنتیموان در آلیاژهای ضد اصطکاک (مانند فلز بابیت) ، [17] در گلوله ها و گلوله های سربی ، غلاف کابل های برقی ، نوع فلز (به عنوان مثال برای ماشین های چاپ لینوتیپ ) ، لحیم کاری (برخی از لحیم های "بدون سرب") استفاده می شود حاوی 5٪ Sb) ، [64] در پیوتر ، و در آلیاژهای سخت کننده با مقدار قلع کم در ساخت لوله های اندام.
کاربرد های دیگر
یک کاربرد به عنوان یک تثبیت کننده و کاتالیزور برای تولید پلی اتیلن ترفتالات است. مورد دیگر به عنوان یک ماده ریز کننده برای از بین بردن حباب های میکروسکوپی در شیشه ، بیشتر برای صفحه های تلویزیون است ؛ یون های آنتیموان با اکسیژن در تعامل هستند و تمایل این دو را برای ایجاد حباب سرکوب می کنند. سومین کاربرد رنگدانه ها است. [18][19]
از آنتیموان به طور فزاینده ای در نیمه هادی ها به عنوان ماده مخدر در ویفرهای سیلیکونی نوع n [68] برای دیودها ، ردیاب های مادون قرمز و دستگاه های اثر هال استفاده می شود. در دهه 1950 ، ساطع کننده ها و جمع کننده های ترانزیستورهای اتصال آلیاژ n-p-n با دانه های ریز آلیاژ سرب-آنتیموان دوپ شدند. آنتیمونید ایندیوم به عنوان ماده ای برای ردیاب های مادون قرمز استفاده می شود. [20][21]
زیست شناسی و پزشکی کاربردهای کمی برای آنتیموان دارند.از ترکیبات آنتیموان به عنوان داروهای ضد پروتوزوآ استفاده می شود. آنتی مونیل تارتارات پتاسیم یا تریک تارتار ، از سال 1919 به بعد به عنوان داروی ضد شیستوزومی مورد استفاده قرار گرفت. پس از آن با praziquantel جایگزین شد. [22] آنتیموان و ترکیبات آن در چندین داروی دامپزشکی مانند آنتیومالین و تیومالات آنتیموان لیتیم به عنوان نرم کننده پوست در نشخوارکنندگان استفاده می شود. [23] آنتیموان اثر مغذی یا تغذیه کننده ای بر روی بافتهای کراتینه شده در حیوانات دارد.
داروهای مبتنی بر آنتیموان ، مانند مگلومین آنتیمونیات ، نیز داروهای انتخابی برای درمان بیماری سالک در حیوانات اهلی محسوب می شوند. علاوه بر دارا بودن شاخص های درمانی پایین ، داروها حداقل مغز استخوان را در خود جای می دهند ، جایی که برخی از آمیستگوتهای لیشمانیا در آن ساکن هستند و بهبود بیماری - به ویژه فرم احشایی - بسیار دشوار است. [24]آنتیموان عنصری به عنوان قرص آنتیموان یک بار به عنوان دارو استفاده می شد. دیگران می توانند پس از بلع و از بین بردن مجدداً از آن استفاده کنند.
آنتیموان (III) سولفید در سر بعضی از مسابقات ایمنی استفاده می شود. سولفیدهای آنتیموان به ثبات ضریب اصطکاک در مواد لنت ترمز خودرو کمک می کنند. از آنتیموان در گلوله ها ، ردیاب های گلوله ، رنگ ، هنر شیشه و به عنوان مات کننده در مینا استفاده می شود. آنتیموان -124 همراه با بریلیم در منابع نوترونی استفاده می شود. اشعه گاما که توسط آنتیموان -124 ساطع می شود ، تجزیه نوری بریلیوم را آغاز می کند. نوترونهای ساطع شده دارای انرژی متوسط 24 کیلو ولت هستند. از آنتیموان طبیعی در منابع نوترونی راه اندازی استفاده می شود.
از نظر تاریخی ، پودر حاصل از آنتیموان خرد شده (سرمه) با استفاده از میله فلزی و چاشنی بر روی چشم زده می شود ، که قدیمی ها تصور می کردند در بهبود عفونت چشم کمک می کند. این عمل هنوز در یمن و سایر کشورهای مسلمان دیده می شود
فراوانی
در جدول زیر اطلاعات ۵ کشور اول تولیدکننده این عنصر در سال ۲۰۱۰ میلادی عنوان شدهاست.
| کشور | تن | % درصد کل |
|---|---|---|
| 100,000 | 76.9 | |
| v |
9,000 | 6,9 |
| 8,000 | 6,2 | |
| 4,000 | 3,1 | |
| تولید جهانی | 130,000 | ۱۰۰٫۰ |
| معنای آنتیموان را در ویکیواژه، واژهنامهٔ آزاد، ببینید. |
منابع
- Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Anastas Sidiropoulos. "Studies of N-heterocyclic Carbene (NHC) Complexes of the Main Group Elements" (PDF). p. 39.
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- جدول تناوبی عناصر (مندلیف) جرارد چشر انتشارات شباهنگ
- حبیش تفلیسی- بیان الصناعات، تصحیح ایرج افشار در «فرهنگ ایران زمین» - سال ۱۳۳۶، ص330. + رک لغتنامه دهخدا، ذیل «روی سخته»
- چشر، جرارد (۱۳۹۱). جدول تناوبی عناصر (مندلیف). انتشارات شباهنگ. شابک ۹۷۸-۹۶۴-۶۱۲۷-۸۲-۱.
- «"Metals Used in Coins and Medals". ukcoinpics.co.uk. Archived from the original on 26 December 2010. Retrieved 16 October 2009».
- "Antimony" in Kirk-Othmer Encyclopedia of Chemical Technology, 5th ed. 2004.
- «Norman, Nicholas C (1998). Chemistry of arsenic, antimony, and bismuth».
- «http://minerals.usgs.gov/minerals/pubs/commodity/antimony/mcs-2016-antim.pdf» (PDF). پیوند خارجی در
|title=وجود دارد (کمک) - «Butterman, C.; Carlin, Jr., J. F. (2003). "Mineral Commodity Profiles: Antimony" (PDF). United States Geological Survey» (PDF).
- «Weil, Edward D.; Levchik, Sergei V. (4 June 2009). "Antimony trioxide and Related Compounds". Flame retardants for plastics and textiles: Practical applications».
- Hastie, John W. (1973). "Mass spectrometric studies of flame inhibition: Analysis of antimony trihalides in flames". Combustion and Flame.
- Grund, Sabina C.; Hanusch, Kunibert; Breunig, Hans J.; Wolf, Hans Uwe (2006) "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- «Weil, Edward D.; Levchik, Sergei V. (4 June 2009). Flame retardants for plastics and textiles: Practical applications».
- «Kiehne, Heinz Albert (2003). "Types of Alloys". Battery Technology Handbook. CRC Press».
- «Williams, Robert S. (2007). Principles of Metallography».
- De Jong, Bernard H. W. S.; Beerkens, Ruud G. C.; Van Nijnatten, Peter A. (2000). "Glass". Ullmann's Encyclopedia of Industrial Chemistry.
- «Yamashita, H.; Yamaguchi, S.; Nishimura, R.; Maekawa, T. (2001). "Voltammetric Studies of Antimony Ions in Soda-lime-silica Glass Melts up to 1873 K"» (PDF).
- «Kinch, Michael A (2007). Fundamentals of infrared detector materials».
- «Willardson, Robert K & Beer, Albert C (1970). Infrared detectors».
- Harder, A. (2002). "Chemotherapeutic approaches to schistosomes: Current knowledge and outlook". Parasitology Research.
- «Kassirsky, I. A.; Plotnikov, N. N. (1 August 2003). Diseases of Warm Lands: A Clinical Manual».
- «Organisation Mondiale de la Santé (1995). Drugs used in parasitic diseases».
- «"Mineral Commodity Summaries: Antimony"» (PDF).
| در ویکیانبار پروندههایی دربارهٔ آنتیموان موجود است. |
