اوگانسون
اوگانسون نام رسمی برای عنصر فوق سنگین با عدد اتمی ۱۱۸ و نماد شیمیایی Og است. هم چنین با اکارادون یا عنصر ۱۱۸ شناخته میشود و در جدول تناوبی عناصر، یک عنصر بلوک p و آخرین عنصر دوره هفتم است. اوگانسون در حال حاضر تنها عضو مصنوعی گروه ۱۸ میباشد. بزرگترین عدد اتمی و جرم اتمی بین عناصر کشف شده تاکنون را دارد.
| اوگانسون | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد جرمی | ۲۹۴ (پایدارترین ایزوتوپ) (unconfirmed: 295) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| اوگانسون در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 118 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | گاز نجیب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Unknown chemical properties, was expected to be a گاز نجیب; now predicted to be metallic-looking reactive solid, and either a نیمرسانا (possibly a شبهفلز) or a فلزات پسواسطه[2][3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Rn] 5f14 6d10 7s2 7p6 (predicted)[4][5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| لایه الکترونی | 2, 8, 18, 32, 32, 18, 8 (predicted) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | solid (predicted)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 320 کلوین (50 سانتیگراد ) (predicted)[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 350±30 کلوین (80±30 سانتیگراد ) (extrapolated)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (نزدیک r.t.) | 4.9–5.1 گرم بر سانتیمتر مکعب (predicted)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه بحرانی | 439 کلوین • 6.8 مگاپاسکال (extrapolated)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی ذوب | 23.5 ژول بر مول (extrapolated)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 19.4 کیلوژول بر مول (extrapolated)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | (−1),[5] (0), (+1),[9] (+2),[10] (+4),[10] (+6)[5] (predicted) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | 157 pm (predicted)[13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگیها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | (fcc) (extrapolated)[14] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 54144-19-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تاریخچه | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نام | after یوری اوگانسیان | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prediction | Hans Peter Jørgen Julius Thomsen (1895) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کشف | مؤسسه مشترک تحقیقات هستهای and آزمایشگاه ملی لارنس لیورمور (2002) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای اصلی اوگانسون | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
پرتوزایی اتم اوگانسون، بعلت جرم زیادش، بسیار ناپایدار است و از ۲۰۰۵، فقط سه یا احتمالاً چهار اتم از ایزوتوپهای 294Og شناخته شدهاست.[18] با وجود مشخصات خیلی کم تجربی مربوط به خواص و ترکیبهای ممکن آن، محاسبات نظری منجر به پیشبینیهای متعدد و بعضاً غیرمنتظرهای شدهاند. برای مثال، اگرچه اوگانسون عنصر گروه ۱۸ است، ممکن است برخلاف دیگر عناصر گروه ۱۸، یک گاز نجیب نباشد.[19] پیشتر تصور میشد تحت شرایط استاندارد یک گاز باشد اما اکنون به علت اثرات نسبیتی، یک جامد شناخته میشود.[19]
تاریخچه
تلاشهای ناموفق ترکیب
در اواخر ۱۹۹۸، فیزیکدان لهستانی روبرت اسمولانژوک محاسبات مربوط به همجوشی هسته اتم برای ترکیب اتمهای فوق سنگین شامل اوگانسون را منتشر کرد.[20] محاسبات او نشان داد که میتوان اوگانسون را با همجوشی سرب با کریپتون در شرایط کنترل شدهٔ دقیق، به وجود آورد.[20]
در ۱۹۹۹، محققان آزمایشگاه ملی لارنس برکلی از این نتایج استفاده نمودند و خیلی زود بعد از انتشار نتایج در ساینس،[21] در مطلبی منتشر شده توسط Physical Review Letters اکتشاف لیورموریم و اوگانسون را اعلام کردند.[22] محققان وقوع واکنش زیر را گزارش دادند.
- 86
36Kr + 208
82Pb → 293
118Uuo + n
سال بعد، وقتی پژوهشگران دیگر آزمایشگاهها قادر به تکرار نتایج نشدند و آزمایشگاه برکلی هم به خوبی نتوانست نتایج را تکرار کند، آنها اقدام به عذرخواهی نمودند.[23] در ژوئن ۲۰۰۲، مدیر آزمایشگاه اعلام کرد که ادعای اصلی کشف این دو عنصر بر اساس اطلاعات جعل شده توسط مؤلف اصلی ویکتور نیکوف بودهاست.[24][25]
گزارشهای اکتشاف
نخستین مشاهدهٔ زوال اتمهای اوگانسون در ۲۰۰۲ و در مؤسسه مشترک تحقیقات هستهای (JINR) توسط یوری اوگانسیان و گروهش در دوبنا روسیه انجام گرفت.[26] در ۹ اکتبر ۲۰۰۶، محققان JINR و آزمایشگاه ملی لارنس لیورمور کالیفرنیا آمریکا، که در JINR دوبنا مشغول به فعالیت هستند، اعلام کردند[15] که به شکل غیرمستقیم مجموعاً سه (احتمالاً چهار) هستهٔ اوگانسون-۲۹۴ (یک یا دو در 2002[27] و دو تای دیگر در ۲۰۰۵) حاصل از برخورد اتمهای کالیفرنیم-۲۴۹ و یونهای کلسیم-۴۸ را شناسایی کردهاند.[27] and two more in 2005) produced via collisions of کالیفرنیم-249 atoms and calcium-48 ions.[28][29][30][31][32]
- 249
98Cf + 48
20Ca → 294
118Uuo + ۳ n
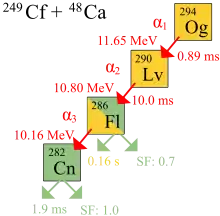
در ۲۰۱۱، آیوپاک نتایج همکاری ۲۰۰۶ دوبنا-لیورمور را مورد بررسی قرار داد و نتیجه گرفت: «سه مورد گزارش شده برای ایزوتوپ Z = ۱۱۸ فراوانی داخلی خیلی خوبی دارند ولی هیچ لنگری برای هستهٔ مشخص نیست تا در حد معیار اکتشاف خود را نشان دهد.»[33]
به علت احتمال خیلی پایین واکنش همجوشی (مقطع همجوشی حدود 0.3-0.6 pb است) آزمایش چهار ماه طول کشید و دوز پرتو ۴×۱۰۱۹ یون کلسیم را که باید به کالیفرنیم شلیک میشدند، به کار گرفت تا اولین واقعهٔ ثبت شده به عنوان ترکیب اوگانسون به وقوع بپیوندد.[34] با این وجود، محققان اطمینان زیادی دارند که نتایج مثبت نیستند، چون احتمال اینکه تشخیصها تصادفی نبوده باشند، کمتر از یک در ۱۰۰۰۰۰ تخمین زده شده بود.[35]
در آزمایشها، واپاشی آلفای سه اتم اوگانسون مشاهده شدند. واپاشی چهارمی با شکافت خود به خود مستقیم نیز مطرح شد. نیمه عمر ۰٫۸۹ میلیثانیه محاسبه شد: 294Og توسط واپاشی آلفا به 290Og واپاشیده میشود. چون فقط سه هسته وجود دارد، نیمه عمر مشتق شده از طول عمرها عدم قطعیت بالایی دارد: ۰٫۸۹+۱٫۰۷
−۰٫۳۱ ms.[15]
- 294
118Uuo → 290
116Lv + 4
2He
شناسایی هستهٔ 294Og مستقیماً با بمباران 245Cm با یونهای 48Ca و ایجاد منحصراً 290Lv به اصطلاح هستهٔ دختر،
- 245
96Cm + 48
20Ca → 290
116Lv + ۳ n,
و با بررسی اینکه واپاشی 290Og با زنجیره واپاشی هسته 294Og همخوانی داشت، مورد تأیید قرار گرفت.[15] 290Lv یا هستهٔ دختر بسیار نا پایدار است و با طول عمر ۱۴ میلیثانیه به 286Fl واپاشیده میگردد و ممکن است شکافت خود به خود یا واپاشی آلفا به 282Cn که در واقع نتیجهٔ شکافت خود به خود است، نیز روی دهند.[15]
در مدل تونل-کوانتومی، نیمه عمر واپاشی آلفای 294Og مقدار ۰٫۶۶+۰٫۲۳
−۰٫۱۸ ms با انرژی تولیدی (Q-Value) تجربی در ۲۰۰۴ منتشر شد.[36] محاسبه با میزان انرژی (Q-Value)های نظری از مدل ماکروسکوپی-میکروسکوپی مونتیان-هافمن-پاتیک-سوبیچفسکی نتایج تقریباً پایین ولی قابل مقایسهای میدهد.
نامگذاری
تا دههٔ ۱۹۶۰ اوگانسون با عنوان اکا-اماناتیون (اماناتیون نام قدیمی رادون است) شناخته میشد.[14] در ۱۹۷۹ آیوپاک توصیه نامههایی در خصوص نامگذاری عنصر با نام آناناکتیم، یک نام با قاعده ی جایگزین تا زمانی که اکتشاف عنصر تأیید شود و آیوپاک اقدام به نامگذاری آن کند، منتشر نمود.[37]
قبل از عذرخواهی ۲۰۰۲، محققان برکلی نام گیورسیم (Gh) را به خاطر آلبرت گیورسو (عضو برجستهٔ تیم تحقیقاتی) در نظر گرفته بودند.[38]
مکتشفان روسی در سال ۲۰۰۶ خبر از کار خود دادند. در ۲۰۰۷، رئیس مؤسسه روسی عنوان کرد که تیم دو نام را برای عنصر جدید لحاظ میکند: فلایوریم به افتخار گئورگی فلیرف، مؤسس آزمایشگاه تحقیقاتی در دوبنا؛ و مسکوویم جهت شناساندن استان مسکو، جایی که دوبنا در آن قرار دارد.[39] او هم چنین عنوان نمود که اگرچه عنصر در یک همکاری آمریکایی، منجر به کالیفورنیم، به کشف رسیدهاست، اما به درستی، عنصر باید به افتخار روسیه نامیده شود زیرا که آزمایشگاه واکنشهای هستهای فلروف در JINR تنها جایی در دنیا بود که میتوانست امکانات این کشف را فراهم کند.[40] این نامها بعد تر برای فلروویم (فلروویم) و لیورموریم (مسکوویم) مطرح شدند.[41] البته، نام نهایی مطرح شده برای عنصر ۱۱۶ لیورموریم بود.[42]
هیچ نامی بهطور رسمی برای عنصر پیشنهاد نشدهاست زیرا که هیچ ادعایی مبنی بر کشف آن توسط آیوپاک قبول نشدهاست. طبق دستورالعملهای فعلی آیوپاک، نام نهایی تمام عناصر باید به «-یم» ختم شود که این یعنی نام آناناکتیم تقریباً بهطور قطع به «-یم» ختم میشود و نه «-ئون»، حتی اگر که اوگانسون یک گاز نجیب شناخته شود، که همگی بهطور سنتی نامهای ختم به «-ئون» دارند (با استثنای هلیم، آن هم به این علت که وقتی کشف شد به عنوان یک گاز نجیب محسوب نمیشد).[43]
مشخصات
پایداری هسته و ایزوتوپها
.png.webp)
پایداری هسته با افزایش عدد اتمی پس از پلوتونیم، سنگینترین عنصر دیرینه به شدت کاهش مییابد و تمام ایزوتوپهای با عدد اتمی بالای ۱۰۱، به استثنای دوبنیم-۲۶۸، با نیمه عمر زیر یک روز، پرتوزایی میکنند. هیچ عنصری با عدد اتمی بالای ۸۲ (بعد از سرب) ایزوتوپ پایدار ندارد.[44] با این وجود، به علت برخی دلایل که هنوز به خوبی درک نشدهاند، کمی افزایش پایداری حول اعداد اتمی ۱۱۰ تا ۱۱۴ وجود دارد که منجر به ظهور مفهومی در فیزیک هستهای با عنوان «جزیرهٔ ثبات» میگردد. این مفهوم، مطرح شده توسط استاد دانشگاه کالیفرنیا، گلن سیبورگ، شرح میدهد که چرا عناصر فوق سنگین بیشتر از حد انتظار باقی میمانند.[45] اوگانسون پرتوزا است و نیمه عمری ظاهراً کمتر از یک میلی ثانیه دارد. با این وجود، این مقدار بیشتر از مقادیر پیشبینی شدهاست،[46] بنابراین ایدهٔ مفهوم «جزیرهٔ ثبات» را تقویت میکند.[47]
محاسبات با استفاده از مدل تونل-کوانتوم وجود ایزوتوپهای غنی از نوترون اوگانسون را با نیمه عمرهای واپاشی آلفای نزدیک به ۱ میلیثانیه پیشبینی میکنند.
محاسبات نظری انجام گرفته بر مسیرهای ترکیب و نیمه عمرهای دیگر ایزوتوپها نشان میدهند که برخی میتوانند کمی پایدارتر از ایزوتوپ ترکیب شدهٔ 294Og باشند، احتمالاً 293Og, 295Og, 296Og, 297Og, 298Og, 300Og و 302Og. از موارد مذکور، 297Og میتواند بیشترین احتمال برای کسب عنوان هستهٔ جاویدتر داشته باشد، و بنابراین میتواند محل تمرکز اقدامات بعدی حول این عنصر قرار بگیرد. برخی ایزوتوپها با نوترونهای زیاد، مانند برخی که حول 313Og قرار دارند نیز میتواند هستهٔ پایدارتری داشته باشند.[48]
خواص محاسبه شدهٔ اتمی و فیزیکی
اوگانسون عضوی از گروه ۱۸ است، عناصر با ظرفیت شیمیایی صفر. اعضای این گروه معمولاً نسبت به اکثر واکنشهای شیمیایی معمول بیاثر هستند (برای مثال، سوختن) زیرا که لایه ظرفیت بیرونی کاملاً با هشت الکترون پر شدهاست. این منجر به انرژی پیکربندی کمینه و پایداری میشود که الکترونهای بیرونی به سختی با هم پیوند دارند.[49] بهطور مشابه تصور میشود، اوگانسون لایه ظرفیت بیرونی پر دارد که الکترونهای ظرفیت آن در آرایش الکترونی 7s27p6 قرار گرفتهاند.[19]
در نتیجه، برخی انتظار دارند اوگانسون خواصی شیمیایی و فیزیک مشابه با دیگر اعضای این گروه و در جدول تناوبی بیش از همه شبیه به گاز نجیب بالایی اش یعنی رادون، داشته باشد.[50] طبق روند تناوبی انتظار میرود اوگانسون کمی فعالتر از رادون باشد. البته، محاسبات نظری نشان میدهند که کاملاً فعال است تا جایی که نمیتوان آن را یک گاز نجیب نامید.[10] علاوه بر فعالتر بودن نسبت به رادون، اوگانسون میتواند حتی فعال تر از فلروویم و کوپرنیسیم هم باشد.v علت افزایش ظاهری فعالیت شیمیایی اوگانسون نسبت به رادون بیثباتی مربوط به انرژی و گسترشی شعاعی آخرین زیرلایه ی اشغال شده یا 7p است.[19] بهطور دقیق تر، تعاملات اسپین – مداری قابل توجه بین الکترونهای 7p با الکترونهای بیاثر 7s2، بهطور مؤثری باعث ایجاد لایهٔ الکترونی دومی نزدیک به فلروویم و کاهش قابل ملاحظهای در پایداری لایههای پر عنصر ۱۱۸ میشوند.[19] همچنین نتیجهای به دست آمدهاست در خصوص اینکه اوگانسون، برخلاف دیگر گازهای نجیب، با یک الکترون ضمن آزادسازی انرژی پیوند برقرار میکند – یا به عبارت دیگر الکترون خواهی مثبت را به نمایش میگذارد.[51][52]
تاکنون انتظار میرود اوگانسون گستردهترین قطبشپذیری را بین تمام عناصر ماقبل خودش (دوبرابر رادون) در جدول تناوبی داشته باشد.[19] با برونیابی از دیگر گازهای نجیب، انتظار داریم اوگانسون نقطه جوشی بین ۳۲۰ و ۳۸۰ کلوین داشته باشد[19] که خیلی با مقادیر تخمین زده شدهٔ قبلی یعنی ۲۶۳ کلوین[53] یا ۲۴۷ کلوین[54] فاصله دارد. حتی با وجود عدم قطعیتهای زیادی در محاسبات، خیلی بعید به نظر میرسد که در شرایط استاندارد یک گاز باشد،[19] و چون محدودهٔ مایع بودن دیگر گازها خیلی کوچک است، یعنی بین ۲ تا ۹ کلوین، این عنصر در شرایط استاندارد باید جامد باشد. با این حال اگر اوگانسون در شرایط استاندارد به حالت گاز باشد، یکی از چگالترین مواد گازی در شرایط استاندارد خواهد بود (حتی اگر مثل دیگر گازهای نجیب تک اتمی باشد).
به علت قطبش پذیری فوقالعاده اش، انتظار میرود اوگانسون برخلاف قاعده انرژی یونش پایین (مشابه با سرب که ۷۰٪ رادون و بهطور قابل ملاحظهای از فلروویم کمتر است[55]) و فاز ماده چگال استانداردی داشته باشد.[19]
ترکیبات پیشبینی شده
هیچ ترکیبی از اوگانسون تاکنون به دست نیامده، اما محاسبات روی ترکیبات نظری از ۱۹۶۴ آغاز شدهاند.[14] پیشبینی شدهاست که اگر انرژی یونش این عنصر به قدر کافی بالا باشد، اکسایش آن دشوار شده و در نتیجه عدد اکسایش رایج آن ۰ خواهد بود (مثل دیگر گازهای نجیب)؛[56] با این حال، ظاهراً این نظریه درستترین نیست.[12]
محاسبات بر روی مولکول دواتمی Og2 نشانگر وجود یک پیوند تقریباً معادل با میزان محاسبه شده برای Hg2، و انرژی تفکیک پیوندی برابر 6 kJ/mol، حدوداً ۴ برابر Rn2 میباشند. اما چشمگیرتر آن است که طول پیوند کوتاهتری از Rn2 به میزان ۰٫۱۶ آنگستروم محاسبه شده که نشان دهندهٔ ساختار پیوند قابل ملاحظهای است.[19] از سوی دیگر، ترکیب OgH+ انرژی تفکیک پیوندی (به عبارت دیگر پروتون خواهی) کمتر از RnH+ نشان میدهد.[19]
پیوند بین اوگانسون و هیدروژن در OgH بسیار شل در نظر گرفته میشود و میتوان آن را به عنوان یک نیروی اصیل واندروالسی در نظر گرفت تا یک پیوند شیمیایی واقعی. در سوی دیگر، با وجود عناصر الکترونگاتیو بالا، به نظر میرسد اوگانسون مثلاً نسبت به کوپرنیسیم یا فلروویم ترکیباتی پایدارتری تشکیل دهد. اعداد اکسایش پایدار +۲ و +۴ برای فلوریدها در ترکیبهای OgF2 و OgF4 پیشبینی شدهاند. عدد +۶ به خاطر پیوند قوی در زیر لایهٔ 7p1/۲ پایداری کمتری دارد.[12] این نتیجهٔ تعاملات مدار – اسپینی است که اوگانسون را معمولاً واکنش پذیر و فعال مینماید. برای مثال، نشان داده شد که واکنش اوگانسون با F2 برای تشکیل OgF2 انرژی 106 kcal/mol را از 46 kcal/mol که از این گونه تعاملات حاصل میشود، آزاد میکند. برای مقایسه، تعامل مدار – اسپینی برای مولکول مشابه RnF2 تقریباً برابر 10 kcal/mol از انرژی ساختار 49 kcal/mol است. تعامل یکسان آرایش چهاروجهی Td را برای OgF4، برخلاف آرایش هندسی مربعی D4h برای XeF4 و هم چنین RnF4 تثبیت میکند. پیوند Og-F به احتمال زیادی یونی باشد تا یک پیوند کووالانسی که باعث غیرفرار بودن ترکیبات OgFn شود.[10][57] انتظار میرود OgF2 به علت الکتروپوزیتیوی بالای اوگانسون نسبتاً یونی باشد.[58] برخلاف دیگر گازهای نجیب (احتمالاً به جز زنون)،[59][60] اوگانسون به قدر کافی الکترون دهنده[58] تصور میشد که میتواند پیوند Og-Cl با کلر تشکیل بدهد.[10]
منابع
ترجمه از ویکیپدیا انگلیسی
- Ritter, Malcolm (9 June 2016). "Periodic table elements named for Moscow, Japan, Tennessee". Associated Press. Retrieved 19 December 2017.
- Mewes, Jan-Michael; Smits, Odile Rosette; Jerabek, Paul; Schwerdtfeger, Peter (25 July 2019). "Oganesson is a Semiconductor: On the Relativistic Band‐Gap Narrowing in the Heaviest Noble‐Gas Solids". Angewandte Chemie. 58 (40): 14260–14264. doi:10.1002/anie.201908327. PMC 6790653 Check
|pmc=value (help). PMID 31343819. - Gong, Sheng; Wu, Wei; Wang, Fancy Qian; Liu, Jie; Zhao, Yu; Shen, Yiheng; Wang, Shuo; Sun, Qiang; Wang, Qian (8 February 2019). "Classifying superheavy elements by machine learning". Physical Review A. 99 (2): 022110–1–7. Bibcode:2019PhRvA..99b2110G. doi:10.1103/PhysRevA.99.022110. hdl:1721.1/120709.
- Nash, Clinton S. (2005). "Atomic and Molecular Properties of Elements 112, 114, and 118". Journal of Physical Chemistry A. 109 (15): 3493–3500. Bibcode:2005JPCA..109.3493N. doi:10.1021/jp050736o. PMID 16833687.
- Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". In Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- Giuliani, S. A.; Matheson, Z.; Nazarewicz, W.; Olsen, E.; Reinhard, P.-G.; Sadhukhan, J.; Schuetrumpf, B.; Schunck, N.; Schwerdtfeger, P. (22 January 2019). "Colloquium: Superheavy elements: Oganesson and beyond". Reviews of Modern Physics. 91 (11001): 011001. Bibcode:2019RvMP...91a1001G. doi:10.1103/RevModPhys.91.011001.
- Bonchev, Danail; Kamenska, Verginia (1981). "Predicting the Properties of the 113–120 Transactinide Elements". Journal of Physical Chemistry. American Chemical Society. 85 (9): 1177–1186. doi:10.1021/j150609a021.
- Eichler, R.; Eichler, B., Thermochemical Properties of the Elements Rn, 112, 114, and 118 (PDF), Paul Scherrer Institut, retrieved 2010-10-23
- Han, Young-Kyu; Bae, Cheolbeom; Son, Sang-Kil; Lee, Yoon Sup (2000). "Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118)". Journal of Chemical Physics. 112 (6): 2684. Bibcode:2000JChPh.112.2684H. doi:10.1063/1.480842.
- Kaldor, Uzi; Wilson, Stephen (2003). Theoretical Chemistry and Physics of Heavy and Superheavy Elements. Springer. p. 105. ISBN 978-1402013713. Retrieved 2008-01-18.
- Pershina, Valeria. "Theoretical Chemistry of the Heaviest Elements". In Schädel, Matthias; Shaughnessy, Dawn. The Chemistry of Superheavy Elements (2nd ed.). Springer Science & Business Media. p. 154. ISBN 9783642374661.
- Fricke, Burkhard (1975). "Superheavy elements: a prediction of their chemical and physical properties". Recent Impact of Physics on Inorganic Chemistry. Structure and Bonding. 21. pp. 89–144. doi:10.1007/BFb0116498. ISBN 978-3-540-07109-9. Retrieved 4 October 2013.
- Oganesson - Element information, properties and uses, Royal Chemical Society
- Grosse, A. V. (1965). "Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em)". Journal of Inorganic and Nuclear Chemistry. Elsevier Science Ltd. 27 (3): 509–19. doi:10.1016/0022-1902(65)80255-X.
- Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, A. N.; Sagaidak, R. N.; Shirokovsky, I. V.; Tsyganov, Yu. S.; et al. (2006-10-09). "Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions". Physical Review C. 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602. Retrieved 2008-01-18.
- Oganessian, Yuri Ts.; Rykaczewski, Krzysztof P. (August 2015). "A beachhead on the island of stability". Physics Today. 68 (8): 32–38. Bibcode:2015PhT....68h..32O. doi:10.1063/PT.3.2880. OSTI 1337838.
- Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Münzenberg, G.; Antalic, S.; Barth, W.; Burkhard, H. G.; Dahl, L.; Eberhardt, K.; Grzywacz, R.; Hamilton, J. H.; Henderson, R. A.; Kenneally, J. M.; Kindler, B.; Kojouharov, I.; Lang, R.; Lommel, B.; Miernik, K.; Miller, D.; Moody, K. J.; Morita, K.; Nishio, K.; Popeko, A. G.; Roberto, J. B.; Runke, J.; Rykaczewski, K. P.; Saro, S.; Schneidenberger, C.; Schött, H. J.; Shaughnessy, D. A.; Stoyer, M. A.; Thörle-Pospiech, P.; Tinschert, K.; Trautmann, N.; Uusitalo, J.; Yeremin, A. V. (2016). "Remarks on the Fission Barriers of SHN and Search for Element 120". In Peninozhkevich, Yu. E.; Sobolev, Yu. G. Exotic Nuclei: EXON-2016 Proceedings of the International Symposium on Exotic Nuclei. Exotic Nuclei. pp. 155–164. ISBN 9789813226555.
- "The Top 6 Physics Stories of 2006". Discover Magazine. 2007-01-07. Archived from the original on 12 October 2007. Retrieved 2008-01-18.
- Smolanczuk, R. (1999). "Production mechanism of superheavy nuclei in cold fusion reactions". Physical Review C. 59 (5): 2634–2639. Bibcode:1999PhRvC..59.2634S. doi:10.1103/PhysRevC.59.2634.
- Ninov, Viktor (1999). "86
Kr". Physical Review Letters. 83 (6): 1104–1107. Bibcode:1999PhRvL..83.1104N. doi:10.1103/PhysRevLett.83.1104. - Service, R. F. (1999). "Berkeley Crew Bags Element 118". Science. 284 (5421): 1751. doi:10.1126/science.284.5421.1751.
- Public Affairs Department (2001-07-21). "Results of element 118 experiment retracted". Berkeley Lab. Archived from the original on 26 August 2011. Retrieved 2008-01-18.
- Dalton, R. (2002). "Misconduct: The stars who fell to Earth". Nature. 420 (6917): 728–729. Bibcode:2002Natur.420..728D. doi:10.1038/420728a. PMID 12490902.
- Element 118 disappears two years after it was discovered. Physicsworld.com. Retrieved on 2012-04-02.
- Oganessian, Yu. T.; et al. (2002). "Results from the first 249
Cf+48
Ca experiment" (PDF). JINR Communication. JINR, Dubna. - Oganessian, Yu. T.; et al. (2002). "Element 118: results from the first 249
Cf + 48
Ca experiment". Communication of the Joint Institute for Nuclear Research. - "Livermore scientists team with Russia to discover element 118". Livermore press release. 2006-12-03. Archived from the original on 17 October 2011. Retrieved 2008-01-18.
- Oganessian, Yu. T. (2006). "Synthesis and decay properties of superheavy elements". Pure Appl. Chem. 78 (5): 889–904. doi:10.1351/pac200678050889.
- Sanderson, K. (2006). "Heaviest element made – again". Nature News. Nature. doi:10.1038/news061016-4.
- Schewe, P. and Stein, B. (2006-10-17). "Elements 116 and 118 Are Discovered". Physics News Update. American Institute of Physics. Archived from the original on 1 January 2012. Retrieved 2008-01-18.
- Weiss, R. (2006-10-17). "Scientists Announce Creation of Atomic Element, the Heaviest Yet". Washington Post. Retrieved 2008-01-18.
- Barber, Robert C.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich W. (2011). "Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)". Pure and Applied Chemistry. 83 (7): 1. doi:10.1351/PAC-REP-10-05-01.
- "Ununoctium". WebElements Periodic Table. Retrieved 2008-01-18.
- "Element 118 Detected, With Confidence". Chemical and Engineering news. 2006-10-17. Retrieved 2008-01-18.
I would say we're very confident.
- Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, A. N.; Shirokovsky, I. V.; Tsyganov, Yu. S.; Gulbekian, G. G.; Bogomolov, S. L.; Gikal, B. N.; Mezentsev, A. N.; Iliev, S.; Subbotin, V. G.; Sukhov, A. M.; Voinov, A. A.; Buklanov, G. V.; Subotic, K.; Zagrebaev, V. I.; Itkis, M. G.; Patin, J. B.; Moody, K. J.; Wild, J. F.; Stoyer, M. A.; Stoyer, N. J.; Shaughnessy, D. A.; Kenneally, J. M.; Wilk, P. A.; Lougheed, R. W.; Il’kaev, R. I.; Vesnovskii, S. P. (2004). "Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactionsU233,238,Pu242, andCm248+Ca48". Physical Review C. 70 (6). doi:10.1103/PhysRevC.70.064609. ISSN 0556-2813.
- Chatt, J. (1979). "Recommendations for the Naming of Elements of Atomic Numbers Greater than 100". Pure Appl. Chem. 51 (2): 381–384. doi:10.1351/pac197951020381.
- "Discovery of New Elements Makes Front Page News". Berkeley Lab Research Review Summer 1999. 1999. Retrieved 2008-01-18.
- "New chemical elements discovered in Russia`s Science City". 2007-02-12. Retrieved 2008-02-09.
- Yemel'yanova, Asya (2006-12-17). "118-й элемент назовут по-русски (118th element will be named in Russian)" (به Russian). vesti.ru. Retrieved 2008-01-18.
- "Российские физики предложат назвать 116 химический элемент московием (Russian Physicians Will Suggest to Name Element 116 Moscovium)" (به Russian). rian.ru. 2011. Retrieved 2011-05-08.
- "News: Start of the Name Approval Process for the Elements of Atomic Number 114 and 116". International Union of Pure and Applied Chemistry. Retrieved 2 December 2011.
- Koppenol, W. H. (2002). "Naming of new elements (IUPAC Recommendations 2002)" (PDF). Pure and Applied Chemistry. 74 (5): 787. doi:10.1351/pac200274050787.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; Leblanc, Jacques; Moalic, Jean-Pierre (April 2003). "Experimental detection of α-particles from the radioactive decay of natural bismuth". Nature. 422 (6934): 876–878. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201.
- Considine, Glenn D.; Kulik, Peter H. (2002). Van Nostrand's scientific encyclopedia (9 ed.). Wiley-Interscience. ISBN 978-0-471-33230-5. OCLC 223349096.
- Oganessian, Yu. T. (2007). "Heaviest nuclei from 48Ca-induced reactions". Journal of Physics G: Nuclear and Particle Physics. 34 (4): R165–R242. Bibcode:2007JPhG...34..165O. doi:10.1088/0954-3899/34/4/R01.
- "New Element Isolated Only Briefly". The Daily Californian. 2006-10-18. Archived from the original on 23 August 2014. Retrieved 2008-01-18.
- Duarte, S. B.; Tavares, O. A. P.; Gonçalves, M.; Rodríguez, O.; Guzmán, F.; Barbosa, T. N.; García, F.; Dimarco, A. (2004). "Half-life predictions for decay modes of superheavy nuclei". Journal of Physics G: Nuclear and Particle Physics. 30 (10): 1487–1494. Bibcode:2004JPhG...30.1487D. doi:10.1088/0954-3899/30/10/014.
- Bader, Richard F.W. "An Introduction to the Electronic Structure of Atoms and Molecules". McMaster University. Retrieved 2008-01-18.
- "Ununoctium (Og) – Chemical properties, Health and Environmental effects". Lenntech. Archived from the original on 16 January 2008. Retrieved 2008-01-18.
- Goidenko, Igor; Labzowsky, Leonti; Eliav, Ephraim; Kaldor, Uzi; Pyykko¨, Pekka (2003). "QED corrections to the binding energy of the eka-radon (Z=118) negative ion". Physical Review A. 67 (2): 020102(R). Bibcode:2003PhRvA..67b0102G. doi:10.1103/PhysRevA.67.020102.
- Eliav, Ephraim; Kaldor, Uzi; Ishikawa, Y; Pyykkö, P (1996). "Element 118: The First Rare Gas with an Electron Affinity". Physical Review Letters. 77 (27): 5350–5352. Bibcode:1996PhRvL..77.5350E. doi:10.1103/PhysRevLett.77.5350. PMID 10062781.
- Seaborg, Glenn Theodore (1994). Modern Alchemy. World Scientific. p. 172. ISBN 981-02-1440-5.
- Takahashi, N. (2002). "Boiling points of the superheavy elements 117 and 118". Journal of Radioanalytical and Nuclear Chemistry. 251 (2): 299–301. doi:10.1023/A:1014880730282.
- Nash, Clinton S.; Bursten, Bruce E. (1999). "Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118". Journal of Physical Chemistry A. 1999 (3): 402–410. doi:10.1021/jp982735k.
- "Ununoctium: Binary Compounds". WebElements Periodic Table. Retrieved 2008-01-18.
- Pitzer, Kenneth S. (1975). "Fluorides of radon and element 118". Journal of the Chemical Society, ChemicalCommunications (18): 760–761. doi:10.1039/C3975000760b.
- Seaborg (c. 2006). "transuranium element (chemical element)". Encyclopædia Britannica. Retrieved 2010-03-16.
- 张青莲 (November 1991). 《无机化学丛书》第一卷:稀有气体、氢、碱金属. Beijing: Science Press. pp. P72. ISBN 7-03-002238-6.
- Proserpio, Davide M. ; Hoffmann, Roald; Janda, Kenneth C. (1991). "The xenon-chlorine conundrum: van der Waals complex or linear molecule?". Journal of the American Chemical Society. 113 (19): 7184. doi:10.1021/ja00019a014.
پیوند به بیرون
- ELEMENT 118: EXPERIMENTS on DISCOVERY, archive of discoverers' official web page
- Chemistry-Blog: Independent analysis of 118 claim
- WebElements: Ununoctium
- Apsidium: Ununoctium - Moskowium
- It's Elemental: Ununoctium
- On the Claims for Discovery of Elements 110, 111, 112, 114, 116, and 118 (IUPAC Technical Report)
| در ویکیانبار پروندههایی دربارهٔ اوگانسون موجود است. |
