اسید
اسید (به انگلیسی: Acid) مولکول یا یونی است که قابلیت اهدای یک پروتون (یون هیدروژن ) دارد (طبق نظریه اسید برونستد-لوری)، یا در تعریف دیگری، اسید ماده ای است که قابلیت شکل دهی یک پیوند کووالانسی با یک جفت الکترون را دارد. (طبق نظریه اسید لوئیس).[1]
| اسیدها و بازها |
|---|
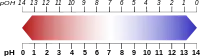 |
| انواع اسید |
|
| انواع باز |
|
اولین دسته اسیدها، اهداکنندگان پروتون یا اسیدهای Brønsted-Lowry هستند. در حالت خاص محلولهای آبی، اهدا کنندگان پروتون یون هیدرونیوم را تشکیل میدهند و به عنوان اسیدهای آرِنیوس شناخته میشوند. برونستد و لوری نظریه آرنیوس را تعمیم دادند تا شامل حلالهای غیرآبی نیز باشد. یک اسید برونستد یا آرنیوس معمولاً حاوی یک اتم هیدروژن متصل به یک ساختار شیمیایی است که پس از از دست دادن هنوز از نظر انرژی مساعد است.
تعاریف قدیمی
اسیدها موادی ترش مزهاند، خاصیت خورندگی دارند، شناساگرها را تغییر رنگ میدهند و بازها را خنثی میکنند.
لی بیگ: اسید موادی هست که در ساختار خود هیدروژن یا هیدروژنهایی دارند که در واکنش با فلزها توسط یونهای فلز جایگزین میشوند.
آرنیوس: اسیدها موادی هستند که ضمن حل شدن در آب یون +H (یون هیدروژن) آزاد میکنند. البته یون +H به صورت آزاد در آب وجود ندارد و به سرعت آبپوشی شده و تبدیل به یون هیدرونیوم (+H3O) میشود. بازها موادی هستند که ضمن حل شدن در آب یون -OH (یون هیدروکسید) آزاد میکنند. این تعریف فقط به موادی محدود میشود که در آب قابل حل باشند (یکی از اشکالات مدل اسیدی آرنیوس در همین است). نظریه آرنیوس در تصحیح و تکمیل نظریات آنتوان لاووازیه و سر همفری دیوی مطرح شد. قبل از سوانت آرنیوس و در حدود سال ۱۸۰۰ میلادی، اغلب شیمیدانان فرانسوی از جمله آنتوان لاووازیه، تصور میکردند که تمام اسیدها دارای اکسیژن هستند. این در حالی بود که اغلب شیمی دانان انگلیسی از جمله سر همفری دیوی اعتقاد داشتند که تمام اسیدها دارای هیدروژن هستند.
لوری-برونستد: اسید گونهای است که در واکنش شیمیایی پروتون (یون+H) میدهد و باز گونهای است که در واکنش شیمیایی پروتون (یون+H) میپذیرد. لوری و برونستد این تعریف را بیان کردند، که از آن بر خلاف تعریف آرنیوس میتوان در محیط غیر آبی هم استفاده کرد.
لوییس: اسیدها موادی هستند که در واکنشهای شیمیایی پیوند داتیو میپذیرند. بازها موادی هستند که در واکنشهای شیمیایی پیوند داتیو میدهند. تعریف لوییس را با نظریه اوربیتال مولکولی هم میتوان بیان کرد. بهطور کلی، اسید میتواند یک جفت الکترون از بالاترین اوربیتال خالی در پایین اوربیتال خالی خود دریافت کند. این نظر را گیلبرت لوییس مطرح کرد. با اینکه این تعریف گستردهترین تعریف است. تعریف لوری-برونستد کاربرد بیشتری دارد. با استفاده از این تعریف میتوان میزان قدرت یک اسید را هم مشخص نمود. از این مفهوم در شیمی آلی هم استفاده میشود (مثلاً در کربوکسیلیک اسید).
در مقابل، بازها موادی با مزهٔ گس-تلخ هستند. حالتی مانند صابون در تماس با دست دارند، شناساگرها را تغییر رنگ میدهند و اسیدها را خنثی میکنند. اگر یک اسید و یک باز با هم واکنش بدهند آب و نمک تولید میشود (نمکها خود از یک فلز و یک نافلز تشکیل شدهاند).
نامگذاری
اسیدها بر اساس آنیون (نافلز)هایشان نامگذاری میشوند. پسوند یونی را حذف و با پسوندی جدید جایگزین میکنیم (گاهی اوقات پیشوند)، طبق جدول زیر. برای مثال، HCl دارای آنیون کلرید است، پس پسوند -ید را حذف گرده و به صورت هیدروکلریک اسید درمیآوریم. باید توجه داشت HCl در حالت گازی هیدروژن کلرید و در حالت محلول هیدروکلریک اسید خوانده میشود این قانون در مورد موارد مشابه نیز صادق است
اسیدهای معدنی ی بدون اکسیژن طبق دستور زیر نامگزاری میشوند.
- هیدرو+نام نافلز+یک+اسید (مانند HCl هیدروکلریک اسید)
اسیدهای معدنی اکسیژن دار طبق دستور زیر نامگذاری میشوند:
- نام نافلز+یک+اسید (مانند H2CO3 کربنیک اسید)
اگر نا فلز با دو ظرفیت متفاوت دو اکسید متفاوت تولید کند، در اسیدی که ظرفیت نا فلز کمتر است با لفظ (و) و در اسیدی که ظرفیت نا فلز بیشتر است با لفظ (یک) خوانده میشود؛ مانند H3PO3 فسفرو اسید و H3PO4 فسفریک اسید.
اسیدهای آلی نیز طبق دستور زیر نامگزاری میشوند:
- نام آلکانهای هم کربن+وییک+اسید (مانند HCOOH متانوییک اسید)
| پیشوند آنیون | پسوند آنیون | پیشوند اسید | پسوند اسید | مثال |
|---|---|---|---|---|
| پر | ات | پر | یک اسید | پرکلریک اسید (HClO۴) |
| ات | یک اسید | کلریک اسید (HClO۳) | ||
| یت | و اسید | کلرو اسید (HClO۲) | ||
| هیپو | یت | هیپو | و اسید | هیپوکلرو اسید (HClO) |
| ید | هیدرو | یک اسید | هیدروکلریک اسید (HCl) |
خواص شیمیایی
واکنش اسیدها عموماً به شکل HA ![]() H+ + A− صورت بندی میشود، که HA نمایانگر اسید و A− نشانگر باز مزدوج است. جفتهای باز مزدوج در یک پروتون تفاوت دارند و افزودن یا کاستن (پروتون زائی و پروتون زدایی) یک p میتواند آنها را به یکدیگر تبدیل کند.
باید توجه داشت که اسید میتواند عضو باردار و باز مزدوج میتواند ماده خنثی باشد که در آن صورت، شمای کلی واکنش به این قرار خواهد بود:
HA+
H+ + A− صورت بندی میشود، که HA نمایانگر اسید و A− نشانگر باز مزدوج است. جفتهای باز مزدوج در یک پروتون تفاوت دارند و افزودن یا کاستن (پروتون زائی و پروتون زدایی) یک p میتواند آنها را به یکدیگر تبدیل کند.
باید توجه داشت که اسید میتواند عضو باردار و باز مزدوج میتواند ماده خنثی باشد که در آن صورت، شمای کلی واکنش به این قرار خواهد بود:
HA+ ![]() H+ + A.
در انحلال تعادلی میان اسید و باز مزدوج آن وجود دارد. ثابت تعادل(K) عبارت است از غلظت تعادل مولکولها یا یونهای موجود در کروشهها نمایانگر غلظت اند، برای نمونه [H2O] یعنی غلظت H2O.
ثابت تفکیک اسید(Ka) در مورد واکنشهای اسید-باز استفاده میشود. ارزش عددی Ka برابر است با حاصل ضرب غلظت فرآوردهها تقسیم بر غلظت واکنش دهندهها، در شرایطی که واکنش دهنده اسید(HA) است و فرآوردهها، باز مزدوج و H+ هستند.
H+ + A.
در انحلال تعادلی میان اسید و باز مزدوج آن وجود دارد. ثابت تعادل(K) عبارت است از غلظت تعادل مولکولها یا یونهای موجود در کروشهها نمایانگر غلظت اند، برای نمونه [H2O] یعنی غلظت H2O.
ثابت تفکیک اسید(Ka) در مورد واکنشهای اسید-باز استفاده میشود. ارزش عددی Ka برابر است با حاصل ضرب غلظت فرآوردهها تقسیم بر غلظت واکنش دهندهها، در شرایطی که واکنش دهنده اسید(HA) است و فرآوردهها، باز مزدوج و H+ هستند.
اسید قوی تر ثابت تفکیک بالاتری نسبت به اسید ضعیف تر دارد. نسبت یونهای هیدروژن به اسید در اسید قویتر بالاتر خواهد بود؛ زیرا اسید قوی تر تمایل بیشتری به از دست دادن پروتون دارد. به دلیل آنکه بازهٔ مقدارهای عددی ممکن برای Ka مرتبههای بزرگیِ بیشتری را در بر میگیرد، عموماً از pKa که ثابت مناسبتری است استفاده میشود، که فرمول آن عبارتست از: pKa = -log10 Ka
اسیدهای قوی تر pKa کوچکتری نسبت به اسیدهای ضعیفتر دارد. pKa محلولهای آبی در ۲۵ درجه سلسیوس بهطور تجربی اندازهگیری شده و در کتابها و منابع درسی درج میشود.
بین اسید (HA) و آب تعادل زیر برقرار میشود که آب به عنوان یک باز رفتار میکند:
HA(aq) ⇌ H۳O+(aq) + A-(aq)
ثابت تفکیک اسیدی (یا ثابت تفکیک اسید) همان ثابت تعادل واکنش اسید (HA) و آب است:
اسیدهای قوی دارای مقدار بزرگی برای Ka هستند (یعنی واکنش تعادلی به سمت راست پیشروی میکند و اسید تقریباً بهطور کامل به H۳O+ و A- تفکیک میشود).
اسیدهای ضعیف دارای مقدار کوچکی برای Ka هستند (یعنی مقدار چشمگیری از HA و A− و مقداری متعادلی از H۳O+ در انتهای واکنش باقی میماند؛ اسید بهطور جزئی واکنش میدهد). برای مثال Ka برای استیک اسید برابر ۱٫۸ x 10−۵ است. تمام اسیدهای آلی اسیدهای ضعیف هستند. نیتریک اسید، سولفوریک اسید، و پرکلریک اسید همه اسیدهای قوی هستند در حال که نیترو اسید و سولفورو اسید و هیپوکلرو اسید ضعیف هستند.
- قدرت یک اسید را با ثابت تفکیک اسیدی (Ka) یا همارزش آن pKa میسنجند، (pKa= - log(Ka)).
- pH یک محلول معیاری برای تعیین غلظت هیدرونیوم است.
اسیدهای چندپروتونی
اسیدهای چندپروتونی ترکیبهایی هستند که دارای بیش از یک هیدروژن اسیدی هستند و بهطور متوالی تفکیک میشوند.
اسیدهای تک پروتونی تنها یک واکنش تکفکیک دارند و فقط یک ثابت تفکیک اسید دارند:
- HA(aq) + H۲O(l) ⇌ H۳O+(aq) + A−(aq) Ka
یک اسید دوپروتونی (در اینجا آن را با H۲A نشان میدهیم) بسته به مقدار pH میتواند یک یا دو واکنش تکفکیک داشته باشد. هر واکنش یک ثابت تفکیک اسید دارد، Ka1 و Ka2:
- H۲A(aq) + H۲O(l) ⇌ H۳O+(aq) + HA−(aq) Ka1
- HA−(aq) + H۲O(l) ⇌ H۳O+(aq) + A۲−(aq) Ka2
ثابت تفکیک اولی همواره بیشتر از دومی است، یعنی Ka1> Ka2. برای مثال سولفوریک اسید (H۲SO۴) میتواند یک پروتون بدهد و به آنیون بیسولفات (HSO۴−) تبدیل شود. هنگامی که Ka1 بسیاز بزرگ باشد، در این صورت میتواند دومین پروتون خود را بدهد و به آنیون سولفات (SO۴۲−) تبدیل شود. (SO۴۲−) هم مقدار متوسطی دارد. مقدار بزرگ Ka1 در اولین تفکیک باعث میشود که سولفوریک اسید، اسیدی قوی باشد. همانند این، مقدار کوچک کربنیک اسید (H۲CO۳) میتواند اولین پروتون را بدهد و به آنیون بیکربنات (HCO۳−) تبدیل شود و دومین پروتون را بدهد و به کربنات (CO۳۲−) تبدیل شود. هر دو مقدار Ka کوچک هستند اما داریم Ka1> Ka2.
یک اسید سهپروتونی (H۳A) میتواند یک یا دو یا سه پروتون بدهد و سه مقدار ثابت تفکیک برای آن وجود دارد، بهطوریکه Ka1> Ka2> Ka3>:
- H۳A(aq) + H۲O(l) ⇌ H۳O+(aq) + H۲A−(aq) Ka1
- H۲A−(aq) + H۲O(l) ⇌ H۳O+(aq) + HA۲−(aq) Ka2
- HA۲−(aq) + H۲O(l) ⇌ H۳O+(aq) + A۳−(aq) Ka3
یک مثال غیرآلی از اسید سهپروتونی فسفریک اسید (H۳PO۴) است. تمام پروتونها میتوانند از دست داده شوند و به H۲PO۴−، سپس HPO۴۲−، و در آخر PO۴۳− تبدیل شود. یک مثال آلی از اسید سهپروتونی اسید سیتریک است، که میتوانند تمام پروتونهای خود را بدهد و در انتها به یون سیترات تبدیل شود.
خنثی شدن
خنثی شدن واکنش میان مقادیر برابری اسید و باز است و به تولید نمک و آب میانجامد. برای مثال هیدروکلریک اسید و سدیم هیدروکسید، آب و سدیم کلرید را میدهند:
- HCl(aq) + NaOH(aq) → H۲O(l) + NaCl(aq)
اسیدهای رایج
اسیدهای قوی
اسیدهای زیر جزو اسیدهای قوی محسوب میشوند و بهطور کامل در آب یونش مییابند و تولید یون (+H3O) میکنند.
| نام | فرمول شیمیایی | تصویر |
|---|---|---|
| هیدروبرمیک اسید | HBr | 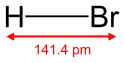 |
| هیدروکلریک اسید | HCl |  |
| هیدرویدیک اسید | HI |  |
| نیتریک اسید | HNO3 | 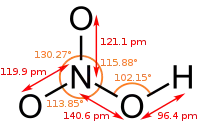 |
| سولفوریک اسید | H2SO4 | 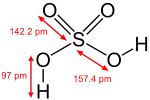 |
| پرکلریک اسید | HClO4 | 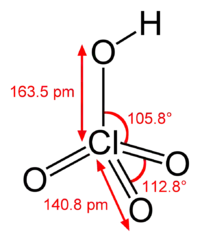 |
| اسید کلریک (جوهر | HClO3 | 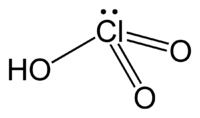 |
اسیدهای ضعیف
اسیدهای زیر جزو اسیدهای ضعیف محسوب میشوند و بهطور کامل در آب یونش نمییابند.
اسیدهای ضعیف معدنی
- بوریک اسیدH3BO3
- کربنیک اسیدH2CO3
- هیدروفلوریک اسیدHF
- فسفریک اسیدH3PO4
- هیدروسولفوریک اسیدH2S
- نیترو اسیدHNO2
- فسفرو اسیدH3PO3
- هیدروسیانیک اسیدHCN
- هیپو فسفورو اسیدH3PO2
اسیدهای ضعیف آلی
بهطور کلی تمام اسیدهای آلی اسیدی ضعیف هستند. مانند:
- استیک اسیدC2H4O2
- بنزوئیک اسیدC7H6O2
- بوتیریک اسیدC4H8O2
- سیتریک اسیدC6H8O7
- فرمیک اسیدCH2O2
- لاکتیک اسیدC3H6O3
- مالئیک اسیدC4H4O4
- ماندلیک اسیدC8H8O3
- اگزالیک اسیدC2H2O4
- پروپانوئیک اسیدC3H6O2
- پیروویک اسیدC3H4O3
- والریک اسیدC5H10O2
جستارهای وابسته
- نمک اسیدی
- باز
- نمک بازی
- باران اسیدی
منابع
- پاکروح، بهزاد- اسیدها و بازها -انتشارات اندیشه سرا-۱۳۸۵خ.
- Zumdahl, Chemistry, 4th Edition.
- شیمی ۲ پیش دانشگاهی
پیوند به بیرون
| در ویکیانبار پروندههایی دربارهٔ اسید موجود است. |
| در ویکیکتاب کتابی با عنوان: اسید و باز وجود دارد. |
