فسفریک اسید
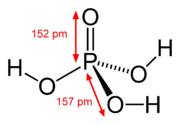
اسید فسفریک (به انگلیسی: Phosphoric acid) که به ارتوفسفریک اسید یا فسفریک(V) اسید نیز معروف است، یک اسید ضعیف با فرمول شیمیایی H3PO4 است. بهطور معمول به عنوان یک محلول غلیظ بیرنگ با غلظت ۸۵٪ در آب مشاهده میشود. ترکیب خالص آن یک جامد بیرنگ است.
| فسفریک اسید | |
|---|---|
 | |
 | |
trihydroxidooxidophosphorus | |
دیگر نامها Orthophosphoric acid | |
| شناساگرها | |
| شماره ثبت سیایاس | ۷۶۶۴-۳۸-۲ |
| پابکم | ۱۰۰۴ |
| کماسپایدر | ۹۷۹ |
| UNII | E4GA8884NN |
| شمارهٔ ئیسی | 231-633-2 |
| شمارهٔ یواِن | 1805 |
| KEGG | D05467 |
| ChEBI | CHEBI:26078 |
| ChEMBL | CHEMBL۱۱۸۷ |
| شمارهٔ آرتیئیسیاس | TB6300000 |
| جیمول-تصاویر سه بعدی | Image 1 |
SMILES
| |
| |
| خصوصیات | |
| فرمول مولکولی | H3PO4 |
| جرم مولی | 98.00 g/mol |
| شکل ظاهری | white solid or colourless viscous liquid (>42 °C) |
| چگالی | 1.885 g/mL (liquid) 1.685 g/mL (85 % solution) 2.030 g/mL (crystal at 25 °C) |
| دمای ذوب | ۴۲٫۳۵ °C (anhydrous) ۲۹٫۳۲ °C (hemihydrate) |
| دمای جوش | ۱۵۸ °C (decomp) |
| انحلالپذیری در آب | 5.48 g/mL |
| اسیدی (pKa) | 2.148 7.198 12.375 |
| گرانروی | 2.4–9.4 cP (85% aq. soln.) 147 cP (100 %) |
| ترموشیمی | |
آنتروپی مولار استاندارد S |
158 J·mol-1·K-1[1] |
آنتالپی استاندارد تشکیل ΔfH |
-1288 kJ·mol-1[1] |
| خطرات | |
| MSDS | ICSC 1008 |
| شاخص ئییو | ۰۱۵-۰۱۱-۰۰-۶ |
| طبقهبندی ئییو | Corrosive (C) |
| کدهای ایمنی | R۳۴ |
| شمارههای نگهداری | (S1/2) S26 S45 |
| لوزی آتش | |
| نقطه اشتعال | |
| ترکیبات مرتبط | |
| مرتبط با فسفر oxoacids | هیپو فسفورو اسید فوسفورو اسید پیروفسفریک اسید اسید تریفسفریک Perphosphoric acid Permonophosphoric acid |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
اسید فسفریک معمولاً در آزمایشگاههای شیمی به عنوان محلول آبی ۸۵٪ مشاهده میشود که یک مایع شربتی بیرنگ، بیبو و غیر فرار است. اگرچه اسید فسفریک تعریف دقیق اسید قوی را برآورده نمیکند، اما محلول ۸۵٪ آن بازهم میتواند پوست را به شدت تحریک کرده و به چشم آسیب برساند.
برای تشخیص این اسید خاص از سایر «اسیدهای فسفریک» مانند پیروفسفریک اسید میتوان از نام «اسید ارتوفسفریک» استفاده کرد. با این وجود، اصطلاح «اسید فسفریک» اغلب به معنای همین ترکیب خاص است؛ و این نام فعلی IUPAC آن است.
کاربردها
فسفریک اسید از جمله پرمصرفترین مواد شیمیایی در صنعت است. از آن در تولید کودهای شیمیایی فسفاته، پاککنندههای صابونی و غیرصابونی، تصفیه آب، خوراک دام و داروسازی، مکملهای خوراک دام و طیور (دی و منو کلسیم فسفات)، مواد فسفاته شویندهها، تصفیه پسابها، ، ضد حریق کردن برخی سطوح و عوامل بازدارنده اشتعال، به عنوان ماده افزودنی در نوشابههای گازدار و نیز جهت تمیزکردن و جرمگیری سطوح فلزی بهکار میرود. همچنین از اسید فسفریک ۳۷ درصد در دندانپزشکی قبل از ترمیمهای کامپوزیت و باندینگها استفاده میشود. فسفریک اسید خوراکی را از افزودن آب به P4O10 میسازند.
کاربرد در کشاورزی
کاربرد اصلی اسید فسفریک برای ساخت کودها است که تقریباً ۹۰٪ از تولید آن را شامل میشود.[2] فسفر یکی از عناصر ضروری برای رشد گیاهان محسوب میشود. فسفات های آلی ترکیباتی هستند که انرژی لازم برای بیشتر واکنشهایی که در سلولهای زنده اتفاق میافتند را مهیا میکنند؛ بنابراین خاک های غنی با کودهای فسفاتی رشد گیاهان را بالا میبرند. افزایش غلظت فسفات در سطح آب ها همچنین رشد گیاهان آبزی را بالا میبرد. اضافات کودهای شیمیایی میتوانند باعث تحریک رشد گیاهان در آبهای دریاچهها و آبهای جاری بشوند. آب فاضلابها که شامل فسفات است میتواند تأثیر یکسانی داشته باشد.
کاربرد در صنایع غذایی
از اسید فسفریک گرید غذایی (E338[3]) در تولید غذاهای اسیدی و نوشابههای گازدار مانند انواع کولاها استفاده میشود. بهکارگیری این ماده سبب دادن طعم تندی به غذا شده، و از آنجا که به صورت انبوه تولید می شود، با قیمتی ارزان و حجمی فراوان در دسترس میباشد. قیمت پایین و حجم زیاد تولید این ماده، آن را در مقایسه با طعم دهندههای طبیعی نظیر زنجبیل برای دادن طعم تندی، یا اسید سیتریک که از لیمو (lemon) و عصاره لیموترش (lime) که برای دادن طعم ترشی بکار میرود، در رتبه بالاتری قرار دادهاست. باید توجه داشت اسید فسفریک موجود در نوشابه میتواند باعث فرسایش دندان شود.[4] همچنین اسید فسفریک میتواند باعث ایجاد سنگ کلیه، به ویژه در افرادی که قبلاً سنگ کلیه داشتهاند، گردد.[5]
کاربرد در شوینده ها
در تولید شوینده ها اسید فسفریک برای نرم کردن آب بکار میرود. یون های کلسیم (II) و منیزیم (II) که باعث سختی آب می شوند، اگر از بین نروند با صابون تشکیل رسوبات غیرقابل حل میدهند که سبب ایجاد لکه بر روی لباسها در هنگام شستشو میشوند. نمک های فسفات از اسید فسفریک به طور وسیع در شوینده ها بهعنوان builder بهکار میرود. بیشتر گستره ترکیبات فسفر در مخلوط شوینده های جامد است که سدیم تری پلی فسفات یکی از آنهاست.Na5P3O10، به عنوان نرمکننده آب، سدیم تری پلی فسفات با کلسیم (II) و منیزیم (II) پیوند برقرار میکند و تشکیل اجزاء محلول را میدهد که کمپلکس یا کلیت است. این کمپلکسها از واکنش کلسیم (II) و منیزیم (II) با صابون ممانعت به عمل میآورند تا رسوب ایجاد نشود.
کاربرد در پزشکی و دندانپزشکی
از اسید فسفریک در دندانپزشکی و اورتودنسی بهعنوان عامل آمادهسازی (Etching) مینا و عاج دندان جهت تمیز کردن و افزایش اصطکاک سطح دندان استفاده میشود. همچنین از اسید فسفریک بهعنوان کاتالیست در ساخت آسپیرین بخاطر داشتن یون هیدروژن فراوان و آلایندگی کمتر در مقایسه با اسید کلریدریک و سولفوریک استفاده میشود. اسید فسفریک با فرمول H3PO4 به عنوان اورتوفسفریک اسید در پزشکی شناخته میشود و نمک ان اورتوفسفات است که یکی از درمانهای اصلی در انواعی از سنگهای کلیوی است که در تیپ III نوع جذبی هیپرکلسیوری، به دلیل نشت فسفات از کلیه، دیده میشود.[6]
کاربرد در زدودن زنگ آهن
از اسید فسفریک میتوان مستقیماً برای زدودن زنگ آهن (اکسید آهن III) از ابزارهای آهنی یا فولادی و تبدیل آهن به فسفاتهای محلول در آب استفاده نمود. پس از زدودن زنگ آهن فسفات آهن تولید شده تبدیل به ترکیب فسفات آهن سیاه شده که خود به عنوان عامل جلوگیری از خوردگی میتواند مورد استفاده قرار گیرد. اسید فسفریک به عنوان کاتالیزور در صنایع پتروشیمی کاربرد دارد.
روشهای تولید
روش تر (Wet process)
در اثر اضافه کردن سولفوریک اسید روی فسفات کلسیم بدست میآید. طبق واکنش زیر:
در این روش کانیهای فسفات را با سولفوریک اسید ترکیب میکنند، علاوه بر تولید فسفریک اسید و برخی فسفاتها که ترکیبات اصلی هستند، سایر ترکیبات (CACO3CAF2)هم تولید میشوند، از طرف دیگر واکنشهایی که در آن با از بین رفتن سولفوریک اسید، ترکیباتی تولید میشود که از نظر تجاری کماهمیت هستند (واکنشهای پارازیتی)، یونهای مزاحمی تولید شده و باعث آلودگی مخلوطها میشوند.
روش حرارتی (خشک) Thermal process
این روش شامل احتراق فسفر و هیدراسیون P4O10 میباشد. مخلوط فسفر مایع و هوا به محفظه احتراق که شبیه برج است تزریق شده و با انجام واکنش اکسیداسیون فسفر، تولید میشود. جنس محفظه احتراق نوعی فولاد مخصوص است که با H3PO4 غیرفعال شدهاست. P4O10 به دست آمده را در برج بعدی هیدراته میکنند و بخارهای باقیمانده P4O10 را، واحد شستشو به اسید فسفریک رقیق تبدیل کرده و به عنوان افشان در پایین آوردن دمای برج اول استفاده میشود.
منابع
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 0-618-94690-X.
- Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2005), "Phosphoric Acid and Phosphates", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a19_465.pub3
- "Current EU approved additives and their E Numbers". Foods Standards Agency. 14 March 2012. Retrieved 22 July 2012.
- Moynihan, P. J. (23 November 2002). "Dietary advice in dental practice". British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). "Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians". Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ناصر سیم فروش و اکبر نورعلیزاده، اورولوژی عمومی، 1389، چاپ اول، تهران، تیمور زاده:طبیب، صص: 312-314
| در ویکیانبار پروندههایی دربارهٔ فسفریک اسید موجود است. |
