بنزوئیک اسید
بنزوئیک اسید، (C۷H۶O۲ (C۶H۵COOH، یک ترکیب بلوری بی رنگ (سفید دیده میشود) است. بنزوئیک اسید سادهترین کربوکسیلیک اسیدآروماتیک نیز میباشد.
این ماده یک اسید ضعیف محسوب میشود. از نمکهای آن به عنوان نگهدارندههای غذایی استفاده میشود، همچنین در ساخت بسیاری از ترکیبات آلی دیگر از بنزوئیک اسید استفاده میشود. ضمنا این ترکیب از تمشک و توت فرنگی بدست می آید.
تاریخچه
بنزوئیک اسید در قرن شانزدهم میلادی کشف شد. اولین بار شخصی به نام Nostradamus از تقطیر خشک مادهای سنتی به نام gum benzoin بدست آورد.
در سال ۱۸۷۵ شخصی به نام Salkowski نیز پی به خواص ضد قارچ بنزوئیک اسید برد.
روشهای تهیه
روش تجاری
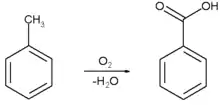
یکی از روشهای تجاری ساخت بنزوئیک اسید، اکسایش جزئی تولوئن با گاز [
[اکسیژن]] در مجاورت کاتالیزور کبالت یا منگنز نفتنات است که با بازدهٔ
بالا و رعایت اصول محیط زیستی (شیمی سبز) انجام میشود که تصویر واکنش مربوطه را
در زیر میبینید:
روش آزمایشگاهی
بنزوئیک اسید مادهٔ ارزان قیمت و در دسترسی است، در نتیجه در صورت نیاز به آن لازم نیست زحمت سنتز آن را متقبل شویم و فقط کافی است نمونهٔ تجاری آن را خریداری کرده و متناسب با کارمان آن را خالص سازی کنیم.
که برای اینکار استفاده از روش تبلور مجدد با دو حلال با حلالهای اتانول و آب بسیار مناسب میباشد.
ولی در هر صورت میتوان آن را به روشهای زیر نیز سنتز کرد:
با هیدرولیز
از هیدرولیز بنزونیتریل، بنزآمید در محیطهای اسیدی یا بازی شدید میتوان بنزوئیک اسید یا آنیون آن را بدست آورد
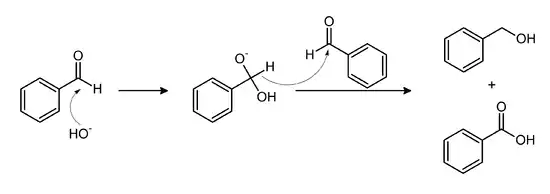
از بنزالدهید
همچنین میتوان با استفاده از واکنش کانیزارو ی تقاطعی بنزوئیک اسید را از بنزالدهید ساخت که واکنش مربوط به آن را در زیر میبینید:
از بنزیل الکل
همچنین میتوان از اکسایش بنزیل الکل در حضور محلول پتاسیم پرمنگنات داغ نیز استفاده کرد.
در این روش بلافاصله بعد از واکنش باید محلول در حالت داغ فیلتر شود تا منگنز دی اکسید تشکیل شده جدا شود و سپس محلول به حال خود رها میشود تا بلورهای بنزوئیک اسید تشکیل شود.
مصارف
برای تهیهٔ بنزیل کلرید
بنزیل کلرید (C۶H۵COCl) از واکنش تیونیل کلرید (یا پنتاکلرید فسفر یا تری کلرید فسفر یا فسژن) با بنزوئیک اسید به دست میآید. با استفاده از بنزیل کلرید میتوان بسیاری از مشتقات بنزوئیک اسید را ساخت از جمله بنزیل بنزوآت که یک طعم دهندهٔ مصنوعی میباشد.
برای تهیهٔ فنول
فنول (C۶H۵OH) از کربوکسیل زدایی همراه با اکسایش در دمای ۳۰۰oC الی ۴۰۰oC بدست میآید. البته این فرایند میتواند در حضور کاتالیزور نمک کبالتII در ۲۰۰oC هم انجام پذیرد. فنول (Phenol) نیز استفادههای بسیاری دارد، که مهمترین آنها تبدیل فنول به سیکلوهگزانول میباشد که سرآغازی برای تولید نایلون است.
نگهدارندهٔ غذا
بنزوئیک اسید و نمکهایش به عنوان نگهدارندهٔ غذا مصرف دارند که به نامهای E۲۱۲، E۲۱۱، E۲۱۰ و E۲۱۳ شناخته میشوند. هر کدام از این نمکها از واکنش مستقیم یا واکنش با نمکهای سدیم، پتاسیم یا کلسیم تهیه میشوند.
در اصل بنزوئیک اسید از رشد قارچها، مخمرها و بعضی باکتریها جلوگیری میکند. نحوهٔ اثر بنزوئیک اسید اینگونهاست که در ابتدا بنزوئیک اسید جذب سلول میشود، اگر pH درون سلولی به ۵ یا کمتر تغییر کند، تخمیر ناهوازی گلوکز از طریق Phosphofructokinase به میزان ۹۵٪ کاهش مییابد و این خود باعث نابودی آنها میشود. مقدار معمول استفاده از بنزوئیک اسید و نمکهایش به عنوان نگه دارنده بین ٪۰٫۰۵-٪۰٫۱ میباشد. البته در بعضی غذاها باید از سطوح بالاتری از بنزوئیک اسید استفاده شود که مقادیر ماکسیمم آن در قوانین بینالمللی غذا موجود است.[1][2]
البته نگرانیهایی وجود دارد مبنی بر اینکه بنزوئیک اسید با آسکوربیک اسید (ویتامین C) موجود در نوشابهها واکنش داده و مقادیر بسیار کم (ولی در دراز مدت خطرناک) بنزن تولید میشود.[3]
خطرات بنزوئیک اسید
بنزوئیک اسید یک محرک پوست و چشم است. پس باید از تماس آن با پوست و چشم خودداری شود.انجمن دولتی بهداشت صنعتی آمریکا ان را در طبقهٔ A4 یعنی غیرقابل طبقهبندی به عنوان سرطان زای انسانی قرار داده است.
پانویس
- GSFA Online Food Additive Group Details: Benzoates (۲۰۰۶)
- «EUROPEAN PARLIAMENT AND COUNCIL DIRECTIVE No ۹۵/۲/EC of 20 February 1995 on food additives other than colours and sweeteners (Consleg-versions do not contain the latest changes in a law)» (PDF). بایگانیشده از اصلی (PDF) در ۱۹ آوریل ۲۰۰۳. دریافتشده در ۳۱ اوت ۲۰۱۰.
- http://www.bfr.bund.de/cm/245/indications_of_the_possible_formation_of_benzene_from_benzoic_acid_in_foods.pdf BfR article
- «Whitfield Ointment». بایگانیشده از اصلی در ۹ اکتبر ۲۰۰۷. دریافتشده در ۳۱ اوت ۲۰۱۰.
- Charles Owens Wilson; Ole Gisvold; John H. Block (2004). Wilson and Gisvold's Textbook of Organic Medicinal and Pharmaceutical. Lippincott Williams & Wilkins. pp. ۲۳۴. ISBN 0781734819.
منابع
| بنزوئیک اسید | |
|---|---|
| |
| شناسنامه | |
| نامگذاری آیوپاک | Benzoic acid |
| جرم مولی | ۱۲۲٫۱۲ گرم بر مول |
| نما(ظاهر) | جامد سفید |
| دمای ذوب | ۱۲۲٫۴ درجه سانتیگراد |
| دمای جوش | ۲۴۹٫۲ درجه سانتیگراد |
| چگالی | ۱٫۲۶۵۹ گرم بر میلی لیتر (در ۱۵ درجهٔ سلسیوس) |
| فشار بخار | Not available |
| pH | 3/0
محلول یک درصد |
| حلالیت در آب | کم محلول در آب سرد |
| چگالی نسبی بخار | ۴٫۲۱ (نسبت به هوا) |
| دادههای کتابخانهای |
|---|
| در ویکیانبار پروندههایی دربارهٔ بنزوئیک اسید موجود است. |