اوره
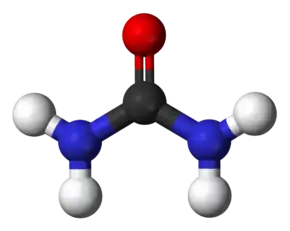
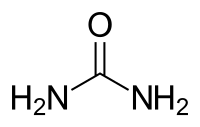
اوره (به انگلیسی: Urea) یا کاربامید (به انگلیسی: carbamide) یک ترکیب آلی با فرمول شیمیایی CO(NH₂)₂ است.
| اوره | |||
|---|---|---|---|
 | |||
| |||
 | |||
دیگر نامها Carbamide carbonyl diamide carbonyldiamine diaminomethanal diaminomethanone | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۵۷-۱۳-۶ | ||
| پابکم | ۱۱۷۶ | ||
| کماسپایدر | ۱۱۴۳ | ||
| UNII | 8W8T17847W | ||
| دراگبانک | DB03904 | ||
| KEGG | D00023 | ||
| ChEBI | CHEBI:16199 | ||
| ChEMBL | CHEMBL۹۸۵ | ||
| شمارهٔ آرتیئیسیاس | YR6250000 | ||
| کد اِیتیسی | B05,D02AE01 (WHO) | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
SMILES
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | CH4N2O۱ | ||
| جرم مولی | ۶۰٫۰۶ g mol−1 | ||
| شکل ظاهری | White solid | ||
| چگالی | 1.32 g/cm3 | ||
| دمای ذوب | ۱۳۳–۱۳۵ °C | ||
| انحلالپذیری در آب | 107.9 g/100 ml (20 °C) 167 g/100ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) | ||
| انحلالپذیری | 50g/L ethanol 500g/L glycerol[1] | ||
| خاصیت بازی (pKb) | pKBH+ = 0.18[2] | ||
| ساختار | |||
| گشتاور دوقطبی | 4.56 D | ||
| خطرات | |||
| MSDS | JT Baker | ||
| شاخص ئییو | Not listed | ||
| نقطه اشتعال | |||
| LD50 | 8500 mg/kg (oral, rat) | ||
| ترکیبات مرتبط | |||
| مرتبط با ureas | تیورآ هایدروکسی کاربیماید | ||
| ترکیبات مرتبط | کاربامید پروکساید Urea phosphate | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
اوره نخست به صورت آمونیاک بوده که از تجزیه آمینواسید ها ساخته شده بوده آمونیاک به دلیل سمیت زیاد برای بدن مضر است؛ پس آمونیاک ها در کبد با دی اکسید کربن (توسط یاخته های کبد ایجاد شده) واکنش نشان میدهد و به اوره تبدیل میشود. این عمل باعث کم شدن سمیت آن می شود تا بدن آن را بتواند در خود نگه دارد و در کلیه توسط نفرون ها دفع می شود. اوره، در متابولیسم ترکیبات حاوی نیتروژن در بدن حیوانات نقش مهمی ایفا میکند و در عین حال، ماده اصلی حاوی نیتروژن، در ادرار پستانداران بهشمار میآید. این ترکیب: سخت، بیرنگ، بیبو (گر چه آمونیاکی که در حضور آب از آن حاصل میشود و شامل بخار آب موجود در هوا نیز است، دارای بوی تندی است) است، نه اسیدی است و نه قلیایی، بسیار محلول در آب و نسبتاً غیر سمی است، از اوره به صورت گستردهای در کودهای شیمیایی به عنوان یک منبع غنی و مناسب نیتروژن استفاده میشود. اوره همچنین یکی از مواد اولیهٔ مهم در صنایع شیمیایی است. سنتز و به وجود آوردن این ترکیب آلی از یک پیش ساز غیرآلی یا معدنی، توسط فریدریش وهلر در سال ۱۸۲۸، نقطهٔ عطف بسیار مهمی در توسعه و پیشرفت دانش شیمی محسوب میشود.
کلمات اوره و کاربامید، همچنین برای نامیدن یک طبقه خاص از مواد و ترکیبات شیمیایی که در همان گروه عملکردی RR'-CO-RR مشترک هستند نیز به کار میرود. بدین معنا که یک گروه کربونیل به دو آمین آلی باقیمانده متصل شدهاست. به عنوان مثال در این مورد میتوان به: کاربامید پراکساید، آلانتوئین و هیدانتوئین اشاره نمود. اورهها وابستگی نزدیکی با بیورتها دارند و ساختمان شیمیایی آنها، مربوط و مرتبط با ساختارآمیدها amides، کارباماتها، دی ایمیدها، کاربودیمیدها و تیوکاربامیدها است.
تاریخچه
اوره برای نخستین بار، به سال ۱۷۷۳ میلادی توسط شیمیدان فرانسوی به نام هیلاری رول درون ادرار کشف گردید. در سال ۱۸۲۸ میلادی، شیمیدان آلمانی فریدریش وهلر، طی تلاشی ناموفق برای تهیه کردن سیانات آمونیم، و هنگامی که به ایزوسیانات نقره، کلرید آمونیوم اضافه کرد، اوره به دست آورد:
AgNCO + NH4Cl → (NH2)۲CO + AgCl
این اولین باری بود که یک ترکیب آلی به صورت مصنوعی از مواد پیش ساز غیرآلی (معدنی) سنتز میگردید، بدون این که ارگانیسمها یا موجودات زنده، هیچگونه دخالتی در این روند داشته باشند. نتایج حاصل از این تجربه یا آزمایش، بهطور ضمنی اعتقاد به اصالت حیات و نظریهٔ ازلی بودن موجودات زنده را، بیاعتبار ساخت: بر مبنای این نظریه، مواد شیمیایی که بدن موجودات زنده را تشکیل میدهند، اساساً متفاوت از همین مواد در اشیاء و پدیدههای بی جان هستند. درک همین موضوع، نقش بسیار مهمی در توسعهٔ شیمی آلی ایفا نمود. در واقع همین کشف مهم وهلر، موجب شد که او نامهٔ پیروزمندانهای به یوناس یاکوب برزیلیوس بنویسد و طی آن اشاره کند که:
«من باید به شما بگویم که: من قادر هستم بدون استفاده از کلیهها، چه در انسان و چه در سگ، اوره تولید بکنم!، سیانات آمونیوم، در واقع همان اورهاست…»
بسیاری معتقدند که وهلر را باید به خاطر همین اکتشاف، پدر شیمی آلی در نظر گرفت.
فیزیولوژی
اوره در بدن بسیاری از موجودات زنده، به عنوان قسمتی از سیکل یا چرخه اوره، از اکسیداسیون اسیدهای آمینه یا آمونیاک تولید میشود. در چرخهٔ مذکور، گروههای آمینه اهدا شده توسط آمونیاک و ال - آسپارتات، به اوره تبدیل میگردند، در حالی که ال - اورنیتین، سیترولین، ال آرژینینوسوکسینات و ال آرژنین به عنوان واسطه عمل میکنند. تولید اوره در کبد اتفاق میافتد و توسط ان استیل گلوتامات تنظیم میشود. اوره به شکل محلول در خون یافت میشود (در محدوده مرجع بین ۲٫۵ تا ۷٫۵ میلی مول در لیتر) و توسط کلیهها به عنوان جزئی از ادرار دفع میگردد. علاوه بر این، مقدار کمی از اوره هم در عرق ترشح میشود، که دفع آن همراه با کلرید سدیم و آب است.
اسیدهای آمینهای که از غذا دریافت میشوند، در صورتی که برای سنتز پروتئینها و دیگر مواد بیولوژیکی، مورد استفاده قرار نگیرند، توسط بدن اکسیده میشوند و اوره و دیاکسید کربن حاصل میکنند، که به عنوان منبعی جایگزین برای انرژی است. مسیر اکسیداسیون، با حذف گروه آمینه توسط ترانس آمینازها آغاز میشود و سپس گروه آمینه چرخهٔ اوره را تغذیه میکند.
آمونیاک (NH۳) یکی دیگر از محصولات فرعی مشترک متابولیسم ترکیبات نیتروژنی است. مولکولهای آمونیاک نسبت به اوره کوچکتر هستند، همچنین در مقایسه با اوره، میزان تحرّک و فرّاریت بیشتری هم دارند. اگر به این ترکیب اجازهٔ تجمع داده شود، آمونیاک pH (پ هاش) داخل سلولی را تا سطوح سمی بالا خواهد برد؛ بنابراین بسیاری از موجودات زنده آمونیاک را به اوره تبدیل میکنند، حتی اگر چنین سنتزی به هزینه کردن انرژی خالص نیاز داشته باشد. خنثی بودن اوره در مرحله عمل، و اینکه این ترکیب بسیار محلول در آب است، آن را تبدیل به وسیله نقلیهٔ امنی برای حمل و نقل و دفع نیتروژن اضافی بدن نمودهاست.
در آب، گروههای آمین ضمن جایگزینی آهسته توسط مولکولهای آب، آمونیاک و آنیون کربنات تولید میکنند. به همین دلیل، ادرار مانده و کهنه، بوی قویتر و تندتری نسبت به ادرار تازه دارد.
در انسان
تنظیم اوره توسط کلیهها یک بخش حیاتی از سوخت و ساز یا متابولیسم بدن انسان را تشکیل میدهد. علاوه بر نقشی که اوره به عنوان حامل مواد زائد نیتروژن دار در بدن ایفا میکند، این ترکیب در تبادلات جاری متقابلی که در سیستم نفرونها انجام میپذیرد (تبادلات نفرونی) نیز نقش دارد، بدین صورت که اجازه میدهد تا جذب مجدد (بازجذب) آب و یونهای مهمی که به منظور دفع، در ادرار ترشح شدهاند، صورت بگیرد. خود اوره در لولههای جمعکننده ادرار واقع در مدولای داخلی نفرونها بازجذب میشود، در نتیجه میزان اسمولاریته در مدولای اینترسیشیال، اطراف لوله صعودی (بالا رونده) و نازک قوس هنله افزایش مییابد که همین بالا رفتن اسمولاریته به نوبه خود باعث بازجذب مجدد آب میشود. با فعالیت حامل شماره ۲ اوره یا همان اوره ترانسپورتر۲، بخشی از این اوره بازجذب شده، در نهایت دوباره به شاخه نازک و صعودی توبول، جریان پیدا میکند، و سرانجام از طریق لولههای جمعآوریکننده، به درون ادرار دفع میشود.
این مکانیزم، که توسط هورمون ضد ادراری یا آنتی دیورتیک antidiuretic کنترل میشود، به بدن اجازه میدهد تا ادرار هیپراسموتیک ایجاد کند، یعنی ادراری که غلظت بالاتری نسبت به مواد حل شده در پلاسمای خون دارد. این مکانیزم همچنین برای جلوگیری از، از دست دادن آب نیز مهم است و به حفظ فشار خون، و نیز حفظ غلظت مناسب یونهای سدیم در پلاسمای خون کمک میکند.
در گونههای دیگر
در ارگانیسمهای آبزی، رایجترین شکل ضایعات نیتروژن آمونیاک است، در حالی که در ارگانیزمهای ساکن خشکی، آمونیاک سمی به اوره یا اسید اوریک تبدیل میگردد. اوره را میتوان در ادرار پستانداران و دوزیستان، و همچنین بعضی از ماهیها پیدا کرد. در پرندگان و خزندگان سوسماری شکل، سوخت و ساز نیتروژن تا حدودی متفاوت است، نیاز به آب در این نوع سوخت و ساز کمتر است و منجر به دفع نیتروژن در شکل اسید اوریک میشود. قابل توجهاست که در بچه وزغها یا نوزادان قورباغه، آمونیاک دفع میگردد، اما این وضع بعد از دگردیسی آنها به سمت تولید اوره تغییر جهت مییابد. بدین ترتیب و بر اساس، تعمیمی که در فوق ارائه شد، وجود مسیر و چرخه اوره نه تنها در پستانداران و دوزیستان، بلکه در بسیاری از موجودات دیگر، همچون: پرندگان، مهره داران، حشرات، گیاهان، مخمرها، قارچها، و حتی در میکروارگانیسمها، مستند شده و به اثبات رسیدهاست.
کاربردها
کشاورزی
بیشتر از ۹۰ ٪ از تولید اوره در دنیا، به منظور استفاده به عنوان کودهای شیمیایی حاوی نیتروژن است. در کاربردهای عمومی، اوره دارای بالاترین مقدار ازت در میان تمامی کودهای جامد نیتروژنی است (۴۶٫۷ ٪). بر این اساس، اوره پایینترین هزینههای حمل و نقل را به ازای هر واحد از تغذیه نیتروژنی به بار میآورد.
اوره در خاک، هیدرولیز شده و به آمونیاک و دیاکسید کربن مبدل میگردد. آمونیاک حاصل از این فرایند، توسط باکتریهای موجود در خاک به نیترات اکسیده میشود، و در نتیجه میتواند توسط گیاه جذب گردد. اوره همچنین در بسیاری از موارد، در فرمولاسیون چند جزئی کودهای جامد نیز، مورد استفاده واقع میشود. از آنجا که اوره به میزان زیادی محلول در آب است، بنابراین برای استفاده در محلولهای کودی نیز بسیار مناسب است (از جمله در ترکیب با آمونیوم نیترات و به صورت: UAN)، به عنوان مثال در کودهای foliar feed'خوراک برگ مانند (کود مخصوص برگ؟)'. در بهکارگیری کودها، شکل گرانولی کود بر شکل پریل آن ارجح است، چراکه به دلیل باریکتر بودن اندازه ذرات در نوع گرانولی توزیع و انتشار آن راحتتر انجام میپذیرد و این برای برنامه مکانیکی یک امتیاز بهشمار میآید.
شایعترین نوع ناخالصی موجود در اوره صناعی، بیورت است، که موجب تضعیف رشد گیاه میشود.
اوره بهطور معمول، به میزان بین ۴۰ تا ۳۰۰ کیلوگرم به ازای هر هکتار، [در اراضی کشاورزی] پخش میگردد، اما در مجموع این میزان، متفاوت است. در برنامههای کوچکتر میزان اتلاف و ضرر به علت شسته شدن پایینتر است. در طول تابستان، اوره اغلب درست قبل از آبیاری (بارش باران)، یا در حین آن پخش میشود تا زیان عمل تبخیر به حداقل رسانده شود (فرایندی که در آن، نیتروژن به صورت گاز آمونیاک در اتمسفر ناپدید میشود). اوره با سایر کودها چندان سازگار نیست.
به دلیل آن که غلظت نیتروژن (ازت) در اوره بالاست، دستیابی به میزان گستردن و پخش آن، بسیار مهم است. تجهیزات مورد نیاز در این راستا، باید به درستی کالیبره شده و به طرز مناسبی مورد استفاده قرار گیرند. حفاری و سوراخ کردن زمین نباید در جایی که تماس نزدیک با دانه دارد، انجام بگیرد، چراکه خطر صدمه و آسیب به روند جوانه زدن وجود دارد. اوره به صورت محلول در آب، به صورت افشانه یا از طریق سیستمهای آبیاری نیز کاربرد دارد.
در مورد دانه پنبه و غلات، اوره معمولاً در زمان انجام آخرین مرتبهٔ کشت و درست قبل از مرحلهٔ کاشت مورد استفاده قرار میگیرد. در مناطقی که بارش باران در آن مناطق بالاست و همچنین در خاکهای شنی (که نیتروژن میتواند به طریق شسته شدن از دست برود) یا هنگامیکه فصل بارش خوبی انتظار میرود، میتوان در طی فصل رشد، از اوره برای پوشانیدن کنارهها یا نقاط مرتفع زمین کشاورزی استفاده کرد. پوشانیدن نقاط مرتفع به وسیلهٔ اوره، همچنین در مراتع و اراضی خاص محصولات علوفهای نیز، محبوب است و طرفدار دارد. در مورد کشت نیشکر، از اوره به روش پوشانیدن کنارهها و پس از کاشت محصول بهره برده میشود. این روش برای تمامی محصولات مشابه نیشکر مثل خیزران ratoon نیز به کار میرود.
در آبیاری محصولات کشاورزی، اوره را میتوان به صورت خشک به خاک افزود، یا آن را به صورت محلول و از طریق آب آبیاری به کار برد. اوره با وزن خودش به راحتی در آب قابل حل است، اما در صورتیکه غلظت آن افزایش پیدا کند، میزان انحلال آن در آب بهطور فزایندهای دشوار میشود. فرایند انحلال اوره در آب یک فرایند اندومتریک است که باعث افت دمای محلول در هنگام حل شدن اوره میشود.
به عنوان یک راهنمایی عملی، که در واقع روش ساده و راحتی برای کود دهی یا fertigation توسط اوره (تزریق اوره در مسیرهای آبیاری) است، میتوان توصیه نمود که بیش از ۳۰ کیلوگرم اوره در هر ۱۰۰ لیتر آب حل شود و مورد استفاده قرار گیرد.
در مورد محصولات باغی، میتوان از افشانههای مخصوص برگ، که اوره را با غلظت ۰٫۵ ٪ تا ۲٫۰ ٪ پخش میکنند، استفاده کرد. در این مورد اغلب از اورهای که میزان بیورت biuret در آن اندک است، استفاده میشود.
از آنجا که اوره جاذب رطوبت از اتمسفر و سطح هواست، در نتیجه برای ذخیرهسازی آن، بهطور معمول از بسته یا کیسهٔ مهر و موم شده پالت مانند (به شکل تشک) استفاده میشود. همچنین اگر نیاز به ذخیره کردن آن به صورت عمده باشد، باید آن را تحت پوشش با پارچه مخصوص کرباسی که قیراندود و عایق اب است، قرار داد. ضمناً توصیه میشود که اوره را باید همانند بسیاری از دیگر کودهای جامد، در محلی خنک و خشک، که تهویه در آن محل به خوبی صورت میگیرد، ذخیره کرد.
صنایع شیمیایی
اوره مادهٔ اولیه برای تولید بسیاری از ترکیبات شیمیایی مهم است، مانند:
- انواع پلاستیک، به ویژه رزینهای فرمالدئید اوره.
- انواع چسب، همچون اوره فرمالدئید و اوره ملامین فرمالدئید، که در ساخت تخته سه لایی مخصوص آب کاربرد دارد.
- سیانات پتاسیم، به عنوان ماده اولیه برخی از صنایع.
- نیترات اوره، یک نوع ماده منفجره.
سیستمهای خودرو
اوره در واکنشهای SNCR و SCR به منظور کاهش آلایندههای NO دار، که در گازهای حاصل از احتراق موجود هستند، کاربرد دارد. به عنوان مثال، گازهایی که از نیروگاهها یا از موتورهای دیزلی خارج میشوند. در مورد موتورهای دیزلی، این فرایند به نام فیلتر بازسازی ذرات دیزلی خوانده میشود. در مورد سیستمهای بلوتک (BlueTec)، به عنوان مثال، از تزریق اوره محلول در آب به سیستم اگزوز خودرو استفاده میشود. آمونیاک حاصل شده از فرایند تجزیهٔ اوره، با اکسید نیتروژن خروجی واکنش داده و توسط یک مبدل کاتالیزوری، به نیتروژن و آب تبدیل میشود.
جستارهای وابسته
منابع
- http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~ZAvqWP:1:sol
- Williams, R. (2001-10-24). "pKa Data" (PDF). Archived from the original (PDF) on 2 June 2010. Retrieved 2009-11-27.