پتاسیم بیکربنات
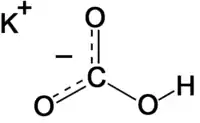
پتاسیم بیکربنات (به انگلیسی: Potassium bicarbonate) با فرمول شیمیایی KHCO۳ یک ترکیب شیمیایی با شناسه پابکم ۵۱۶۸۹۳ است؛ که جرم مولی آن 100.115 g/mol میباشد. شکل ظاهری این ترکیب، بلورهای سفید است.
| پتاسیم بیکربنات | |
|---|---|
 | |
 | |
potassium hydrogen carbonate | |
دیگر نامها potassium acid carbonate | |
| شناساگرها | |
| شماره ثبت سیایاس | ۲۹۸-۱۴-۶ |
| پابکم | ۵۱۶۸۹۳ |
| کماسپایدر | ۵۵۰۵۳ |
| شمارهٔ ئیسی | 206-059-0 |
| کد اِیتیسی | A12 |
| جیمول-تصاویر سه بعدی | Image 1 |
SMILES
| |
| |
| خصوصیات | |
| فرمول مولکولی | KHCO3 |
| جرم مولی | 100.115 g/mol |
| شکل ظاهری | white crystals |
| بوی | odorless |
| چگالی | 2.17 g/cm3 |
| دمای ذوب | Decomposes |
| انحلالپذیری در آب | 33.7 g/100 mL (20 °C) 60 g/100 mL (60 °C) |
| انحلالپذیری | practically insoluble in الکل |
| اسیدی (pKa) | 10.329[1]
6.351 (carbonic acid)[1] |
| خطرات | |
| MSDS | MSDS |
| شاخص ئییو | Not listed |
| کدهای ایمنی | R۳۶ R۳۷ R۳۸ |
| لوزی آتش | Error: imagemap_invalid_title |
| نقطه اشتعال | |
| ترکیبات مرتبط | |
| دیگر آنیونها | کربنات پتاسیم |
| دیگر کاتیونها | جوش شیرین بیکربنات آمونیوم |
| ترکیبات مرتبط | بیسولفات پتاسیم Potassium hydrogen phosphate |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
کالیسینیت = سنگ بی کربنات پتاسیم
بی کربنات پتاسیم که با نامهای پتاسیم هیدروژن کربنات یا اسید کربنات پتاسیم نیز خوانده میشود مادهای بیرنگ، بدون بو و نمکی است. بر اساس سازمان (FDA) آمریکار بی کربنات پتاسیم عموماً یک ماده امن و بیخطر است. هیچ شواهدی از سرطان در انسان نبوده و هیچ تأثیرات مضر مصرف زیاد. معمولاً پتاسیم بی کربنات به صورت سفید کریستالی و یا گرانولهای سفید رنگ وجود دارد. بی کربنات پتاسیم به ندرت بهطور طبیعی یافت میشود و سنگ معدن آن را کالیسینیت مینامند.
این ساختار معمولاً به منظور آزاد سازی کربن دیاکسید در پختن غذاها استفاده میشود، جهت خاموش کردن آتش در صنعت مواد خاموشکننده آتش در شیمی خشک، به عنوان یک معرف و به عنوان یک بافر قوی در داروسازی مصرف میشود.
افزودنی خوراکی
بی کربنات پتاسیم به عنوان افزودنی در شراب سازی و مبنا در غذا به دلیل مقدار اسیدیته متعادل مصرف میشود. پتاسیم بی کربنات یک جز معمول در نوشابه سازی به منظور ملایم ساختن تأثیرات گازی نوشابه مصرف میشود.
آتشنشانی
بی کربنات پتاسیم به عنوان عامل فرونشانی آتش در شیمی خشک مصرف میشود. این ماده تنها عامل خاموشکننده در روش شیمی خشک است که توسط سازمان آتشنشانی بینالمللی برای خاموش کردن آتشسوزیهای حاصل از سقوط هواپیماها در فرودگاهها مورد تأیید واقع شدهاست. تأثیر بی کربنات پتاسیم در فرونشانی آتش نسبت به سدیم بی کربنات دوبرابر بیشتر میباشد.
ضد کپک و قارچ
پتاسیم بیکربنات به صورت پودری یک ماده تأثیرگذار جهت از بین بردن و ممانعت از کپک زدگی و قارچ و پوسته پوسته شدن سیب و همچنین برای کشاورزی طبیعی نیز قابل مصرف است.
افزودنی جهت طعم دهنده
پتاسیم بیکربنات معمولاً در آبهای معدنی نیز جهت طعم دهندگی استفاده میشود.
جستارهای وابسته
منابع
- Goldberg, Robert N.; Kishore, Nand; Lennen, Rebecca M. (2003). "Thermodynamic quantities for the ionization reactions of buffers in water". In David R. Lide. CRC handbook of chemistry and physics (84th ed.). Boca Raton, FL: CRC Press. pp. 7–13. ISBN 978-0-8493-0595-5. Retrieved 6 March 2011.
- «IUPAC GOLD BOOK». دریافتشده در ۱۸ مارس ۲۰۱۲.
