بیماری آلزایمر
بیماری آلزایمر (به انگلیسی: Alzheimer's disease) یا بیماری فراموشی که به اختصار آلزایمر خوانده میشود که با تضعیف تدریجی ناخودآگاه در استخراج اطلاعات و افکار همراه است یک نوع اختلال عملکرد مغزی است که بتدریج تواناییهای ذهنی بیمار تحلیل میرود. بارزترین نوع از انواع مختلف زوال عقل اختلال حافظه است. اختلال حافظه معمولاً بتدریج ایجاد شده و پیشرفت میکند. در ابتدا اختلال حافظه به وقایع و آموختههای اخیر محدود میشود ولی بتدریج خاطرات قدیمی هم آسیب میبینند. بیمار پاسخ سئوالی را که چند لحظه قبل پرسیدهاست فراموش میکند و مجدداً همان سؤال را میپرسد. بیمار وسایلش را گم میکند و نمیداند کجا گذاشتهاست. در خرید و پرداخت پول دچار مشکل میشود و نمیتواند حساب دارائیش را نگه دارد. بتدریج در شناخت دوستان و آشنایان و نام بردن اسامی آنها نیز مشکل ایجاد میشود. کمکم مشکل مسیریابی پیدا شده و اگر تنها از منزل بیرون برود ممکن است گم شود. در موارد شدیدتر حتی در تشخیص اتاق خواب، آشپزخانه، دستشویی و حمام در منزل خودش هم مشکل پیدا میکند. بروز اختلال در حافظه و روند تفکر سبب آسیب عملکردهای اجتماعی و شخصی بیمار شده و در نتیجه ممکن است سبب افسردگی، عصبانیت و پرخاشگری بیمار شود . قایم کردن اشیا و لباس هم جزو این بیماری این بیماری کوچکی مغز را در پی دارد و فراموشی کامل کلات زوال عقل بروز توهم و هذیان است. مثلاً بیمار فکر کند همسرش به وی خیانت کردهاست یا همسایگان و پرستارش قصد آسیب رساندن و توطئه علیه وی را دارند. بیمار ممکن است به فرزندانش بدبین شود. گاهی اوقات بیمار افرادی را مثلاً والدین فوت شده یا اقوام را که نیستند و حضور ندارند میبینند. استرس برای غذا خوردن دارند که کم هستش
| بیماری آلزایمر | |
|---|---|
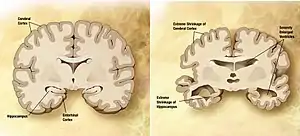 | |
| مقایسه یک مغز عادی در سمت چپ با یک مغز آلزایمر دار در سمت راست. | |
| طبقهبندی و منابع بیرونی | |
| تخصص | عصبشناسی |
| آیسیدی-۱۰ | G۳۰, F۰۰ |
| آیسیدی-9-CM | 331.0, 290.1 |
| اُمیم | ۱۰۴۳۰۰ |
| دادگان بیماریها | 490 |
| مدلاین پلاس | 000760 |
| ئیمدیسین | neuro/۱۳ |
| پیشنت پلاس | بیماری آلزایمر |
| سمپ | D000544 |
| مرور ژن | |
در موارد شدید بیمار برای انجام کارهای اولیه شخصی نیاز به کمک پیدا میکند و ممکن است توانایی کنترل ادرار و مدفوع را هم از دست دهد. بیمار دچار زوال عقل ممکن است در تکلم و یافتن کلمات مناسب مشکل پیدا کند و در نتیجه کم حرف و گوشهگیر شود. در موارد پیشرفته تر بیمار آگاهیش را نسبت به بیماری از دست داده و نمیداند دچار ناتوانی در انجام برخی کارها است و ممکن است کارهای خطر ساز انجام دهد. بتدریج ممکن است توانایی حرکتی بیمار هم دستخوش آسیب شده و مکرراً تعادلش را از دست داده زمین بخورد.
آلزایمر رایجترین شکل زوال عقل است. علائم این بیماری با از دست دادن قدرت حفظ اطلاعات بهخصوص حافظهٔ موقت در دوران پیری آغاز شده و بهتدریج با از دست دادن قدرت تشخیص زمان، افسردگی، از دست دادن قدرت تکلم، گوشهگیری و سرانجام مرگ در اثر ناراحتیهای تنفسی به پایان میرسد. مرگ پس از پنج تا ده سال از بروز علائم اتفاق میافتد؛ اما بیماری حدود بیست سال قبل از ظهور علائم آغاز شدهاست. این بیماری با از دست رفتن سیناپسهای نورونها در برخی مناطق مغز، نکروزه[persian-alpha 1] شدن سلولهای مغز در مناطق مختلف سیستم عصبی، ایجاد ساختارهای پروتئینی کروی شکلی به نام پلاکهای پیری (SP) در خارج نورونهای برخی مناطق مغز و ساختارهای پروتئینی رشتههای به نام NFT در جسم سلولی نورونها، مشخص میشود.
این بیماری علاجناپذیر را اولین بار روانپزشک آلمانی به نام آلویز آلزایمر در سال ۱۹۰۶ میلادی معرفی کرد. غالباً این بیماری در افراد بالای ۶۵سال بروز پیدا میکند ؛ گر چه آلزایمر زودرس (با شیوع کمتر) ممکن است زودتر از این سن رخ دهد. در سال ۲۰۰۶ میلادی ۲۶٫۶ میلیون نفر در جهان به این بیماری مبتلا بودند و پیشبینی میشود که در سال ۲۰۵۰ میلادی از هر ۸۵ نفر یک مبتلا به آلزایمر وجود داشته باشد. روز جهانی آلزایمر: همه ساله روز ۲۱ سپتامبر یا ۳۰ شهریور به مناسبت روز جهانی آلزایمر در دنیا مراسم و همایشهای مختلف برگزار میشود. شعار سال ۲۰۰۸ این روز (No time to lose) است، به این معنی که زمانی برای تلف کردن نداریم.
پنج درصد از جمعیت ۶۵ ساله و بالاتر به بیماری آلزایمر متوسط تا شدید مبتلا هستند و این در حالیست که ۱۰ تا ۱۵ درصد سالمندان در همین گروه سنی از بیماری آلزایمر خفیف رنج میبرند.[1]
عوامل احتمالی دخیل در بیماری آلزایمر
کاهش سطح استیلکولین در مغز: استیل کولین یک ناقل عصبی بسیار مهم به حساب میآید به طوریکه اگر به هر دلیلی سطح این ناقل عصبی در سیناپسهای مغزی کاهش پیدا کند، علایم بیماری آلزایمر پدیدار میگردد. از علل کاهش سطح استیلکولین در سیناپسها میتوان به افزایش غلظت استیلکولیناستراز(مهارکنندهی استیلکولین) و یا کاهش ATP میتوکندریایی اشاره کرد.
استرس اکسیداتیو:گونههای اکسیژن فعال (ROS) از قبیل رادیکالهای سوپراکسید، پراکسید هیدروژن و هیدروکسیل به طور مداوم در ارگانیسمهای هوازی تولید میشوند. در شرایط عادی سطح شکلگیری ROS در تعادل با ظرفیت آنتیاکسیدان سلول میباشد.
درصورتی که سلول به مدت طولانی در معرض استرسهای محیطی مثل گرما، UV و غیره قرار گیرد و یا در سیستم دفاعی آنتیاکسیدان بدن اختلالی ایجاد شود، این تعادل به هم میخورد و سطح تولید ROS بیشتر از ظرفیت آنتیاکسیدان بدن خواهد بود. نتیجهی چنین حالتی ایجاد استرس اکسیداتیو و به دنبال آن آسیب اکسیداتیو پروتئینها، لیپیدها و DNA خواهد بود. سیستم عصبی مرکزی(CNS) به علت مصرف زیاد اکسیژن و دارا بودن مقادیر بالای اسیدچرب غیراشباع، به استرس اکسیداتیو حساس میباشد. ROS در طی زنجیرهی تنفسسلولی تولید میشود و به همین دلیل میتوکندریها مهمترین منبع تولید این ترکیبات در سلول به حساب میآیند.
پروتئینهای بتاآمیوئید و تائو: ناهنجاریهای پاتولوژیکی بیماری آلزایمر میتواند شامل رسوب دو پروتئین بتاآمیلوئید و تائو باشد. پروتئینهای بتاآمیلوئید در خارج از نورون رسوب میکنند اما پروتئینهای تائو در داخل نورون قرار میگیرند. در هردو شکل، رسوبها متشکل از تجمع پروتئینها با تاخوردگی اشتباه میباشند. این ضایعات باید به تعداد کافی وجود داشته باشند تا باعث بروز آسیب بافتی لازم برای ایجاد بیماری آلزایمر شوند.
پروتئینهای بتاآمیلوئید در قسمتهایی به نام پلاکهای آمیلوئید در فضای خارج سلولی مغز مبتلایان به آلزایمر یافت میشوند. پلاکهای آمیلوئید علاوهبر بتاآمیلوئید حاوی پروتئینهای دیگری از جمله آپولوپروتئینE نیز هستند که توسط نوعی ژن مستعدکننده به آلزایمر (APOE) رمزگردانی میشود. همچنین برخی مطالعات اخیر بیان کردهاند که پروتئین بتاآمیلوئید میتواند وارد میتوکندری شده و زنجیرهی انتقال الکترون میتوکندری را تخریب نموده و منجر به تولید ROS، مهار تولید ATP، عدم عملکرد میتوکندری و تخریب نورونی گردد.
پروتئینهای تائو ساختار میکروتوبولها را حفظ میکنند و نقش مهمی را در عملکرد کامل نورونها ایفا میکنند. اما اگر مولکولهای فسفات به پروتئینهای تائو متصل شوند باعث جداشدن آنها از میکروتوبولها شده و درنهایت باعث تجزیهی توبولها میشوند. سپس مولکولهای تائو تجمع پیدا میکنند و کلافههایی را تشکیل میدهند که با عملکرد سلولی تداخل دارند. همچنین با تجزیهی توبولها، انتقلال اندامکهای سلولی با مشکل مواجه میشود که همین امر موجب کاهش ATP میتوکندریایی در دندریتها و آکسونها میشود.
فلزات، یکی از ریسک فاکتورهای ابتلا به آلزایمر
علاوه بر موارد ذکرشده، تحقیقات این فرضیه را مطرح نموده اند که مقادیر فلزات موجود در مغز میتواند کلید آسیب در بیماری آلزایمر باشد. به عنوان مثال، نشان داده شده است که در بیماران مبتلا به آلزایمر سطوح آهن مغز در برخی نواحی بیشتر است. همچنین در بررسی های انجام شده برروی مغز مبتلایان به این بیماری مشخص شده است که غلظت آلومینیوم در هیپوکامپ این بیماران ۴ برابر حالت عادی است. این فلزات قادرند تولید رادیکالهای آزاد را تحریک کنند و به همین دلیل یک منبع مهم تولید ROS بهحساب می آیند.
در رابطه با عوامل دیگر بیماری آلزایمر میتوان به جهش های ژنتیکی، دیابت شیرین، سطوح پایین B۱۲ و فولات، مواجهات شغلی(مثل میدانهای مغناطیسی و فلزات سنگین) و فعالیت بدنی شدید و طولانی مدت اشاره کرد.[2]
تاریخچه

در سال ۱۹۰۱، روانشناس و عصبشناس آلمانی «آلویز آلزایمر» اولین مورد این بیماری را کشف و در مورد آن نوشت، که بعدها به بیماری آلزایمر معروف شد. بیمار یک زن ۵۰ ساله بود به اسم «اوت دتر». آلویز آلزایمر این زن را از زمان بستری شدنش در آسایشگاهی در شهر فرانکفورت تا زمان مرگ او در سال ۱۹۰۶ همراهی کرد،[3][4]
پروتئینهای آمیلوئیدی
در بیماری آلزایمر ساختارهای پروتئینی کروی شکلی در خارج نورونهای برخی مناطق مغز و ساختارهای پروتئینی رشتهای در جسم سلولی نورونها، تشکیل میشود. این ساختارهای پروتئینی که به آنها اجسام آمیلوئیدی گفته میشود، در اثر برخی تغییرات در پروتئوم سلولهای عصبی وبهم خوردن تعادل و تغییر در میزان یا ساختار پروتئینهای پرسینیلین، آپولیپوپروتئینE، سینوکلئین، و پپتید آمیلوئیدبتا ایجاد میشود. یکی از مهمترین پروتئینهایی که در ایجاد آلزایمر نقش دارد، پروتئین پیشساز آمیلوئید (APP) نام دارد. این پروتئین در سلولهای دستگاه عصبی بیان میشود و در اتصال سلولها به هم، تماس سلولها و اتصال به ماتریکس خارج سلولی و اسکلت سلولی نقش دارد. پروتئین APP بهوسیلهٔ سه نوع آنزیم پروتئولاتیک پردازش میشود. آنزیمهای آلفا، بتا و گاما- سکرتاز، به ترتیب پروتئین APP را در اسیدهای آمینه ۶۷۸، ۶۷۱ و ۷۱۱برش میدهند. با اثر آنزیمهای گاما و بتا سکرتازبلا بر پروتئین APP، به ترتیب، پپتیدهایی به نام آمیلوئیدبتا۴۰ (دارای ۴۰ اسید آمینه) و آمیلوئیدبتا۴۲ (دارای ۴۲ اسیدآمینه) ایجاد میشوند. در حالت عادی مقدار این قطعات در سلولها کم است و بهسرعت تجزیه میشود؛ اما اگر در پروتئوم سلولهای عصبی این تعادل برهم بخورد و مقدار این قطعات افزایش یابد، ساختارهای پروتئینی کروی و درنتیجه آلزایمر ایجاد میشود. در بیماران مبتلا به سندروم داون (تریزومی ۲۱) میزان بیان پروتئین APP افزایش مییابد و علائمی شبیه آلزایمر مشاهده میشود که ممکن است به علت افزایش مقدار پپتید آمیلوئید بتا۴۲ باشد؛ زیرا ژن پروتئین APP بر روی کروموزوم ۲۱ قرار دارد.
ساختار بیوشیمیایی پلاکهای پیری
پلاکهای پیری، از رشتههای پروتئینی بنام اجسام آمیلوئید، و مقداری از پروتئینهای دیگر بنام آپولیپوپروتئینE، سینوکلئین و آلفا-آنتی کیموتریپسین، تشکیل شدهاند. بنظر میرسد تشکیل این پلاکها از عوامل اصلی ایجاد آلزایمر باشد. پروتئین اصلی تشکیل دهنده اجسام آمیلوئیدی، پروتئین آمیلوئید β یا Aβ است. چهار ایزوفرم از این پروتئین که دارای ۳۹تا ۴۳ اسید آمینه میباشند در اجسام آمیلوئیدی شناسایی شدهاست. ایزوفرمهای A۱–۴۰ (دارای ۴۰ اسید آمینه) و A۱–۴2(43) (دارای ۴۲ یا ۴۳ اسید آمینه) توانایی تشکیل اجسام آمیلوئیدی را دارند. با ساختن cDNA از روی Aβ۱–۴۰ و بررسی کتابخانههای ژنومی با آن، ناحیهای در 21q21.۲ شناسایی شد که یک پروتئین بزرگ کد میکرد. این پروتئین که پروتئین پیش ساز آمیلوئید (APP) نام گرفت دارای ایزوفرمهایی به اندازههای ۷۷۰، ۷۵۱و۶۹۵ اسید آمینه است. این پروتئینها اغلب در سلولهای دستگاه عصبی بیان میشوند و در اتصال سلولها بهم، تماس سلولها و اتصال به ماتریکس خارج سلولی و اسکلت سلولی نقش دارند. مولکولهای APP بوسیله سه نوع آنزیم پروتئولاتیک پردازش میشوند. آنزیم آلفا- سکرتاز مولکول APP را در اسید آمینه ۶۷۸ برش میدهد، آنزیم بتا- سکرتاز مولکول APP را در اسید آمینه ۶۷۱ برش میدهد و آنزیم گاما-سکرتاز مولکول APP در اسید آمینه ۷۱۱ یا ۷۱۳ برش میدهد. قطعه Aβ۱–۴۰ وAβ۱–۴۲ از اثر آنزیمهای و سکرتاز ایجاد میشوند. در حالت عادی مقدار این قطعات در سلولها کم است و به سرعت تجزیه میشود اما همانطور که بعداً خواهیم دید در صورتیکه عواملی این تعادل را برهم زنند و مقدار این قطعات افزایش یابد، اجسام آمیلوئیدی و درنتیجه آلزایمر ایجاد میشود. در بیماران مبتلا به سندروم داون (تریزومی ۲۱)نیز علائمی شبیه آلزایمر مشاهده میشود که میتواند بعلت افزایش مقدار پروتئین Aβ۱–۴2(43)، که ژن آن بر روی کروموزوم ۲۱ قرار دارد، باشد.
پروتئین های تاو
یکی از راههای تایید ابتلا به بیماری آلزایمر مشاهده رشته هایی درهم تنیده با منشا پروتئینی موسوم به "تاو" در سلولهای عصبی است. تاو، از جمله مهمترین پروتئین های موجود درون نورون ها بوده که با اتصال به انواع خاصی از رشته های اسکلت سلولی، از جمله میکروتوبولها و پلیمریزه کردن آنها در ناحیه آکسون سلولهای عصبی، به کاهش فضای بین سلولی کمک می کند. به این ترتیب نورونها به یکدیگر نزدیک شده و پیام عصبی بین سلولها انتقال می¬یابد. اگر در اثر عوامل ژنتیکی یا محیطی، تاو توانایی خود در اتصال به اسکلت سلولی را از دست بدهد، آنگاه میکروتوبوها نیز قادر به پلیمریزه شدن نخواهند بود. در نتیجه فضای بین نورونها کاهش نیافته و انتقال پیام عصبی با اختلال مواجه خواهد شد. در بیماری آلزایمر واحدهای پروتئین تاو که از میکروتوبولها رها شده اند، به یکدیگر متصل شده و بهصورت رشته هایی منظم و به شدت پایدار درون سلول تجمع می¬یابند که در نهایت منجر به مرگ سلول عصبی می¬شود. مشاهده این تجمعات از طریق روش رنگ آمیزی منفی در میکروسکوپ الکترونی امکانپذیر است. اما برای مشاهده واحدهای تشکیل دهنده این تجمعات رشته ای و سایر جزئیات آن، از روش میکروسکوپی کرایو الکترون استفاده می-شود. از آنجائیکه در مغز انسان بالغ، شش ایزوفرم متفاوت از پروتئین تاو وجود دارد، در حال حاضر تعیین ساختار این پروتئین در بیماری آلزایمر تنها بوسیله روش میکروسوپی کرایو الکترون ممکن است. محققان در مطالعه ای که در سال 2017 بر روی قشر مخ یک بیمار 74 ساله مبتلا به آلزایمر صورت گرفت، با استفاده از همین روش، موفق به مشاهده و ارائه تصویری گرافیکی از واحدهای پروتئین تاو شدند. در این مطالعه مشخص شد که هسته مرکزی تجمعات رشته ای در بیماری آلزایمر، متشکل از یک جفت پروتئین تاو است که به شکل حرف C به هم متصل شده و زمینه را برای اتصال سایر پروتئین های تاو فراهم می کنند.[5]
ژنتیک بیماری آلزایمر
بیماری آلزایمر یک بیماری پیچیده چندعاملی است. حدود۱۰ در صد موارد آن بهصورت ارثی باتوارث اتوزومال غالب(AD) است. در بیماری آلزایمر ارثی(FAD)، بیماری آلزایمر، بهصورت زود رس بین سنین ۶۵–۵۵ بروز میکند. از حدود ۹۰ درصد موارد بیماری که بهصورت اسپورادیک است، ۲۵ تا ۴۰ درصد آنها با برخی آللهای ژنها ارتباط دارند. با بررسی ژن APP در اعضاء خانوادههایی که افراد آن مبتلا به نوع زود رس آلزایمر میشدند، جهشهای مختلفی در این ژن یافت شد که در ژن APP افراد سالم وجود نداشت بیشتر این جهشها، جهشهای بدمعنا در اسید آمینههای ۷۱۶و۷۱۷ بودند. همچنین دو جهش همزمان در اسید آمینههای ۶۷۱و۶۷۰ در موارد زیادی مشاهده شد. در اثر جهش در جایگاههای ۷۱۶یا۷۱۷ فعالیت آنزیمهای β وγ- سکرتاز تغییر کرده و میزان تولید Aβ۱–۴2(43) افزایش مییابد همچنین جهشهای همزمان در جایگاه ۶۷۱و۶۷۰ باعث افزایش فعالیت -β سکرتاز و افزایش میزان Aβ۱–۴2(43) میشود. با انجام آنالیز پیوستگی بر روی اعضاء خانوادههای مبتلا به نوع زود رس آلزایمر، ناحیهای بر روی کروموزوم14 (14q24.3) در ارتباط با آلزایمر بدست آمد. mRNAهای مختلف حاصل از این ناحیه به کمک RT-PCR بررسی شده و با مقایسه موتاسیونهای موجود در mRNA افراد بیمار با افراد سالم، ژن عامل آلزایمر شناسایی شد. این ژن پروتئینی کد میکرد که پرسینیلین۱ نام گرفت. این ژن بهصورت PSEN1 نمایش داده میشود. باهمین روش یک ژن مشابه دیگر، برروی کروموزوم۱در ناحیه 1q32-۴۲ شناسایی شد که PSEN2 نام گرفت. پروتئینهای پرسینیلین۱و۲، حدود ۶۷٪ با هم شباهت دارند و پروتئینهای غشایی هستند. حدود ۴۰٪ از آلزایمرهای زودرس فامیلی بعلت جهش در این ژن است جهش در این ژن باعث افزایش مقدار Aβ۱–۴2(43) میشود (مکانیسم این عمل هنوز مشخص نیست). با استفاده از آنالیز پیوستگی ژنهای دیگری نیز در ارتباط با آلزایمر دیر هنگام فامیلی شناسایی شدهاست. یکی از این جایگاهها، برروی کروموزوم۱۹ در ناحیه 19q13.۲ قرار دارد که در آن ژن APOE، که آپولیپوپروتیئن E را کد میکند، قرار دارد. این ژن دارای سه آلل است که با بررسیهای بیشتر مشخص شد آلل APOE*۴با بیماری آلزایمر ارتباط دارد. البته وجود این آلل بهصورت هموزیگوت یا هتروزیگوت در یک فرد، حتماً با بروز آلزایمر همراه نیست و این آلل فقط شانس ابتلاء فرد به آلزایمر را افزایش میدهد. این آلل بعنوان یک فاکتور خطر، برای آلزایمر به حساب میآید؛ و عوامل دیگری مانند عوامل محیطی و فیزیولوژیکی علاوه بر آلل APOE*۴، برای بروز آلزایمر لازم است (مولتی فاکتوریال). علاوه بر این آلل، آللهایی از ژنهای A2M (که بر روی کروموزوم۱۲ در ناحیه 12p13.۳ قرار دارد) و LRP1 که بر روی کروموزوم ۱۲ در ناحیه 12q13-۱۴ قرار دارد) بعنوان فاکتورهای خطر بیماری آلزایمر به حساب میآیند. این دوژن به ترتیب پروتئینهای آلفا-۲-ماکروگلوبولین (A2M) و پروتئین وابسته به رسپتور LDL1، (LRP1) را کد میکنند.LRP1 به A2M, APPوAPOE متصل می شودو تجزیه APP را تسهیل میکند. در صورت جهش در این دو پروتئین، عمل تجزیه APP بهخوبی صورت نمیگیرد ودر اثر بهم خوردن تعادل، میزا ن پروتئینهای آمیلوئیدوژن، افزایش مییابد.
درمان بیماری آلزایمر
در حال حاضر درمان بیماری آلزایمر بیشتر شامل درمانهای علامتی، درمان اختلالات رفتاری و داروهای کاهنده سیر پیشرفت بیماری است.
کنترلهای دارویی
گرچه هنوز درمانی برای بیماری آلزایمر وجود ندارد اما با استفاده از داروها میتوان سیر پیشرفت بیماری را کند کرد و از شدت اختلال حافظه و مشکلات رفتاری بیمار کاست. داروهای مورد تأیید برای بیماری آلزایمر شامل موارد زیر است.
داروهای آرامبخش و ضد جنون: اگر با روشهای غیر دارویی نتوان رفتارهای آزاردهنده، بیقراری و پرخاشگری بیمار را کمتر کرد میتوان از داروهای جدید ضد جنون مثل اولانزاپین، کوتیاپین و ریسپریدون استفاده کرد. گاهی اوقات افسردگی سبب پرخاشگری بیمار است که با استفاده از داروهای ضد افسردگی مثل فلوکستین میتوان آن را درمان کرد.
داروهای ضد کولین استراز: در بیماری آلزایمر مقدار استیل کولین که یکی از واسطههایی شیمیایی مداخله گر در حافظهاست کم میشود. داروهای مختلفی برای افزایش مقدار استیل کولین پایانههای عصبی استفاده میشوند از جمله ریواستیگمین (Exelon)، دانپزیل (Aricept)، و گالانتامین (Razadyne). این داروها سبب بهبود حافظه، عملکرد شناختی و عملکرد اجتماعی بیمار میشوند. این داروها تا حدودی رفتارهای غیرطبیعی بیمار را نیز اصلاح میکنند. مشکل عمده این داروها عوارض گوارشی، تهوع، استفراغ، دل پیچه و اسهال است که با افزایش تدریجی دارو، مصرف همراه صبحانه و شام و با مایعات یا آب میوه از شدت عوارض کاسته میشود.
ممانتین(Ebixa, Namenda): داروی دیگری که در درمان موارد متوسط تا شدید بیماری آلزایمر استفاده میشود و تا حدودی هم اثرات محافظتی بر روی سلولهای مغزی دارد ممانتین است. این دارو نیز سبب بهتر شدن توانایی شناختی و حافظه بیمار میشود. گیجی و منگی مهمترین عوارض این دارو هستند. دارو را میتوان همراه با غذا مصرف کرد. داروهایی که اثر بخشی آنها به تأیید نرسیدهاست: داروها مختلف شیمیایی و گیاهی وجود دارند که بر اساس برخی مطالعات برای بیماری آلزایمر توصیه شدهاند اما اثر بخشی آنها هنوز به تأیید نرسیدهاست. ویتامینها مثل ویتامینE، ویتامینهای گروه ب، امگا ۳، استروژن، جینکوبیلوبا، داروهای ضد التهاب مثل بروفن از این دسته داروها هستند. رژیم غذایی سالم شامل مصرف روزانه سبزی و میوه و کاهش مصرف چربیهای اشباع به علاوه مصرف مناسب مواد غذایی حاوی ویتامینهای «آ، سی و ای» یکی از راههای مهم پیشگیری از آلزایمر است.[6]
گاما سکرتاز سابقاً برای درمان آلزایمر مورد آزمایش قرار گرفته بود.[7]
اخیراً محققان آمریکایی با بررسی نتایج یک پژوهش دریافتهاند که داروهای فشار خون که برای درمان بیماران مبتلا به فشار خون بالا استفاده میشود، خطر بروز آلزایمر را در افراد کاهش میدهد. این احتمال وجود دارد که فشار خون بالا اثر حفاظتی داشته باشد یا ممکن است چیزی که افراد مبتلا به فشار خون بالا اغلب در معرض آن قرار میگیرند مانند داروهای فشار خون از آنها در برابر ابتلا به آلزایمر محافظت میکند.[8]
یک گام در درمان بیماری
پژوهشگران دانشگاه ام آی تی آمریکا یک قدم در راه درمان بیماری برداشتهاند. آنها با تابش ال ای دی دارای بسامد ۴۰ هرتز برروی موشهای آزمایشگاهی، مشاهده کردهاند که پلاکهای بتا آمیلویید بمیزان ۴۰ تا ۵۰ درصد کاهش داشته و همچنین از سطح پروتئین تاو نیز کاسته شدهاست. این یافتهها در حالی بدست میآید که دیگر بسامدها، بین ۲۰ تا ۸۰ هرتز تأثیری را در پی نداشتهاست. برنامهریزی برای آزمایش برروی انسان در شرایط تدارک قراردارد.[9]
آلزایمر و تغذیه
پژوهشگران دانشگاه پزشکی شیکاگو با بررسی عادت غذایی ۶۰۰۰ نفر دریافتند که آن دسته از افرادی که دچار مشکلات فراموشی و نظایر آن نیستند، در عادت غذایی خود غذاهای سرشار از ویتامین ای گنجاندهاند. ویتامین ای، رادیکالهای آزاد را که محتملاً میتوانند به سلولهای مغز آسیب بزنند، مهار میکند.[10][11]
آلزایمر و گروههای خونی
گروه خونی افراد میتواند در ابتلای آنها به بیماریهای زوال شناختی مانند آلزایمر تأثیرگذار باشد. گروه خونی نقش مهمی در رشد سیستم ایمنی بدن ایفا کرده و ممکن است باعث خطر بالاتر ابتلا به زوال شناختی شود. افراد دارای گروه خونی O از ماده خاکستری بیشتری در مغز خود نسبت به گروههای خونی A ,B و AB برخوردارند که این امر به حفاظت در برابر بیماریهایی مانند آلزایمر کمک خواهد کرد. دارندگان گروه خونی O از ماده خاکستری بیشتری در بخش خلفی مخچه برخوردارند. در مقایسه، افراد با گروههای خونی A, B یا AB دارای حجم کوچکتری از ماده خاکستری در مناطق تمپورال و لیمبیک مغز از جمله هیپوکامپ چپ هستند که یکی از نخستین بخشهایی از مغز است که در اثر آلزایمر، آسیب میبیند.[12]
ارتباط هِم و هموگلوبین با آلزایمر
مشخص شده، فعالیت ایمنی سلول¬های آستروسیت به عنوان سلول هایی که آمیلوئیدهای بتا را فاگوسیت کرده و از طرفی با بیان سایتوکین ها باعث ایجاد التهاب می شوند با بیماری آلزایمر در ارتباط است. طبق مطالعات انجام شده ، فاکتورهای خونی هِم و هموگلوبین هر دو در بافت مغز افراد مبتلا به آلزایمرافزایش می یابد. تاثیر این دو فاکتور خونی بر روی آستروسیت ها به این صورت است که هِم و هموگلوبین باعث کاهش بیان سایتوکین ها می شود و در حضور این دو فاکتور میزان ورود آمیلوئیدهای بتا به درون سلول های آستروسیت کاهش پیدا می کند. از طرفی بیان گیرنده های سطح سلول آستروسیت بنام CD36 در حضور هِم و هموگلوبین نیز کاهش پیدا می کند. همچنین تاثیر هِم و هموگلوبین به آمیلوئید بتا به این صورت است که، به نسبت 2:1 برای هِم و 1:1 برای هموگلوبین متصل می شوند و بر روی مورفولوژی آمیلوئید های بتا اثر گذاشته که باعث ایجاد فرم التهابی آن می شوند. از طرفی هِم و هموگلوبین به آمیلوئید های بتا با وزن مولکولی بالا وصل می شوند. [13]
پیشگیری
هنوز راه ثابت شدهای برای جلوگیری از ابتلاء به آلزایمر وجودندارد، چراکه عامل یا عوامل اصلی این بیماری ناشناخته است. پژوهشها نشان میدهند که دیابت و هر بیماری دیگری که بر قند خون تأثیر داشته باشد، در عملکرد مغز و سیستم اعصاب اختلال وارد میکند. افزایش قند خون، سبب افزایش سطح آمیلوئید بتا در بدن بیمار میشود. آمیلوئید بتا نشان دهنده پپتیدهایی از اسید آمینه هستند که مهمترین جزء پلاکهای آمیولوئید در مغز بیماران مبتلا به آلزایمر بهشمار میآیند.[14] با اینحال یکی از بهترین راههایی که امروزه برای پیشگیری از ابتلاء به آلزایمر بیان میشود، همان راههایی است که برای کاهش خطر ابتلاء به بیماریهای قلبی بیان میشوند. کنترل موارد مهمی که بر سلامت قلب تأثیر دارد، مانند، فشارخون بالا، چاقی و دیابت ممکناست بتواند به پیشگیری از ابتلاء به آلزایمر کمک کند. افزایش تحرک و فعالیت جسمی، روابط اجتماعی و رژیم غذایی سالم میتواند، خطر ابتلاء به آلزایمر را کاهش دهد. برای پیشگیری، استفاده از ذهن مثل یادگیری دو زبان و حل جدول، معاشرت با دیگران، انتخاب زندگی سالم، کنترل کلسترول، جلوگیری از چاقی، تغذیه سالم، مصرف امگا ۳ و ماهی، ورزش کردن و توجه به فشار و قند و پیشگیری از ضربه سر کمک کننده است. بیماری لثه میتواند مشکل حافظه در بیماران آلزایمری را تشدید کند.[15]محققین دریافته اند زوال عقل در افرادی که توامان آلزایمر و بیماری لثه دارند سریعتر است. پیشرفت آلزایمر ناشی از التهاب حاصل از افزایش سلولهای ایمنی موسوم به میکروگلیا در مغز است و در صورت جلوگیری از این التهاب، پیشرفت بیماری متوقف میشود. نتایج یک تحقیق نشان میدهد توقف تولید سلولهای ایمنی جدید در مغز میتواند اختلال حافظه را که در بیماری آلزایمر مشاهده میشود، کاهش دهد.[16]
راههای تشخیص
چنانچه شخص ۴ یا ۵ نشانه زیر را داشته باشد، باید به پزشک مراجعه کند.[17]
- اختلال حافظه که فعالیتهای روزانه را دچار اشکال میکند.
- مشکلات در انجام کارهای عادی مثلاً فراموش میکند، غذا بپزد
- ضعف بیان و استفاده از کلمات نامناسب برای صحبت کردن
- گم کردن زمان مکان مثلاً روز و شب
- کاهش قضاوت (اختلال در تصمیمگیری)
- اختلال تفکر ذهنی (حسابهای مالی – ارقام)
- جابهجا گذاشتن اجسام مثلاً ساعت را روی گاز میگذارد
- تغییرات در حالت و رفتار (خنده – گریه – عصبانیت)
- انگیزه را از دست میدهند و بیتوجه میشوند
- تغییر شخصیت (منزوی شدن – عصبانی شدن)
- اخیراً محققان کالج لندن در انگلستان موفق به شناسایی پروتئینی در خون شدهاند که عامل توسعه اختلال شناختی است و بسیار قبل تر از مشاهده علایم آلزایمر، میتواند بیماری را پیشبینی کند. نتایج این پژوهش که روی بیش از یکهزار پروتئین خونی در ۲۱۲ داوطلب صورت گرفتهاست، نشان میدهد که پروتئین MAPKAPK5 در خون افرادی که به آلزایمر مبتلا میشوند، کمتر از افراد عادی است.[18]
یکی دیگر از روشهای جدید تشخیص زودهنگام آلزایمر از طریق بزاق است. با بررسی سطح هورمون استرس در بزاق میتوان احتمال آلزایمر و زوال عقل در سالمندان را تشخیص داد.[19]
- نوع فرعی زوال عقل:
- با آغاز زودرس: اگر آغاز آن در ۱۵ سالگی یا پایینتر است.
- با آغاز دیررس: اگر آغاز آن پس از ۱۵ سالگی است.
روز جهانی آلزایمر
روز جهانی آلزایمر همه ساله روز ۲۱ سپتامبر (۳۱ شهریور) به مناسبت روز جهانی آلزایمر در دنیا مراسم و همایشهای مختلفی برگزار میشود. شعار سال ۲۰۰۸ (No time to lose) بود، به این معنی که زمانی برای تلف کردن نداریم.
5 عامل از دست دادن حافظه غیر از آلزایمر[20]
از دست دادن حافظه که اغلب از آن به اشتباه به طور کلی آزایمر یاد می شود، عوامل دیگری نیز می تواند داشته باشد. ازدست دادن حافظه به علت 5 عامل زیر را نمی توان آلزایمر دانست.
- سوء مصرف الکل و مواد مخدر
- افسردگی
- بیماری پارکینسون
- بیماری هانتینگتون
- عوارض جانبی مصرف دارو
منابع
Contributeurs à Wikipédia, "Maladie d'Alzheimer," Wikipédia, l'encyclopédie libre, http://fr.wikipedia.org/w/index.php?title=Maladie_d%27Alzheimer&oldid=27089184 (Page consultée le mars 7, 2008).
- «پنج درصد از جمعیت ۶۵ ساله و بالاتر به بیماری آلزایمر متوسط تا شدید مبتلا هستند». بایگانیشده از اصلی در ۱۷ ژوئیه ۲۰۱۴. دریافتشده در ۲۰ ژوئیه ۲۰۱۱.
- «بیماری آلزایمر و دلایل ابتلا به این بیماری و درمان های آلزایمر- دکتر فارمو». دکتر فارمو | دارویی-داروسازی-پزشکی و سلامتی. ۲۰۱۹-۱۱-۰۴. دریافتشده در ۲۰۲۰-۰۱-۱۱.
- Alzheimer: Uber eine eigenartige Erkrankung der Hirnrinde.. In: Allg. Z. Psychiat. Psych. -Gerichtl. Med.. 64, Nr. 1-2, 1907, S. 146–148
- Konrad Maurer, Ulrike Maurer: Alzheimer: the life of a physician and the career of a disease. New York: Columbia University Press 2003, ISBN 0-231-11896-1
- Anthony W P F, Benjamin F, Shaoda H, Alexey G M, Garib M, Holly J G, R Anthony C, Bernardino G, Michel Goedert & Sjors H W Scheres (2017). "Cryo-EM structures of tau filaments from Alzheimer's disease". Nature, 2017. 547(7662): p. 185. doi:10.1038/nature23002. Vancouver style error: punctuation (help)
- «بیماری آلزایمر و روشهای تشخیص و کنترل آن - مازیار مهدوی فر - رادیو زمانه». بایگانیشده از اصلی در ۱۰ ژوئیه ۲۰۱۳. دریافتشده در ۷ آوریل ۲۰۱۳.
- cell.com
- داروی فشار خون عامل کاهش خطر ابتلا به آلزایمر . [خبرگزاری جمهوری اسلامی http://www.irna.ir]
- «Cern Courier». ۵۷ (۱). سوئیس: Cern. ۲۰۱۷، ژانویه/فوریه. تاریخ وارد شده در
|سال=را بررسی کنید (کمک); پارامتر|تاریخ بازیابی=نیاز به وارد کردن|پیوند=دارد (کمک) - The Best Brain Food You Should Be Eating مجله Reader's Digest
- ALZHEIMER뭩 PREVENTION بایگانیشده در ۲ نوامبر ۲۰۱۳ توسط Wayback Machine alzheimersinfo.org
- خبرگزاری انتخاب کدام گروههای خونی در معرض ابتلا به آلزایمر هستند؟ به نقل از خبرنامه تحقیقات مغز
- Sitara B Sankar1, *, Rebecca K Donegan2, *, Kajol J Shah1, Amit R R, †, Levi B W, K V (2018). "Heme and hemoglobin suppress amyloid β–mediated inflammatory activation of mouse astrocytes". Journal of Biological Chemistry, 2018. 293(29): p. 11358-11373. doi:10.1074/jbc.RA117.001050. line feed character in
|vauthors=at position 59 (help); Vancouver style error: punctuation (help) - احتمال ابتلا به آلزایمر در دیابتیها بیشتر است . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- «انجمن علمی پریودنتولوژی ایران :: مشاهده مطالب تخصصی». iap.ir. دریافتشده در ۲۰۱۹-۱۰-۱۲.
- توقف پیشرفت بیماری آلزایمر با انسداد التهاب در مغز . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- سادهترین راههای تشخیص "آلزایمر" بایگانیشده در ۱ اوت ۲۰۱۴ توسط Wayback Machine خبرگزاری انتخاب
- تشخیص آلزایمر با آزمایش خون . [خبرگزاری جمهوری اسلامی http://www.irna.ir]
- پیشبینی زوال شناختی سالمندان با بررسی بزاق . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- shadmaan.com (۲۰۲۰-۱۲-۱۳). «5 عامل اصلی غیر از آلزایمر در از دست دادن حافظه | شادمان». شادمان | اخبار سالمندان و بازنشستگان. دریافتشده در ۲۰۲۰-۱۲-۱۵.
| در ویکیانبار پروندههایی دربارهٔ بیماری آلزایمر موجود است. |