اچآیوی
ویروس نقص ایمنی انسانی (به انگلیسی: Human immunodeficiency virus) یا اچآیوی (HIV)، نوعی ویروس آهستهگستر (ویروس پسگرد با سرعت تکثیر پایین) و عامل بیماری ایدز است.[1][2] HIV به یاختههای حیاتی دستگاه ایمنی بدن از جمله لنفوسیت تی کمککننده (CD4+ T)، درشتخوارها و یاختههای دندانهای حمله میکند.[3] اچآیوی ویروسی است که با مختل کردن کارکرد و ویران کردن گونهای از یاختههای مسؤول هماهنگی ایمنی منجر به نقص دستگاه ایمنی بدن انسان میشود که به آن ایدز میگویند. از زمان ورود HIV به بدن تا بروز ایدز ممکن است بین ۶ ماه تا ده سال یا بیشتر به درازا بکشد در این مدت گرچه فرد به ظاهر تندرست به نظر میرسد، ولی ممکن است ویروس از او به دیگران سرایت کند.
| ویروس نقص ایمنی اکتسابی | |
|---|---|
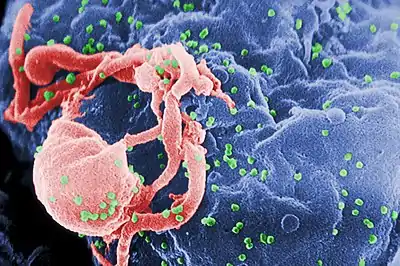 | |
| تصویر ریزنگاریشده از ویروس HIV-1 (به رنگ سبز) که به صورت برجستگی از لنفوسیت مشخص شدهاست. | |
| طبقهبندی ویروس | |
| Group: | Group VI (ویروس پسگرد) |
| تیره: | ویروس پسگرد |
| سرده: | ویروس آهستهگستر |
| گونهها | |
| |
HIV عمدتاً از طریق آمیزش جنسی محافظت نشده (بدون کاندوم مانند مقعدی و حتی دهانی)، انتقال خون آلوده و سرسوزن آلوده و از مادر به فرزند در طول بارداری، زایمان یا شیردهی منتقل میگردد. بعضی از مایعات بدن مانند بزاق و اشک قادر به انتقال HIV نیستند.[4] پیشگیری از HIV، عمدتاً از طریق آمیزش جنسی امن و برنامه تعویض سرنگ، راه حلی برای جلوگیری از گسترش این بیماری محسوب میشوند. هیچ گونه درمان یا واکسن وجود ندارد؛ اگر چه درمان ضدویروسی میتواند باعث کاهش دوره بیماری و امید به زندگی نزدیک به طبیعی گردد. با وجود این که درمان ضدویروسی خطر مرگ و عوارض ناشی از این بیماری را کاهش میدهد، اما این داروها گرانقیمت هستند و ممکن است با عوارض جانبی همراه باشند.
تحقیقات ژنتیکی نشان میدهد که HIV در اصل متعلق به غرب آفریقا و در اوایل قرن بیستم بودهاست.[5] در دهه ۹۰ میلادی میلتون ویلیام کوپر به افشاگریهایی در رابطه با این ویروس پرداخته بود و سران ایالات متحده آمریکا گفتههای وی را تئوری توطئه نام نهادند.[6]
علائم و نشانهها
ابتلا به HIV دارای سه مرحله اصلی است: ابتلای حاد، دوره نهفتگی و ایدز.[7][8]
ابتلای حاد
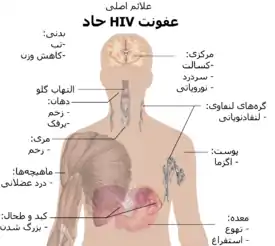
دورهٔ نخست ابتلا به HIV، عفونت حاد HIV یا نشانگان حاد ویروسی نامیده میشود.[7][9] بسیاری از افراد ۲ تا ۴ هفته پس از مواجهه با این ویروس، دچار نشانهٔ بیماریهایی مانند آنفلوانزا یا [[ایجاد تودههای کوچک یا بزرگ حاوی پروتئین و گلبول سفید و اجزاء لنفی و مایعات میان بافتی آلودهٔ ویروسی شده مُرده در بافتهای نرم و مخاطی و در حالت شدید مشاهده تومور]] در فرد آلوده میشوند و در بسیاری از افراد هم هیچ نشانهٔ قابل توجهی در آنها دیده نمیشود و گاهی تا آخر عمر حامل این ویروس و مقاوم به آن و خود ایمنی به ویروس تا پایان زندگی بوده اما عامل سرایت دهنده و پخش و اپیدمی آن بهطور پنهان به بقیه هستند.[10][11] علائم در ۴۰ تا ۹۰ درصد موارد رخ میدهد و معمولاً شامل تب، بزرگی گرههای لنفی، گلودرد، بثورات پوستی، سردرد و یا زخم دهان و اندام تناسلی میشود.[9][11] بثورات پوستی که در ۲۰ تا ۵۰ درصد موارد رخ میدهد، خود را بر روی بالاتنه نشان میدهد و به شکل لکههای با لبهٔ صاف است.[12] همچنین در این مرحله برخی از افراد دچار عفونتهای فرصتطلب میشوند.[9] ممکن است در دستگاه گوارش علائمی مانند تهوع، استفراغ یا اسهال رخ دهد، و همچنین علائم عصبی نوروپاتی محیطی یا سندرم گیلن باره دیده شود.[11] طول دورهٔ این علائم متفاوت است، اما معمولاً یک تا دو هفته میباشد.[11]
با توجه به اینکه این علائم اختصاصی نیستند، اغلب به عنوان نشانههایی از ابتلا به HIV شناخته نمیشوند. حتی پزشک خانواده یا متخصص در یک بیمارستان محلی ممکن است آن را با بیماریهای شایع عفونی دیگر به دلیل نشانههای مشترک اشتباه بگیرند؛ بنابراین، توصیه میشود در بیمارانی که دارای تب توجیهناپذیر هستند ، تذکر داده شود که ممکن است دارای HIV باشند و خطر ابتلا به این ویروس در آنها وجود دارد.[11]
دوره نهفتگی
پس از علائم اولیه، بیمار وارد مرحلهای به نام دوره نهفتگی یا HIV بینشانه یا HIV مزمن میشود.[8] این مرحله از HIV میتواند بدون هیچ گونه درمانی از حدود سه سال[13] تا بیش از ۲۰ سال[14] (بهطور متوسط حدود هشت سال)[15] به درازا بینجامد. اگرچه معمولاً در ابتدای بیماری هیچ علائمی مشاهده نمیشود یا علامتهای خیلی کمی دیده میشود، اما در نزدیکی پایان این مرحله بسیاری از افراد دچار تب، کاهش وزن، مشکلات گوارشی و دردهای عضلانی میشوند.[8] همچنین ۵۰ تا ۷۰ درصد از افراد دچار بزرگی گرههای لنفی ماندگار میشوند، بهطوریکه چند گروه از گرههای لنفی (به جز در کشاله ران) به مدت بیش از سه تا شش ماه بدون هیچ درد و توجیهی بزرگ میشود.[7]
اگر چه بسیاری از مبتلایان به HIV-1 در صورت عدم درمان نهایتاً به مرحله ایدز میرسند، ولی درصد کمی از آنها (حدود ۵٪) سطح بالای سلولهای CD4+ T خود را بدون هیچ درمان ضدویروسی تا بیش از ۵ سال حفظ میکنند.[11][16] این افراد به عنوان مهارکنندگان HIV طبقهبندی میشوند، و آنهایی که سالها مقدار کم یا غیر محسوسی از ویروس را بدون درمان ضدویروسی در بدن خود نگه میدارند به عنوان «مهارکنندگان ممتاز» یا «سرکوبگران ممتاز» شناخته میشوند.[16] این پدیده ممکن است به کشف واکسن یا درمان قطعی اچآیوی کمک کند.
سندرم نقص ایمنی اکتسابی
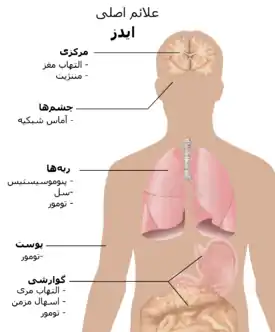
سندرم نقص ایمنی اکتسابی (ایدز) زمانی معنی پیدا میکند که شمار سلولهای CD4+ T به کمتر از ۲۰۰ سلول در هر میکرولیتر برسد یا بیماریهای مشخص مربوط به HIV رخ دهد.[11] در غیاب درمان، حدود نیمی از افراد دچار اچآیوی در عرض ده سال مبتلا به ایدز میشوند.[11] رایجترین وضعیتهایی که هشداری بر وجود ایدز هستند التهاب ریه ناشی از پنوموسیستیس (۴۰٪)، نزاری به شکل نشانگان لاغری ناشی از اچآیوی (۲۰٪) و برفک سرخنای میباشند. دیگر علامت شایع عفونتهای دستگاه تنفسی به شکل تکراری است.[11]
عفونت فرصتطلب ممکن است توسط باکتری، ویروس، قارچ و انگل به وجود بیاید که در حالت عادی توسط دستگاه ایمنی بدن مهار میشود.[17] اینکه کدام عفونت رخ بدهد تا حدودی به این بستگی دارد چه عواملی در محیط اطراف فرد قرار دارد.[11] این عفونتها تقریباً میتواند هر دستگاهی از بدن را تحت تأثیر قرار دهند.[18]
افراد مبتلا به ایدز خطر دچار شدن به ویروسهای سرطانزای مختلفی را دارند از جمله: سارکوم کاپوزی، لنفوم، لنفوم دستگاه عصبی مرکزی، و سرطان گردن رحم.[12] سارکوم کاپوزی، شایعترین سرطانی است که در ۱۰ تا ۲۰ درصد از افراد دچار HIV اتفاق میافتد.[19] پس از آن لنفوم شایعترین سرطان است و علت مرگ نزدیک به ۱۶ درصد از افراد مبتلا به ایدز میباشد و جزء نشانههای اولیه ۳ تا ۴ درصد از آنها است. هر دوی این سرطانها با ویروس هرپس ۸ انسانی همراه هستند.[19] خیلی اوقات مبتلایان به ایدز به دلیل ارتباطی که با ویروس پاپیلوم انسانی (HPV) دارد، دچار سرطان گردن رحم میشوند.[19]
علاوه بر این، آنها بهطور مکرر دچار علائمی مانند تب طولانی، تعریق شبانه، تورم غدد لنفاوی، لرز، ضعف، و کاهش وزن میشوند.[20] اسهال یکی دیگر از علائم شایعی است که ۹۰٪ از افراد مبتلا به ایدز دچار آن میشوند.[21]
ویروسشناسی
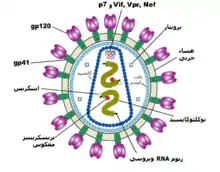
اچآیوی، یا ویروس [نقص] ایمنی و دفاع آدمی، ویروسی دارای پوشش، علاوه بر کپسید، است که اندازهای برابر با ۱۲۵ نانومتر دارد و برای همانندسازی در گلبولهای سفید دستگاه ایمنی بدن انسان مستقر میشود.[22]
HIV عامل طیفی از بیماری است که با نام ایدز شناخته میشود. HIV نوعی ویروس پسگرد است که عمدتاً به اجزای دستگاه ایمنی انسان مانند سلولهای CD4+ T، درشتخوارها و سلولهای دندریتیک سرایت میکند و به صورت مستقیم یا غیرمستقیم سلولهای CD4+ T را از بین میبرد.[23]
HIV عضوی از سرده ویروس آهستهگستر،[24] و بخشی از خانواده ویروس پسگرد است.[25] ویروسهای آهستهگستر خصوصیات ریختشناسی و زیستشناسی مشترک بسیاری دارند. گونههای بسیاری از پستانداران مبتلا به ویروس آهستهگستر میشوند، که مشخصاً دلیل بیماریهای طولانیمدت با دوره کمون طولانی هستند.[26] ویروسهای آهستهگستر به شکل تک رشته، حس مثبت، ویروس آرانای احاطه شده منتقل میشوند. پس از ورود به سلول هدف، ویروس ژنوم آرانای توسط آنزیم وارونویس ویروسی که همراه با ژنوم ویروسی در ذرات ویروسی منتقل شده، به یک دیانای دو رشته استاندارد تبدیل میشود. سپس DNA ویروسی وارد هسته سلول میشود و کل DNA های سلولی را توسط اینتگراز ویروسی فرا میگیرد.[27] وقتی فرا گرفته شد، ویروس ممکن است پنهان شود و این به ویروس و سلولهای میزبانش این امکان را میدهد تا توسط دستگاه ایمنی بدنی شناسایی نشوند.[28] همچنین این ویروس میتواند تکثیر شود و ژنومهای RNA جدیدی تولید کند و پروتئینهای ویروسی که توسط سلول به عنوان هستههای سلولی جدید معرفی شدهاند را در چرخهای از نو پدید آورد.[29]
دو نوع ایدز تاکنون مشخص شدهاست: HIV-1 و HIV-2.
HIV-1 گونهای از ویروسی بود که زودتر شناخته شد (و در ابتدا به عنوان LAV یا HTLV-III شناخته میشد). این گونهای است که مهاجمتر و واگیرتر است.[30] واگیری کمتر HIV-2 در مقایسه با HIV-1 بدین معناست که افرادی که با HIV-1 مواجهه دارند کمتر ممکن است دچار HIV-2 بشوند. از آنجا که HIV-2 توانایی سرایت کمی دارد، ابتلای به آن عمدتاً محدود به آفریقای غربی است.[31]
نتیجهٔ یک پژوهش علمی عمده و معتبر از سوی گروهی از پژوهشگران دانشگاه آکسفورد انگلستان نشان میدهد که ویروس اچآیوی در روند فرگشتی (تکاملی) خود، دچار دگرش و تحول شده و در مقایسه با گذشته، از میزان خطر، مرگبار بودن و مسری بودن آن کاسته شدهاست. بر اساس این مطالعه، ویروس اچآیوی در حال هماهنگی و تطبیق خود با دستگاه ایمنی بدن انسان بوده و درجهٔ خطر آن در حال کاهش است. بر اساس گزارش منتشر شده از این پژوهش، اکنون فاصلهٔ زمانی بین آلودگی به ویروس و بروز بیماری ایدز بیشتر شدهاست و ممکن است تغییرات تکاملی ایجاد شده در ویروس اچآیوی به نتیجهبخشی اقدامات و تلاشها برای مهار همهگیری گسترده و گسترش ابتلاء به بیماری ایدز یاری رساند. به باور برخی ویروسشناسان، امکان دارد در ادامهٔ روند فرگشتی ویروس اچآیوی، در نهایت، این ویروس بیخطر شود. پیامد تلاش دائمی ویروس برای تغییر به منظور پنهان ماندن در برابر سامانهٔ ایمنی بدن انسان، کاهش توانایی تکثیر ویروس است. از سوی دیگر، بنا بر یافتههای این پژوهش، داروهای ضد ویروس در تضعیف و تحلیل ویروس اچآیوی دارای سهم شایانی هستند؛ چون این داروها ابتدا به نمونههای قویتر و پرخطر حمله کرده و آنها را از بین میبرند، باعث میشوند در فرایند انتخاب طبیعی (در این مورد، صفت مطلوب برای زنده ماندن، ضعیف بودن است چرا که داروها، ویروسهای قویتر و بیماریزاتر را زودتر مورد حمله قرار میدهند)، ویروسهای ضعیفتر و ملایمتر باقی بمانند و تکثیر شوند. البته اکنون، ضعیفترین نمونههای ویروسی هم کاملاً خطرناک هستند.[32]
تشخیص بیماری

بیماری ایدز و HIV با توجه بروز علایم و نشانههای بیمار، از طریق آزمایش و بررسی آن در آزمایشگاه تشخیص داده میشود.[9] آزمایش HIV به همه کسانی که در معرض خطر قرار دارند توصیه میشود، که شامل هر فرد مبتلا به هر نوع بیماری آمیزشی است میشود.[12] در بسیاری از مناطق دنیا، یک سوم حاملان HIV زمانی متوجه میشوند که در مرحله پیشرفتهای از این بیماری هستند و AIDS یا نقص شدید دستگاه ایمنی آشکار میشود.[12]
آزمایش HIV
در اکثر افراد دچار HIV، در طول سه تا دوازده هفته پس از بیماری اولیه، یک سری پادتنهای ویژه ایجاد میگردد.[11] تشخیص اولیهٔ HIV قبل از تولید آنتیبادی، با اندازهگیری اچآیوی-آرانای یا آنتیژن P24 انجام میشود.[11] نتایج مثبت به دست آمده توسط آنتیبادی یا آزمایش واکنش زنجیرهای پلیمراز (PCR)، با PCR یا با آزمایش آنتیبادی دیگری تأیید میشوند.[9]
آزمایش آنتیبادی در کودکان کمتر از ۱۸ ماه، به دلیل وجود مداوم آنتیبادیهای مادری معمولاً نتیجه درستی نمیدهند.[33] بنابراین ابتلا به HIV تنها توسط آزمایش PCR مربوط به HIV RNA یا DNA یا از طریق آزمایش ایدز آنتیبادی P24 قابل تشخیص است.[9] در اکثر نقاط دنیا دسترسی به آزمایش PCR قابل اعتماد وجود ندارد و افراد باید تا زمانی صبر کنند که علائم پیشرفت کند یا سن کودک به اندازه کافی باشد و آزمایش آنتیبادی درستی نتیجه دهد.[33] در کشورهای جنوب صحرای آفریقا در بین سالهای ۲۰۰۷ و ۲۰۰۹، بین ۳۰ تا ۷۰ درصد مردم، از وضعیت HIV خود آگاه بودهاند.[34] در سال ۲۰۰۹، بین ۴ تا ۴۲ درصد مردم مورد آزمایش قرار گرفتند.[34] این ارقام نشان دهنده افزایش قابل توجهی نسبت به ده سال گذشتهاست.[34]
طبقهبندی ابتلا به HIV
از دو طبقهبندی اصلی برای مرحلهبندی HIV و ایدز استفاده میشود، یکی توسط سازمان جهانی بهداشت[9] (WHO) و دیگر توسط مرکز کنترل بیماریها[35] (CDC). برنامه CDC بیشتر در کشورهای توسعهیافتهاستفاده میشود. از آنجا که برنامه WHO احتیاجی به آزمایش ندارد، بیشتر مناسب کشورهای در حال توسعهاست که با کمبود لوازم روبرو هستند. علیرغم تفاوتهای که این دو با هم دارند، اما میتواند هر دوی آنها را از لحاظ آماری مقایسه نمود.[7][9][35]
سازمان بهداشت جهانی برای اولین بار در سال ۱۹۸۶ تعریفی برای ایدز ارائه نمود.[9] از آن زمان به بعد، مرحلهبندی WHO برای چندین بار تغییر کرده و گسترش یافت، که نسخهٔ اخیر آن که در سال ۲۰۰۷ منتشر شدهاست.[9] ردهبندی مراحل تعیین شده توسط WHO به شکل زیر است:
- ابتلای اولیه به HIV: که یا بدون علامت است یا همراه با سندرم حاد ویروسی است.[9]
- مرحله ۱: ابتلا به HIV بدون علامت با تعداد سلولهای CD4 بیش از ۵۰۰ در هر میکرولیتر. ممکن است شامل بزرگ شدن گرههای لنفاوی نیز باشد.[9]
- مرحله ۲: علائم خفیف که ممکن است تغییر جزئی غشاء مخاطی و عود عفونت دستگاه تنفسی فوقانی را شامل شود و تعداد سلولهای CD4 کمتر از ۵۰۰ در هر میکرولیتر است.[9]
- مرحله ۳: علائم پیشرفته که ممکن است شامل اسهال مزمن و غیرعادی برای بیش از یک ماه شود، به همراه عفونتهای باکتریایی شدید از جمله سل ریوی و همچنین تعداد سلولهای CD4 کمتر از ۳۵۰ در هر میکرولیتر.[9]
- مرحله ۴ یا ایدز: علائم شدیدی شامل انگل گوشتخوار و کیست ساز در بافت مغز و ماهیچه و اکثر بافتهای مغز، ایجاد پوششهای سفید و بافتهای قارچی برفک مانند و لایههای سفید حاصل قارچ کاندیدیا در دهان مری، نای، نایژه یا شش و سرطان عروق بدن باضایعاتی تبخال مانند غیر برجسته قابل تشخیص و مشاهده قرمز و قهوه ای در روی پوست بیرونی . تعداد سلولهای CD4 به کمتر از ۲۰۰ در هر میکرولیتر میرسد.[9]
مرکز کنترل و پیشگیری بیماری آمریکا نیز ایجاد یک سیستم طبقهبندی برای HIV ارائه نموده و آخرین بار آن را در سال ۲۰۰۸ به روزرسانی کردهاست.[35] در این سیستم ابتلا به HIV بر اساس شمارش CD4 و علائم بالینی میباشد،[35] بیماری را در سه مرحله توصیف میکند:
- مرحله ۱: تعداد سلولهای CD4 بیشتر یا مساوی ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۲: تعداد سلولهای CD4 بین ۲۰۰ تا ۴۹۹ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۳: تعداد سلولهای CD4 کمتر از ۲۰۰ در هر میکرولیتر یا وجود علائمی از ایدز
- نامعلوم: اگر اطلاعات کافی برای هر یک از مراحل فوق در دسترس باشد
اگر پس از درمان، تعداد سلولهای CD4 خون به بیش از ۲۰۰ در هر میکرولیتر افزایش یابد یا بیماری دیگری به جز ایدز احتمال رود یا حتی درمان گردد هنوز هم تشخیص اینکه بیماری ایدز بوده باشد پابرجا خواهد بود.[7]
تاریخچه
کشف
ایدز اولین بار در سال ۱۹۸۱ در آمریکا مشاهده شد.[19] اولین مواردی که مشاهده شد در بین معتادان تزریقی و همچنین همجنسگرایان مرد قرار داشت که به دلیل نامعلومی سیستم دفاعی بدن آنها ضعیف شده بود و علایم بیماری التهاب ریه پنوموسیستیس کارینی (PCP) در آنها مشاهده میشد که این بیماری در افرادی دیده میشود که سیستم دفاعی بدنی ضعیفی دارند.[36] سپس نوعی سرطان پوست نادر با نام کاپوسی سارکوما (KS) در میان مردان همجنسگرای گزارش شد.[37][38] موارد بیشتری از بیماری PCP و KS مشاهده شد و این زنگ خطری برای مرکز پیشگیری و کنترل بیماری بود و گروهی از طرف این مرکز برای بررسی این واقعه تشکیل شد.[39]
در آن اوایل مرکز کنترل بیماری هنوز نامی رسمی برای این بیماری انتخاب نکرده بود و معمولاً نام این بیماری را با بیماری که مریض با آن در ارتباط بود بیان میکردند، برای مثال تا قبل از کشف HIV از نام لنفادنوپاتی که بیماری عامل بود استفاده میشد.[40][41] همچنین اسامی مانند سارکوم کاپوزی یا عفونت فرصتطلب نامهایی بودهاند که توسط این گروه در سال ۱۹۸۱ استفاده میشدهاست.[42] از آنجا که این سندرم در هائیتی، همجنسگرایان، هموفیلی، و مصرفکنندگان هروئین ظاهر شده بود، مرکز کنترل بیماری عبارت «بیماری ۴ه» را ابداع کرد.[43] در مطبوعات از اصطلاح «گرید» که مخفف معادل انگلیسی عبارت نقص ایمنی مرتبط با همجنسگرایی استفاده میشد.[44] اما بعداً که معلوم شد که ایدز فقط محدود به جامعه همجنسگرایان نمیشود،[42] این نتیجه گرفته شد که استفاده از اصطلاح گرید گمراهکننده است و واژه ایدز در همایشی در ژوئیه ۱۹۸۲ معرفی شد.[45] از سپتامبر ۱۹۸۲، مرکز کنترل بیماری از واژه ایدز برای نسبت دادن این بیماری استفاده کرد.[46]

در سال ۱۹۸۳، دو گروه تحقیقاتی جداگانه به رهبری رابرت گالو و لوک مونتانیه بهطور مستقل اعلام کردند که یک ویروس پسگرد جدید بیماران مبتلا به ایدز را مبتلا کرده، و یافتههایشان را در همان شماره از مجله ساینس منتشر کردند.[47][48] گلو ادعا کرد که ویروسی که گروه خود از یک بیمار مبتلا به ایدز برای تحقیقات جدا کرده بود از نظر شکل کاملاً مشابه سایر ویروسهای تی-لنفوتروپیک انسانی (HTLV) بوده که گروهش در همان ابتدا جدا کرده بود. گروه گالو نام آن ویروس را HTLV-III گذاشتند. در همان زمان، گروه مونتانیه ویروسی از یک بیمار مبتلا به تورم غدد لنفاوی گردن و ضعف فیزیکی که دو مشخصه از علائم ایدز است، جدا کرده بود. تناقض در گرازشهای گروه گالو و مونتانیه و همکارانشان نشان میداد که هسته پروتئینهای این ویروس از لحاظ ایمنیشناسی، کاملاً متفاوت از HTLV-I است. گروه مونتانیه اسم ویروسی که جدا کرده بودند را ویروس مرتبط با لنفادنوپاتی (LAV) گذاشتند.[39] از آنجا که مشخص شد هر دوی این ویروس یکسان هستند، در سال ۱۹۸۶ LAV و HTLV-III هر دو به HIV تغییر نام دادند.[49]
منشأ
به نظر میرسد که هر دو ویروس HIV-1 و HIV-2 در اصل متعلق به نخستیسانان مرکز آفریقا بوده و در اوایل قرن بیست به بدن انسان منتقل شدهاند.[5] به نظر میآید که ویروس HIV-1 در اصل متعلق به مناطق جنوبی کامرون و تکامل یافتهٔ ویروس نقص ایمنی میمونی (SIV) که در میان شمپانزههای وحشی شیوع دارد، بودهاست.[50][51] همچنین ویروس HIV-2 تکامل یافتهٔ ویروس SIV میان گونهای میمون به نام منگابی دودی بودهاست که در غرب آفریقا (از جنوب سنگال تا غرب ساحل عاج) زندگی میکردهاست.[31] پخبینیانی مانند میمون شب نسبت به ویروس HIV-1 مقاوم هستند و این احتمالاً به دلیل یک نوع ژن پیوندی دو گونه مقاوم ویروس در آنها میباشد.[52] به نظر میرسد که HIV-1 حداقل در سه مرحله جهش داشته و به سه گروه از ویروسهای M, N و O جهش یافته است.[53]
مدارکی موجود است که نشان میدهد انسانهایی که در شکار یا فروش حیوانات دخالت داشتند دچار ویروس SIV شدهاند.[54] اگرچه SIV ویروس ضعیفی است که سیستم دفاعی بدن انسان با آن مقابله میکند و بیش از چند هفته در بدن انسان باقی نمیماند، اما انتقال سریع و متوالی آن بین انسانهای مختلف زمان کافی را به این ویروس برای تبدیل آن به HIV میدهد.[55] علاوه بر این، با توجه به نرخ پایین انتقال فرد به فرد بیماری، SIV فقط میتواند از طریق تعداد زیادی افراد در معرض خطر پخش شود که باور بر این است که تا قبل از قرن بیستم چنین جمعیتی وجود نداشتهاست.
راههای انتقال پرخطر بسته به زمان انتقال از حیوان به انسان به ویروس این امکان را میدهد که با انسان سازگار شود و در بین جامعه پخش گردد. مطالعات ژنتیکی ویروسی نشان میدهد که اجداد گروه HIV-1 M به سال ۱۹۱۰ بر میگردد.[56] افرادی که مدعی هستند که HIV در این تاریخ شیوع یافته، آن را به ظهور و رشد استعمار و شهرهای مستعمره آفریقایی ارتباط میدهند که منجر به تغییرات اجتماعی شامل بی بند و باری جنسی، گسترش تنفروشی، و بیماریهای زخم تناسلی (مانند سیفیلیس) در شهرهای مستعمره شدهاست.[57] در حالی که میزان انتقال HIV در رابطه جنسی واژینال در حالت عادی کم است، اما اگر یکی از طرفین مبتلا به یک بیماری آمیزشی عفونی باشد، احتمال انتقال هم افزایش خواهد یافت. در اوایل دهه ۱۹۰۰ شهرهای مستعمره به دلیل شیوع بالای تنفروشی و بیماریهای زخم تناسلی معروف بودند و به نظر میرسید که در سال ۱۹۲۸ به اندازه ۴۵٪ زنان ساکن کینشاسا شرقی تنفروشی میکردند و در سال ۱۹۳۳ در حدود ۱۵٪ ساکنان همان شهر به بیماری سیفیلیس مبتلا شده بودند.[57]
از نگاهی دیگر مشاهده میشود که اعمال خطرناک پزشکی در آفریقا در طول جنگ جهانی دوم، مانند استریل نبودن، استفاده مجدد از سرنگها در واکسنهای عمومی، آنتیبیوتیک و آنتیمالاریا از عواملی بودهاند که باعث پخش ویروس و سازگاری آن با انسانها شدهاست.[55][58][59]
بررسی نمونههای خونی به جا مانده از گذشته نشان میدهد که اولین انسانی که مبتلا به ایدز شده در سال ۱۹۵۹ در کنگو جان خود از دست دادهاست. این نخستین و قدیمیترین مورد مرگ شناخته شده در اثر ابتلا به این بیماری محسوب میشود.[60] همچنین ممکن است ویروس اچآیوی نخستین بار در سال ۱۹۶۶ به آمریکا رسیده باشد،[61] ولی عمده شیوع HIV مربوط به خارج از صحرای آفریقا (و همچنین آمریکا) میشود و میتوان آن را به فردی ناشناس و مبتلا به ایدز نسبت داد که در هائیتی زندگی میکردهاست و با ورود به آمریکا در سال ۱۹۶۹ به آن شیوع بخشیدهاست.[62] پس از آن به سرعت بین گروههای پرخطر (در ابتدا در بین مردان همجنسگرا) پخش شد. در سال ۱۹۷۸ شیوع ویروس HIV-1 در بین مردان همجنسگرای ساکن نیویورک و سان فرانسیسکو، ۵ درصد تخمین زده شد که بیانگر این است که هزاران نفر در کشور مبتلاً به ایدز بودهاند.[62]
پانویس
- Weiss RA (1993). "How does HIV cause AIDS?". Science (5112): 1273–9. Bibcode:1993Sci...260.1273W. doi:10.1126/science.8493571. PMID 8493571.
|فصل=ignored (help) - Douek DC, Roederer M, Koup RA (2009). "Emerging Concepts in the Immunopathogenesis of AIDS". Annu. Rev. Med.: 471–84. doi:10.1146/annurev.med.60.041807.123549. PMC 2716400. PMID 18947296.
|فصل=ignored (help) - Cunningham AL, Donaghy H, Harman AN, Kim M, Turville SG (August 2010). "Manipulation of dendritic cell function by viruses". Curr. Opin. Microbiol. 13 (4): 524&ndash, 9. doi:10.1016/j.mib.2010.06.002. PMID 20598938.
- "HIV and Its Transmission". Centers for Disease Control and Prevention. 2003. Archived from the original on 4 February 2005. Retrieved May 23, 2006.
- Sharp, PM; Hahn, BH (2011 Sep). "Origins of HIV and the AIDS Pandemic". Cold Spring Harbor perspectives in medicine. ۱ (۱): a006841. doi:10.1101/cshperspect.a006841. PMC 3234451. PMID 22229120. Check date values in:
|تاریخ=(help) - "Bill Cooper interview CNN Uncut original". Event occurs at 39:00. Retrieved June 13, 2015.
- Mandell, Bennett, and Dolan (2010). Chapter 121.
- "Stages of HIV". U.S. Department of Health & Human Services. Dec 2010. Archived from the original on 13 May 2012. Retrieved 13 June 2012.
- WHO case definitions of HIV for surveillance and revised clinical staging and immunological classification of HIV-related disease in adults and children (PDF). Geneva: World Health Organization. 2007. p. 6–16. ISBN 978-92-4-159562-9.
- Diseases and disorders. Tarrytown, NY: Marshall Cavendish. 2008. p. 25. ISBN 978-0-7614-7771-6.
- Mandell, Bennett, and Dolan (2010). Chapter 118.
- Vogel, M (2010 Jul). "The treatment of patients with HIV". Deutsches Ärzteblatt international. ۲۸–۲۹: ۵۰۷–۱۵. doi:10.3238/arztebl.2010.0507. PMC 2915483. PMID 20703338. Check date values in:
|تاریخ=(help);|فصل=ignored (help) - Evian, Clive (2006). Primary HIV/AIDS care: a practical guide for primary health care personnel in a clinical and supportive setting (Updated 4th ed.). Houghton [South Africa]: Jacana. p. 29. ISBN 978-1-77009-198-6.
- Radiology of AIDS. Berlin [u.a.]: Springer. 2001. p. 19. ISBN 978-3-540-66510-6.
|first1=missing|last1=in Authors list (help) - Elliott, Tom (2012). Lecture Notes: Medical Microbiology and Infection. John Wiley & Sons. p. 273. ISBN 978-1-118-37226-5.
- Blankson, JN (2010 Mar). "Control of HIV-1 replication in elite suppressors". Discovery medicine. 9 (46): 261–6. PMID 20350494. Check date values in:
|تاریخ=(help) - Holmes CB, Losina E, Walensky RP, Yazdanpanah Y, Freedberg KA (2003). "Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa". Clin. Infect. Dis. 36 (5): 656–662. doi:10.1086/367655. PMID 12594648.
- Chu, C; Selwyn, PA (2011-02-15). "Complications of HIV infection: a systems-based approach". American family physician. 83 (4): 395–406. PMID 21322514.
- Mandell, Bennett, and Dolan (2010). Chapter 169.
- "AIDS". MedlinePlus. A.D.A.M. Retrieved 14 June 2012.
- Sestak K (2005). "Chronic diarrhea and AIDS: insights into studies with non-human primates". Curr. HIV Res. 3 (3): 199–205. doi:10.2174/1570162054368084. PMID 16022653.
- زیستشناسی؛ دورهٔ پیشدانشگاهی؛ رشتهٔ علوم تجربی؛ محمد کرامالدینی و دیگران…؛ سازمان پژوهش و برنامهریزی آموزشی، دفتر تألیف کتابهای درسی ابتدایی و متوسطهٔ نظری؛ چاپ دوازدهم؛ ۱۳۹۲. فصل نهم؛ ص ۲۱۰.
- Alimonti JB, Ball TB, Fowke KR (2003). "Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS". J. Gen. Virol. 84 (7): 1649–1661. doi:10.1099/vir.0.19110-0. PMID 12810858.
- International Committee on Taxonomy of Viruses (2002). "61.0.6. Lentivirus". National Institutes of Health. Archived from the original on 18 April 2006. Retrieved 2012-06-25.
- International Committee on Taxonomy of Viruses (2002). "61. Retroviridae". National Institutes of Health. Archived from the original on 29 June 2006. Retrieved 16 March 2013. More than one of
|تاریخ دسترسی=and|accessdate=specified (help) - Lévy, J. A. (1993). "HIV pathogenesis and long-term survival". AIDS. 7 (11): 1401–10. doi:10.1097/00002030-199311000-00001. PMID 8280406.
- Smith, Johanna A. ; Daniel, René (Division of Infectious Diseases, Center for Human Virology, Thomas Jefferson University, Philadelphia) (2006). "Following the path of the virus: the exploitation of host DNA repair mechanisms by retroviruses". ACS Chem Biol. 1 (4): 217–26. doi:10.1021/cb600131q. PMID 17163676.
- Martínez, edited by Miguel Angel (2010). RNA interference and viruses: current innovations and future trends. Norfolk: Caister Academic Press. p. 73. ISBN 9781904455561.
- Immunology, infection, and immunity. Washington, D.C.: ASM Press. 2004. p. 550. ISBN 9781555812461.
|first1=missing|last1=in Authors list (help) - Gilbert, PB; McKeague, IW; Eisen, G; Mullins, C; Guéye-Ndiaye, A; Mboup, S; Kanki, PJ (28 February 2003). "Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal". Statistics in Medicine. 22 (4): 573–593. doi:10.1002/sim.1342. PMID 12590415.
- Reeves, J. D. and Doms, R. W (2002). "Human Immunodeficiency Virus Type 2". J. Gen. Virol. 83 (Pt 6): 1253–65. doi:10.1099/vir.0.18253-0. PMID 12029140.
- ویروس اچ آی وی در روند تکامل 'خفیف تر شدهاست' - BBC Persian. بیبیسی فارسی. جیمز گالاگر، سردبیر اخبار بهداشتی، بیبیسی نیوز. بازبینی شده در تاریخ ۲ دسامبر ۲۰۱۴. پیوند پایدار (دائمی)
- Kellerman, S; Essajee, S (2010 Jul 20). "HIV testing for children in resource-limited settings: what are we waiting for?". PLoS medicine. 7 (7): e1000285. doi:10.1371/journal.pmed.1000285. PMC 2907270. PMID 20652012. Check date values in:
|تاریخ=(help) - UNAIDS 2011 pg. 70–80
- Schneider, E; Whitmore, S; Glynn, KM; Dominguez, K; Mitsch, A; McKenna, MT; Centers for Disease Control and Prevention, (CDC) (2008-12-05). "Revised surveillance case definitions for HIV infection among adults, adolescents, and children aged <18 months and for HIV infection and AIDS among children aged 18 months to <13 years--United States, 2008". MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports / Centers for Disease Control. 57 (RR–10): 1–12. PMID 19052530.
- Gottlieb MS (2006). "Pneumocystis pneumonia—Los Angeles. 1981". Am J Public Health. 96 (6): 980–1; discussion 982–3. PMC 1470612. PMID 16714472. Archived from the original on April 22, 2009. Retrieved March 31, 2009.
- Friedman-Kien AE (1981). "Disseminated Kaposi's sarcoma syndrome in young homosexual men". J. Am. Acad. Dermatol. 5 (4): 468–71. doi:10.1016/S0190-9622(81)80010-2. PMID 7287964.
- Hymes KB; Cheung T; Greene JB; et al. (1981). "Kaposi's sarcoma in homosexual men-a report of eight cases". Lancet. 2 (8247): 598–600. PMID 6116083. Unknown parameter
|نویسنده-separator=ignored (help) - Basavapathruni, A; Anderson, KS (2007). "Reverse transcription of the HIV-1 pandemic". The FASEB Journal. 21 (14): 3795–3808. doi:10.1096/fj.07-8697rev. PMID 17639073.
- Centers for Disease Control (CDC) (1982). "Persistent, generalized lymphadenopathy among homosexual males". MMWR Morb Mortal Wkly Rep. 31 (19): 249–251. PMID 6808340. Retrieved August 31, 2011.
- Barré-Sinoussi F; Chermann JC; Rey F; et al. (1983). "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 868–871. Bibcode:1983Sci...220..868B. doi:10.1126/science.6189183. PMID 6189183. Unknown parameter
|نویسنده-separator=ignored (help) - Centers for Disease Control (CDC) (1982). "Opportunistic infections and Kaposi's sarcoma among Haitians in the United States". MMWR Morb Mortal Wkly Rep. 31 (26): 353–354; 360–361. PMID 6811853. Retrieved August 31, 2011.
- "Making Headway Under Hellacious Circumstances" (PDF). American Association for the Advancement of Science. July 28, 2006. Retrieved June 23, 2008.
- Altman LK (May 11, 1982). "New homosexual disorder worries health officials". New York Times. Retrieved August 31, 2011. More than one of
|کد زبان=and|زبان=specified (help) - Kher U (July 27, 1982). "A Name for the Plague". Time. Archived from the original on 7 March 2008. Retrieved 16 March 2013. More than one of
|تاریخ دسترسی=and|accessdate=specified (help); More than one of|کد زبان=and|زبان=specified (help) - Centers for Disease Control (CDC) (1982). "Update on acquired immune deficiency syndrome (AIDS)—United States". MMWR Morb Mortal Wkly Rep. 31 (37): 507–508; 513–514. PMID 6815471.
- RC Gallo, PS Sarin, EP Gelmann, M Robert-Guroff, E Richardson, VS Kalyanaraman, D Mann, GD Sidhu, RE Stahl, S Zolla-Pazner, J Leibowitch, and M Popovic (1983). "Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 865–867. Bibcode:1983Sci...220..865G. doi:10.1126/science.6601823. PMID 6601823.
- Barre-Sinoussi, F; Chermann, J.; Rey, F; Nugeyre, M.; Chamaret, S; Gruest, J; Dauguet, C; Axler-Blin, C; Vezinet-Brun, F; Rouzioux, C; Rozenbaum, W; Montagnier, L (1983). "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 868–871. doi:10.1126/science.6189183. ISSN 0036-8075.
- Aldrich, ed. by Robert; Wotherspoon, Garry (2001). Who's who in gay and lesbian history. London: Routledge. p. 154. ISBN 9780415229746.
- Gao F; Bailes E; Robertson DL; et al. (1999). "Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes". Nature. 397 (6718): 436–41. Bibcode:1999Natur.397..436G. doi:10.1038/17130. PMID 9989410. Unknown parameter
|نویسنده-separator=ignored (help) - Keele, B. F. , van Heuverswyn, F. , Li, Y. Y. , Bailes, E. , Takehisa, J. , Santiago, M. L. , Bibollet-Ruche, F. , Chen, Y. , Wain, L. V. , Liegois, F. , Loul, S. , Mpoudi Ngole, E. , Bienvenue, Y. , Delaporte, E. , Brookfield, J. F. Y. , Sharp, P. M. , Shaw, G. M. , Peeters, M. , and Hahn, B. H. (28 July 2006). "Chimpanzee Reservoirs of Pandemic and Nonpandemic HIV-1". Science. 313 (5786): 523–6. Bibcode:2006Sci...313..523K. doi:10.1126/science.1126531. PMC 2442710. PMID 16728595.
- Goodier, J. , and Kazazian, H. (2008). "Retrotransposons Revisited: The Restraint and Rehabilitation of Parasites". Cell. 135 (1): 23–35. doi:10.1016/j.cell.2008.09.022. PMID 18854152.(subscription required)
- Sharp, P. M.; Bailes, E.; Chaudhuri, R. R.; Rodenburg, C. M.; Santiago, M. O.; Hahn, B. H. (2001). "The origins of acquired immune deficiency syndrome viruses: where and when?" (PDF). Philosophical Transactions of the Royal Society B: Biological Sciences. 356 (1410): 867–76. doi:10.1098/rstb.2001.0863. PMC 1088480. PMID 11405934.
- Kalish ML; Wolfe ND; Ndongmo CD; McNicholl J; Robbins KE; et al. (2005). "Central African hunters exposed to simian immunodeficiency virus". Emerg Infect Dis. 11 (12): 1928–30. doi:10.3201/eid1112.050394. PMC 3367631. PMID 16485481. Unknown parameter
|نویسنده-separator=ignored (help) - Marx PA, Alcabes PG, Drucker E (2001). "Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa" (PDF). Philos Trans R Soc Lond B Biol Sci. 356 (1410): 911–20. doi:10.1098/rstb.2001.0867. PMC 1088484. PMID 11405938.
- Worobey, Michael; Gemmel, Marlea; Teuwen, Dirk E.; Haselkorn, Tamara; Kunstman, Kevin; Bunce, Michael; Muyembe, Jean-Jacques; Kabongo, Jean-Marie M.; Kalengayi, Raphaël M. (2008). "Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960" (PDF). Nature. 455 (7213): 661–4. Bibcode:2008Natur.455..661W. doi:10.1038/nature07390. PMID 18833279. (subscription required)
- Sousa, João Dinis de; Müller, Viktor; Lemey, Philippe; Vandamme, Anne-Mieke; Vandamme, Anne-Mieke (2010). Martin, Darren P., ed. "High GUD Incidence in the Early 20th Century Created a Particularly Permissive Time Window for the Origin and Initial Spread of Epidemic HIV Strains". PLoS ONE. 5 (4): e9936. doi:10.1371/journal.pone.0009936. PMC 2848574. PMID 20376191.
- Chitnis, Amit; Rawls, Diana; Moore, Jim (2000). "Origin of HIV Type 1 in Colonial French Equatorial Africa?". AIDS Research and Human Retroviruses. 16 (1): 5–8. doi:10.1089/088922200309548. PMID 10628811.(subscription required)
- Donald G. McNeil, Jr. (September 16, 2010). "Precursor to H.I.V. Was in Monkeys for Millennia". New York Times. Retrieved 2010-09-17.
Dr. Marx believes that the crucial event was the introduction into Africa of millions of inexpensive, mass-produced syringes in the 1950s. ... suspect that the growth of colonial cities is to blame. Before 1910, no Central African town had more than 10,000 people. But urban migration rose, increasing sexual contacts and leading to red-light districts.
- Zhu, T. , Korber, B. T. , Nahmias, A. J. , Hooper, E. , Sharp, P. M. and Ho, D. D. (1998). "An African HIV-1 Sequence from 1959 and Implications for the Origin of the epidemic". Nature. 391 (6667): 594–7. Bibcode:1998Natur.391..594Z. doi:10.1038/35400. PMID 9468138.
- Kolata, Gina (28 October 1987). "Boy's 1969 Death Suggests AIDS Invaded U.S. Several Times". The نیویورک تایمز. Retrieved 11 February 2009.
- Gilbert, M. Thomas P.; Rambaut, Andrew; Wlasiuk, Gabriela; Spira, Thomas J.; Pitchenik, Arthur E.; Worobey, Michael (November 20, 2007). "The emergence of HIV/AIDS in the Americas and beyond" (PDF). PNAS. 104 (47): 18566–18570. Bibcode:2007PNAS..10418566G. doi:10.1073/pnas.0705329104. PMC 2141817. PMID 17978186.
| در ویکیانبار پروندههایی دربارهٔ اچآیوی موجود است. |
