تنظیم بیان ژن
تنظیم بیان ژن به ساز و کارهایی گفته میشود که توسط سلولها برای افزایش یا کاهش یک محصول خاص ژن (پروتئین یا آرانای) انجام میگیرد و به صورت غیررسمی به آن تنظیم ژن گفته میشود. هر گامی از بیان ژن از شروع تفسیر تا پردازش آرانای و اصلاح پروتئین حاصل از ترجمهٔ آرانای میتواند تنظیم شود. اغلب در یک شبکهٔ تنظیم ژن، تنظیمکنندهٔ ژنهای مختلف همدیگر را کنترل میکند.
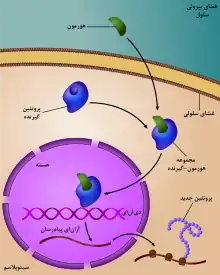
تنظیم ژن کاری حیاتی در ویروسها، پروکریوتها و یوکریوتها است چون به سلولها اجازه میدهد پروتئینهای مورد نیاز را در زمان نیاز و به مقدار نیاز تولید کنند و بنابراین به این موجودات قابلیت انعطافپذیری و تطابقپذیری با شرایط مختلف محیط را میدهد. گرچه در سال ۱۹۵۱، باربارا مککلینتاک تعامل بین دو ناحیهٔ ژنتیکی، فعالکننده و جداکننده، را در تشکیل رنگدانههای ذرت نشان داد، اکثریت کشف سیستم تنظیم ژن را شناسایی ورزهٔ لاک توسط ژاک مونو میدانند، که در آن بعضی آنزیمهای مشارکتکننده در سوخت و ساز لاکتوز در ای. کولای فقط در حضور لاکتوز و نبودن گلوکوز بیان میشوند.
در موجودات چند سلولی، تنظیم ژن موجب دگرگونی یاخته و ریختزایی در جنین میشود که در نهایت موجب به وجود آمدن نوع سلولهای مختلف در این موجودات میشود که نمایهٔ بیان ژن متفاوتی از یک ژنوم یکسان دارند. این بیانگر نحوهٔ رخ دادن تکامل در سطح مولکولی و اساس توسعهٔ تکاملی در زیستشناسی است[1] .
مراحل تنظیم بیان ژن
یک سلول در مراحل مختلفی میتواند پروتئینهای تولیدی خود را کنترل کند:[2]
- کنترل زمان و مقدار تفسیر ژن در مرحلهٔ تفسیر
- کنترل نحوهٔ پیرایش آرانای و پردازش آن
- انتخاب این که کدام آرانایهای پیامرسان از هسته خارج شوند
- از بین بردن بعضی آرانایهای خاص
- انتخاب اینکه کدام آرانایهای پیامرسان توسط ریبوزوم ترجمه شوند
- فعال کردن یا غیرفعال کردن پروتئینها پس از ترجمه
تنظیم بیان ژن در مرحلهٔ تفسیر
تغییر شیمیایی دیانای
متیلدار کردن دیانای یک فرایند شیمیایی برای خاموش کردن ژن است که حتی در تقسیم سلولی توسط سلول مادر به دختر منتقل میشود و یکی از راههای حفظ نمایهٔ بیان ژن سلول مادر در سلول دختر است.[2] دیانای بهطور معمول توسط آنزیمهای متیل ترانسفراز روی نوکلئوتید سیتوزین در قسمت دو نوکلئوتیدی سی.جی. (که در صورت تراکم بالای آن در قسمتی از رشتهٔ دیانای به آن قسمت جزیرهٔ سی.جی. هم گفته میشود) متیلدار میشود. تحلیل الگوی متیلدار شدن در یک ناحیهٔ دادهشدهٔ دیانای (که میتواند یک راهانداز باشد) توسط روشی به نام نگاشت بیسولفات انجام میشود. در این روش پسماندهای سیتوزین متیلدارشده در پالایش بیسولفات تغییری نمیکند در صورتی که سیتوزین بدون متیل به اوراسیل تبدیل میشود. این تفاوتها توسط روشهای توالییابی دیانای یا روشهای کمیکنندهٔ میزان دگردیسی نقطهای دیانای مثل توالییابی پیروفسفاتی و آرایهٔ متراکم سنجیده میشود. الگوهای متیلدار شدن غیرعادی مظنون به مشارکت در ایحاد سلولهای سرطانی هستند[3] .
تغییر ساختاری دیانای
در یوکاریوتها، میزان دسترسی به ناحیههای وسیعی از دیانای به ساختار کروماتین در آن نواحی بستگی دارد. این ساختار میتواند در نتیجهٔ تغییر هیستونها - پروتئینهایی که رشتهٔ دیانای به دور آنها میپیچد تا در ساختار کروماتینی جای بگیرد - توسط متیلدار شدن، آرانایهای بدون رمز یا پروتئینهای پیونددهنده با دیانای تغییر کند. این تغییرات میتواند موجب بازشدگی و افزایش میزان دسترسی به دیانای و بنابراین افزایش میزان بیان ژنهای آن ناحیه یا برعکس شود.
پروتئینهای پیونددهنده با دیانای
توالی خاص رشتهٔ دیانای موجب شروع و تنظیم فرایند تفسیر میشود. برای شروع تفسیر یک ژن لازم است آنزیم آرانای پلیمراز به راهانداز آن ژن متصل شود. علاوه بر راهانداز تقریباً تمامی ژنها چه در باکتری و چه یوکریوتها توالیهای دیانای ای دارند که برای روشن یا خاموش کردن بیان آن ژنها به کار میرود. بعضی از این توالیها خیلی کوتاه و بعضی خیلی بلند هستند. این توالیها به خودی خود نمیتوانند کاری انجام دهند. برای اینکه هر تأثیری داشته باشند لازم است که پروتئینهای خاصی، که به آنها عوامل تنظیمکننده گفته میشود، این توالی را تشخیص داده و به آن متصل شود. این ترکیب پروتئینهای متصل به دیانای و دیانای است که بیان ژنها را تنظیم میکند. برای اتصال یک پروتئین به توالی دیانای لازم است سطح فضایی پروتئین به صورت کامل با سطح فضایی دیانای در آن ناحیه مطابق باشد؛ بنابراین پروتئینهای مختلفی توالیهای مختلفی را شناسایی میکنند. پروتئینها با لبههای جفت باز توالی دیانای و اغلب بدون خراب کردن پیوند هیدروژنی که خود جفتباز را کنار هم نگه میدارد، پیوندهایی از نوع هیدروژنی، یونی و آبگریز تشکیل میدهند. با وجود اینکه هر کدام از این پیوندها به تنهایی ضعیف هستند، تعداد زیادی از این پیوندها بین پروتئین و توالی دیانای برقرار میشود و پروتئین را خیلی سفت در جای خود نگه میدارد.[2]
ساز و کارهای متفاوتی برای تنظیم بیان ژن توسط پروتئینهای تنطیمکننده در سلول وجود دارد. در بعضی موارد یک پروتئین یا ترکیب پروتئینی خاص با راهانداز ژنی پیوند داده و مانع اتصال پلیمراز به آن راهانداز میشوند و بنابراین از تفسیر ژن جلوگیری میکنند. زمانی که میزان یکی از پروتئینهای مشارکتکننده در این ترکیب پروتئینی بازدارنده در سلول افت کند، این پروتئین از سطح راهانداز جدا شده و ژن مجدداً تفسیر میشود. یا بعضی توالیهای راهانداز به سختی توسط آنزیم پلیمراز تشخیص داده میشوند و وجود پروتئین یا ترکیب پروتئینی خاص متصل شده به آن موجب شناسایی این توالی توسط پلیمراز و متصل شدن به آن میشود. در یوکریوتها پروتئینهای فعالکنندهٔ دیگری هم وجود دارند که به منطقهای تا فاصلهٔ چندهزار جفتباز از راهانداز متصل میشوند. به این محل اغلب افزاینده گفته میشود چون حضور آن بهطور قابل ملاحظهای میزان تفسیر را افزایش میدهد. مدلهای مختلفی برای تعامل راهانداز و افزاینده از فاصلهٔ دور پیشنهاد شده که سادهترین آنها که به نظر میرسد در بیشتر جاها عمل میکند مدل حلقه است.[2] دیانای بین راهانداز و افزاینده حلقه میشود و آنها را در مقاربت فیزیکی میآورد که موجبات تعامل بین آنها را فراهم میکند. ترکیبهای پروتئینی زیادی در این تشکیل حلقه تأثیر دارند و عدم وجود هر کدام از پروتئینهای دخیل در تشکیل حلقه مانع بیان ژن میشود. اما تشکیل حلقه همیشه باعث فعال شدن تفسیر نمیشود. در بعضی موارد ترکیبهای پروتئینی حلقهای حائل بین راهانداز و افزاینده تشکیل میدهند که مانع برقراری ارتباط بین آندو و باعث سرکوبی ژن میشود[4] . علاوه بر آن توالی دیانای میتواند پروتئینهایی که موجب تغییر ساختار کروماتین میشوند را جذب کند و بدین طریق موجب تغییر ساختار کروماتین و تنظیم بیان ژن شود.
ریز آرانایها
قسمت ترجمهنشدهٔ '۳ در آرانای پیامرسان - قسمتی که درست بعد از کدون خاتمه واقع است - اغلب حاوی توالیهای تنظیمکنندهای است که بر روی بیان ژن بعد از تفسیر آن تأثیر میگذارد[5] . چنین قسمتهای ترجمهنشدهٔ '۳ای اغلب حاوی محل اتصال برای ریزآرانایها و پروتئینهای تنظیمکننده هستند. ریزآرانای با متصل شدن به چنین قسمتهایی میتواند بیان چندین آرانای پیامرسان را یا با ممانعت از شروع ترجمه یا با باعث تجزیه شدن - در صورتی که قسمتهایی از آرانای پیامرسان به صورت جفت رشته باشد پروتئینهای خاصی در سلول آنها را تشخیص داده و تجزیه میکنند - کاهش دهد. آزمایشهای مستقیم نشان میدهد که یک ریزآرانای میتواند پایداری صدها آرانای پیامرسان یکتا را کاهش دهد[6] . آزمایشهای دیگری نشان میدهد که یک ریزآرانای واحد میتواند تولید صدها پروتئین را سرکوب کند[7][8] . پروتئینهای سرکوبکننده هم با اتصال به این نواحی میتوانند مانع از بیان آرانای پیامرسان شوند.
به نظر میرسد تأثیر تنظیم نامناسب بیان ژن توسط ریزآرانای در سرطان مهم باشد[9] . برای مثال در مقالهای در سال ۲۰۱۵، ۹ ریزآرانای به عنوان یکی از عوامل سرطان معده و روده شناخته شدند که موجب تغییر و کاهش بیان آنزیمهای تعمیرکنندهٔ دیانای میشدند[10] . به نظر میرسد تأثیر تنظیم نامناسب بیان ژن توسط ریزآرانایها در اختلالات عصبی-روانی از جمله اسکیزوفرنی، اختلال دو قطبی، اختلال افسردگی اساسی، بیماری پارکینسون، بیماری فراموشی، اوهامبینی هم مؤثر باشد[11][12][13] .
تنظیم ترجمه
ترجمهٔ آرانای پیامرسان میتواند توسط چندین سازوکار و بیشتر در مرحلهٔ شروع ترجمه کنترل شود. بهکارگیری زیرواحدهای ریبوزومی ریز در فرایند ترجمه میتواند توسط ساختار دوم آرانای پیامرسان، اتصال رشتهٔ مکمل آرانای یا با اتصال پروتئین تنظیم شود. در هر دوی پروکریوتها و یوکریوتها، تعداد بسیار زیادی پروتئین متصل شونده به آرانای وجود دارد، که اغلب توسط ساختار دوم آرانای تفسیر شده به هدفشان متصل میشوند. این ساختار میتواند تحت شرایط مختلف، برای مثال دمای مختلف یا در حضور یک لیگاند تغییر کند. بعضی از آرانایهای تفسیر شده به عنوان ریبوزیم عمل کرده و بیان خود را کنترل میکنند.
تمایز سلولهای مختلف در جنین
تمام سلولهای موجودات چند سلولی از یک سلول تخم به وجود میآیند. در ابتدا زیستشناسان گمان میکردند سلولها در طی تقسیم سلولی و تبدیل به نوع سلولهای خاص قسمتهایی از دیانای خود را از دست میدهند و تنها قسمتهای مورد استفادهٔ آنها باقی میماند و این دلیل عملکرد متفاوت و تمایز سلولهاست. در صورتی که ژنوم سلولهای تمایز یافته قابلیت عملکردی ژنوم سلول تخم را از دست بدهد قادر به ساخت یک موجود کامل از ابتدا نخواهند بود. برای آزمایش این تفکر، هستهٔ سلول پوست یک قورباغهٔ بالغ به داخل تخم آن قورباغه که از قبل هستهٔ آن را برداشته بودند تزریق شد و مشاهده شد که حداقل در مواری تخم به صورت عادی به یک نوزاد قورباغه توسعه مییابد. بعدها زیستشناسان به این پی بردند که تمامی سلولها ژنوم خود را حفظ میکنند و تمایز بین آنها از تفاوت نمایهٔ بیان ژنومشان در اثر انباشته کردن مجموعهٔ متفاوتی از پروتئینها و آرانایها در هر سلول حاصل میشود؛ بنابراین سلولها با بیان ژنهای مختلف به میزان متفاوتی عملکرد متفاوتی نشان میدهند.[2]
منابع
- مشارکتکنندگان ویکیپدیا. «Regulation of gene expression». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۱۰ دی ۱۳۹۵.
- Bray, Alberts; Johnson, Hopkin; Raff, Lewis; Walter, Roberts (2009). Essential Cell Biology (3 ed.). Garland Science.
- Vertino PM, Spillare EA, Harris CC, Baylin SB (Apr 1993). "Altered chromosomal methylation patterns accompany oncogene-induced transformation of human bronchial epithelial cells" (PDF). Cancer Research. 53 (7): 1684–9. PMID 8453642.
- Kaduke, Stephan; Blobel, Gerd A (2009). "Chromatin loops in gene regulation". Biochim Biophy Acta. 1789 (1): 17-25. doi:10.1016/j.bbagrm.2008.07.002. Unknown parameter
|ماه=ignored (help) - Ogorodnikov A, Kargapolva Y, Danckwardt S (2016). "Processing and transcriptome expansion at the mRNA 3′ end in health and disease: finding the right end". Eur J Physiol. 468: 993–1012. doi:10.1007/s00424-016-1828-3. PMC 4893057. PMID 27220521
- Lim LP, Lau NC, Garrett-Engele P, Grimson A, Schelter JM, Castle J, Bartel DP, Linsley PS, Johnson JM (Feb 2005). "Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs". Nature. 433 (7027): 769–73. Bibcode:2005Natur.433..769L. doi:10.1038/nature03315. PMID 15685193
- Selbach M, Schwanhäusser B, Thierfelder N, Fang Z, Khanin R, Rajewsky N (Sep 2008). "Widespread changes in protein synthesis induced by microRNAs". Nature. 455 (7209): 58–63. doi:10.1038/nature07228. PMID 18668040
- Baek D, Villén J, Shin C, Camargo FD, Gygi SP, Bartel DP (Sep 2008). "The impact of microRNAs on protein output". Nature. 455 (7209): 64–71. doi:10.1038/nature07242. PMC 2745094. PMID 18668037
- Palmero EI, de Campos SG, Campos M, de Souza NC, Guerreiro ID, Carvalho AL, Marques MM (Jul 2011). "Mechanisms and role of microRNA deregulation in cancer onset and progression". Genetics and Molecular Biology. 34 (3): 363–70. doi:10.1590/S1415-47572011000300001. PMC 3168173. PMID 21931505
- Bernstein C, Bernstein H (May 2015). "Epigenetic reduction of DNA repair in progression to gastrointestinal cancer". World Journal of Gastrointestinal Oncology. 7 (5): 30–46. doi:10.4251/wjgo.v7.i5.30. PMC 4434036. PMID 25987950
- Maffioletti E, Tardito D, Gennarelli M, Bocchio-Chiavetto L (2014). "Micro spies from the brain to the periphery: new clues from studies on microRNAs in neuropsychiatric disorders". Frontiers in Cellular Neuroscience. 8: 75. doi:10.3389/fncel.2014.00075. PMC 3949217. PMID 24653674
- Mellios N, Sur M (2012). "The Emerging Role of microRNAs in Schizophrenia and Autism Spectrum Disorders". Frontiers in Psychiatry. 3: 39. doi:10.3389/fpsyt.2012.00039. PMC 3336189. PMID 22539927
- Geaghan M, Cairns MJ (Aug 2015). "MicroRNA and Posttranscriptional Dysregulation in Psychiatry". Biological Psychiatry. 78 (4): 231–9. doi:10.1016/j.biopsych.2014.12.009. PMID 25636176