ترجمه یوکاریوتی
فرایند ترجمه آرانای پیامرسان به پروتئین در موجودات یوکاریوت را ترجمه یوکاریوتی میگویند و شامل ۴ مرحله است:شروع، انتشار، پایان و بازیافت ریبوزوم.
شروع
شروع وابسته به کلاه
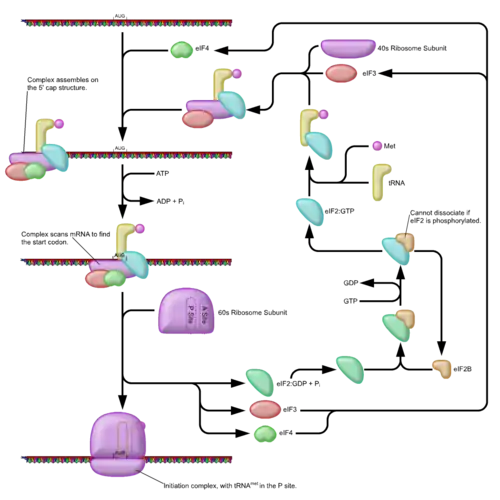
شروع ترجمه معمولاً شامل تعامل بین پروتئینهای کلیدی با تگ خاص متصل شده به انتهای ۵' آرانای پیامرسان، کلاه ۵' و همچنین ناحیهٔ ترجمه نشدهٔ ۵' است. فاکتورهای رونویسی به ریبوزوم کوچکتر (که به واحد 40S معروف است) وصل میشوند و همه با هم آرانای را در مکان درست نگه میدارند. فاکتورelf3 به ریبوزوم کوچک متصل میشود و نقش مهمی در حفظ کردن ریبوزوم بزرگتر از اتصال در زمان نامناسب دارد. این فاکتور همچنین با مجموعه فاکتور elf4 نیز در ارتباط است، که شامل ۴ فاکتور شروع elf4A , elf4E, elf4G هستند. فاکتور elf4G داربست پروتئینی است که به elf3 و دو جز دیگر مستقیماً متصل است. فاکتور elf4E پروتئین متصل به کلاه است. اتصال elf4E به کلاه عموماً به عنوان عامل محدودکنندهٔ سرعت ترجمه در شروع وابسته به کلاه در نظر گرفته میشود و غلظت elf4E به نوعی پیوند نظارتی در کنترل ترجمه است. ویروسهای خاصی اتصال بین elf4Eو elf4G را میشکافند و مانع از ترجمه وابسته به کلاه میشوند تا ماشین میزبان را برای حمله پیامهای ویروسی (مستقل از کلاه) دستکاری نمایند. فاکتور elf4A یک آرانای هلیکاز وابسته به ATP است که به ریبوزوم در حل مسئلهٔ شکلدهی خاص ساختار نوع دوم همزمان با ترجمه آرانای پیامرسان کمک میکند.[1] پروتئین متصل شونده به دنباله آدنین(PABP)، از طریق elF4G به مجموعه elF4F نسبت داده میشود و به دنبالهٔ آدنین بسیاری از آرانایهای پیامرسان یوکاریوتی متصل میشود. این پروتئین نقش مهمی را در حلقه شدن آرانای پیامرسان در زمان ترجمه بازی میکند.[2][3] این مجموعه پیش شروع 43S همراه با فاکتورهای پروتئینی روی آرانای حرکت میکنند تا در فرایند جستجو آرانای برای یافتن کلمه رمز ژنتیکی شروع ترجمه (معمولاًAUG)به انتهای ۳' برسند. در یوکاریوتها و ارکیا امینواسید شروع 'متونین' است. آغازگر مت-شارژ آرانای حامل، توسط فاکتور شروع یوکاریوت2(elf2) به محل p از ریبوزوم کوچک آورده شده، GTP را هیدرولیزه کرده و سیگنالهایی برای جدا شدن فاکتورهای پروتئینی از ریبوزوم کوچک و در نهایت اتصال ریبوزوم بزرگتر را ارسال میکند. در نهایت ریبوزوم کامل 80S فرایند ترجمه آرانای پیامرسان را شروع میکند. تنظیم سنتز پروتئین تا حدودی تحت تأثیر فسفراسیون elf2 (از طریق واحد آلفا) که بخشی از مجموعه سه تایی eIF2-GTP-Met-tRNA_i^Metاست، قرار میگیرد. وقتی تعداد زیادی elf2 فسفریزه میشوند که سنتز پروتئین مهار شده باشد. این پدیده در اثر قحطی امینواسید یا در اثر حمله ویروس اتفاق میافتد. با این حال، درصد کمی از این فاکتورهای شروع بهطور طبیعی فسفریزه شدهاند. تنظیمکننده دیگر 4EBP است که به فاکتور شروع elf4E متصل است و ارتباطش با elf4G را مهار میکند و در نتیجه از شروع وابسته به کلاه جلوگیری میکند. در مخالفت با اثر4EBP، فاکتورهای رشد اقدام به فسفریزه کردن 4EBP کرده، میل ترکیبی elf4E را کاهش داده و اجازه سنتز پروتئین را میدهند. درحالیکه تنظیم کلی سنتز پروتئین از طریق تعدیل کردن بیان فاکتورهای کلیدی و تعداد ریبوزومها ایجاد میشود، آرانایهای پیامرسان میتوانند نرخهای ترجمه متفاوتی نسبت به حضور عناصر دنباله نظارتی داشته باشند و اهمیت این مسئله در تنظیمات مختلف شامل مخمر میوز و پاسخ اتیلن در گیاهان مشخص شدهاست. علاوه بر این، مطالعات اخیر در مخمر و انسان نشان داده است که اختلاف تکاملی در رشتههای سامان دهنده همسو میتواند روی تنظیمات ترجمه اثرگذار باشد.[4]
شروع مستقل از کلاه
بهترین مثال برای شروع ترجمه مستقل از کلاه، سایت ورود ریبوزوم داخلی است. تفاوت شروع مستقل از کلاه با شروع وابسته به کلاه در این است که در شروع مستقل از کلاه نیازی به کلاه ۵' برای جستجو رمز شروع ترجمه آرانای پیامرسان از انتهای۵' نیست. ریبوزوم میتواند مستقیماً به نقطه شروع متصل شود، یا از طریق فاکتورهای شروع یا ITASs (عوامل ساماندهی ناهمسو) جستجو در ناحیهٔ ترجمه نشده ۵' را انجام ندهد. این روش ترجمه برای شرایطی که تنها نیاز به ترجمه ناحیههای خاص آرانای پیامرسان است، مهم میباشد. برای مثال میتوان به پاسخ فاکتورها به اپوپتوز و پاسخهای ناشی از استرس اشاره کرد.[5]
انتشار
انتشار به فاکتورهای انتشار یوکریوتی بستگی دارد. بعد از این که مرحله قبلی به پایان رسید، آرانای پیامرسان در محل مناسب قرار گرفتهاست، بنابراین رمز ژنتیکی بعدی میتواند در مرحله انتشار برای تولید پروتئین ترجمه شود. آغازگر آرانای حامل، ناحیهٔ p را در ریبوزوم اشغال کرده و ناحیهٔ A آماده برای دریافت آمینواسید آرانای حامل میشود. در طول انتشار زنجیره، هر امینواسید به زنجیره پلی پپتیدی در حال ساخت درطی سه مرحله اضافه میشود. این سه مرحله در چرخه به این ترتیب است: ۱. قرار گرفتن آمینواسید آرانای حامل درست در محل A از ریبوزوم، ۲. تشکیل پیوند پپتیدی، و ۳. شیفت آرانای پیامرسان به اندازه یک رمز ژنتیکی نسبت به ریبوزوم.
برخلاف باکتریها که شروع ترجمه در آنها دقیقاً وقتی انتهای ۵' آرانای پیامرسان سنتز شد رخ میدهد، در یوکریوتها این ارتباط محکم بین رونویسی و ترجمه ممکن نیست چون رونویسی و ترجمه در محفظههای جداگانهای از سلول انجام میشوند (در هسته و سیتوپلاسم). پیش سازهای آرانای پیامرسان یوکاریوتی یاید در هسته پردازش شوند (کلاه پلی ادنیلاسون و اسپلاینیگ) قبل از اینکه آرانای پیامرسان برای ترجمه به سیتوپلاسم صادر شود. ترجمه همچنین میتواند تحت تأثیر توقف ریبوزومی که قابلیت تحریک حمله اندونوکلئوتیک به آرانای پیامرسان را دارد و فرایند فروپاشی آرانای پیامرسان نامیده میشود، قرار بگیرد. توقف ریبوزومی همچنین به پیچ خوردن رشته پلی پپتیدی تازه تولید شده از ریبوزوم کمک کرده و در حالی که آرانای پیامرسان را رمزگذاری میکند، ترجمهٔ پروتئین را به تأخیر میاندازد و سبب تحریک تغییر قاب ریبوزومی شود.[6]
پایان
این مرحله نیز به فاکتورهای آزادسازی یوکریوتی بستگی دارد و مشابه پایان ترجمه پروکریوت است اما برخلاف پایان ترجمه پروکریوت، یک فاکتور آزادسازی کلی وجود دارد،erf1، که تمام رمزهای ژنتیکی پایان را شناسایی میکند. پس از پایان ترجمه، ریبوزوم از آرانای پیامرسان جدا شده و رشته پلی پپتیدی ایجاد شده آزاد میشود.erf3 یک GTPase وابسته به ریبوزوم است که به erf1 کمک میکند تا رشته را آزاد کند. ژنوم انسان تعدادی ژن را کد میکند، که کدهای پایان آرانای پیامرسان بهطور شگفتانگیزی کم هستند: در این ژنها پایان ترجمه، با توجه به بازهای خاص آرانای در مجاورت کدهای پایان ناکارامد است. ناکارامدی مرحله پایان در این ژنها منجر به ترجمهٔ بیشتر از ۱۰٪ از کد پایان در این ژنها میشود. بعضی از این ژنها، در این ناحیهٔ اضافه خوانده شده، دامنههای کاربردی پروتئین را کد میکنند؛ بنابراین ایزوفرمهای پروتئین جدید نیز میتوانند ایجاد شوند.[7]
جستارهای وابسته
منابع
- Hellen, Christopher U. T. ; Sarnow, Peter (2001-07-01). "Internal ribosome entry sites in eukaryotic mRNA molecules". Genes & Development. 15 (13): 1593–1612. doi:10.1101/gad.891101. ISSN 0890-9369. PMID 11445534
- Malys N, McCarthy JEG (2011). "Translation initiation: variations in the mechanism can be anticipated". Cellular and Molecular Life Sciences. 68 (6): 991–1003. doi:10.1007/s00018-010-0588-z. PMID 21076851
- Wells, SE; et al. (1998). "Circularization of mRNA by Eukaryotic Translation Initiation Factors". Molecular Cell. 2: 135–140. doi:10.1016/S1097-2765(00)80122-7. PMID 9702200
- Cenik, Can; Cenik, Elif Sarinay; Byeon, Gun W; Candille, Sophie P. ; Spacek, Damek; Araya, Carlos L; Tang, Hua; Ricci, Emiliano; Snyder, Michael P. (Nov 2015). "Integrative analysis of RNA, translation, and protein levels reveals distinct regulatory variation across humans.". Genome Research. 25: 1610–21. doi:10.1101/gr.193342.115. PMID 26297486
- López-Lastra, M; Rivas, A; Barría, MI (2005). "Protein synthesis in eukaryotes: the growing biological relevance of cap-independent translation initiation". Biological research. 38 (2–3): 121–46. doi:10.4067/s0716-97602005000200003. PMID 16238092.
- Buchan JR, Stansfield I. Halting a cellular production line: responses to ribosomal pausing during translation. Biol Cell. 2007 Sep;99(9):475-87
- Schueren F and Thoms S (2016). "Functional Translational Readthrough: A Systems Biology Perspective". PLOS Genetics. 12 (e1006196): 12. doi:10.1371/JOURNAL.PGEN.1006196. PMC 4973966Freely accessible. PMID 27490485
پیوند به بیرون
- Animation at wku.ed
- A nimations at nobelprize.org