آرانای پیامرسان
آرانای پیام رسان یا آرانای پیک (انگلیسی: Messenger RNA یا به اختصار mRNA) گونهٔ مهمی از آرانایها است که یک الگوی ژنتیکی را برای ساخت یک محصول پروتئینی (پلی پپتید)، به صورت رمزه (کدون) (توالی ۳ نوکلئوتیدی در رنای پیک) رمزگذاری میکند. mRNA، از یک الگوی دیانای، رونویسی (ساخته) میشود و اطلاعات رمزگذاری شده را به مکانهای ساخت پروتئین یعنی ریبوزومها، میبرد.
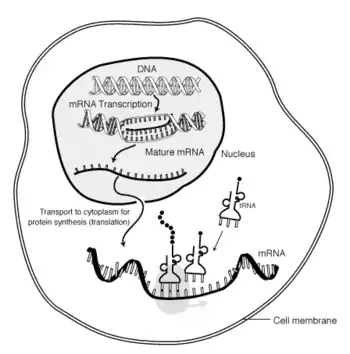
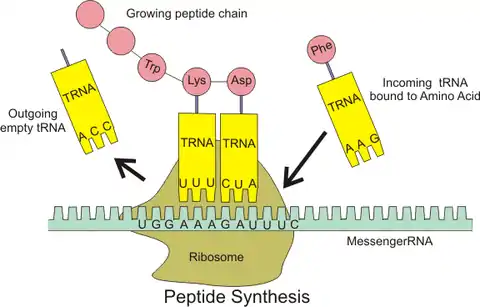
در ریبوزوم، رمزههای رنای پیک تعیین میکنند که کدام آمینواسیدها باید در ساختار پلیپپتید قرار بگیرند. به ساخته شدن پلیپپتید از روی اطلاعات رنای پیک، ترجمه میگویند. آرانایهای ناقل دارای آمینواسید، با خواندن اطلاعات رمزهها آمینواسید مناسب را انتخاب میکنند و فرایند ترجمه را انجام میدهند.[1]
در هر رمزه، یک آمینواسید، رمز شده است. البته رمزههای پایان هیچ آمینواسیدی را رمز نمیکنند بلکه فرایند ترجمه را به پایان میرسانند.[1]
این پردازش نیازمند به انواع دیگری از آرانای نیز نیاز دارد: آرانای ناقل (tRNA) که کار شناسایی رمزهها را انجام میدهد و آمینواسیدهای متناظر را تأمین میکند، و همچنین آرانای ریبوزومی (rRNA)، که جزء مرکزی در دستگاه تولید پروتئین ریبوزوم است.[1]
ساخت، پردازش و عملکرد
به طور خلاصه عملکرد مولکول mRNA با رونویسی از روی DNA آغاز شده و با از هم پاشیدگی تمام میشود. در طول زندگی، مولکول mRNA ممکن است که پردازش شده، تغییر یابد یا قبل از ترجمه، منتقل شود. مولکولهای mRNA یوکاریوتی، معمولاً نیازمند پردازش و انتقال اطلاعات بیشتری هستند در حالیکه در پروکاریوتها اینگونه نیست.
رونویسی
در طول رونویسی (ساخت mRNA از روی DNA)، آرانای پلیمراز (در نقش آنزیم)، عموماً در هنگام نیاز، یک کپی از ژن DNA به mRNA درست میکند. این فرایند در یوکاریوتها و پروکاریوتها مانند هم است. یک تفاوت مهم این است که RNA polymerase های پروکاریوتی در ارتباط با آنزیمهای پردازشی mRNA در طول رونویسی میباشند تا پردازش بتواند پس از شروع رونویسی به سرعت پیشرفت نماید. محصول چندروزه، پردازش نشده یا به صورت جزئی پردازش شده، pre-mRNA نام دارد، هنگامی که پردازش کامل شود، محصول، mature mRNA نامیده میشود.
پردازش pre-mRNA یوکاریوتی
پردازش mRNA در یوکاریوتها و باکتریها، پروکاریوتها بسیار متفاوت است. mRNA پروکاریوتی در برابر رونویسی بالغ میشود و هیچ پردازشی نیاز ندارد، به جز در مواردی اندک. pre-mRNA یوکاریوتی نیازمند پردازش گستردهای است.
ضمیمه کپ ۵
ضمیمه کپ ۵' (همچنین اصطلاحات RNA cap، RNA 7-methylguanosine cap یا RNA m7G cap) یک نوکلئوتید گوانین تغییریافتهاست که به «جلو» یا 5'end یک RNA پیامرسان یوکاریوتی، کمی پس از شروع رونویسی اضافه میشود. کپ ۵َ شامل یک پایانه ۷-متیلگوانوزین است که توسط یک پیوند ۵َ-۵َ-تریفسفات به اولین نوکلئوتید ترجمه شده متصل میشود. حضور آن برای شناسایی توسط ریبوزوم و محافظت از RNases حیاتی است. ضمیمه کلاهک با رونویسی همراه میشود و رونویسی همکارانه ایجاد میشود بهطوریکه هرکدام روی دیگری تأثیر میگذارد. کمی پس از شروع رونویسی، 5' end مربوط به mRNA که در حال سنتز شدن است توسط یک کمپلکس سنتزکننده کلاهک که در ارتباط با آرانای پلیمراز است، محدود میشود. این کمپلکس آنزیمی، واکنشهای شیمیایی را که برای mRNA کپینگ لازم است کاتالیز میکند. سنتز به عنوان یک واکنش چند مرحلهای بیوشیمیایی به پیش میرود.
اسپلایسینگ
اسپلایسینگ فرایندی است که در آن pre-mRNA تغییر مییابد تا امتدادهای خاصی از رشتههای کد نشده که اینترون نامیده میشوند را حذف کند. امتدادهایی که باقی میمانند شامل رشتههای کدشده پروتئینی هستند و اگزون نامیده میشوند. گاهی اوقات پیامهای pre-mRNA ممکن است که به چندین روش مختلف اسپلایس شوند که سبب میشود تا یک ژن چندین پروتئین را رمز کند. این فرایند، اسپلایسینگ جایگزین نامیده میشود. اسپلایسینگ، معمولاً توسط یک کمپلکس پروتئین-RNA که اسپلایسسام نامیده میشود انجام میشود اما بعضی از مولکولهای RNA نیز توانایی کاتالیز اسپلایسینگ خود را دارند. (به ریبوزیم مراجعه کنید)
ویرایش کردن
در بعضی موارد، یک mRNA که میخواهد ویرایش شود، ترکیب نوکلئوتیدی آن mRNA تغییر مییابد. یک مثال در انسانها apolipoprotein B mRNA میباشد که در بعضی از بافتها ویرایش میشود اما در بقیه نمیشود. ویرایش، یک کودون توقف زودرس ایجاد میکند که در هنگام ترجمه، یک پروتئین کوتاهتر تولید میکند.
پلی آدنیلاسیون
پلی آدنیلاسیون پیوند شیمیایی یک نیمه پلیآدنیلیک با یک مولکول RNA پیامرسان میباشد. در ارگانیسمهای یوکاریوتی، بیشتر مولکولهای RNA پیامرسان (mRNA)، در 3'end پلیآدنیلیزه هستند. دنباله پلی(آ) (poly(A) tail) و پروتئینی که به آن باند میشود، mRNA را از ازهمپاشیدگی بهوسیله اگزونوکلئاز محافظت میکند. پلی آدنیلاسیون همچنین برای اتمام رونویسی، خارج کردن mRNA از هسته و ترجمه کردن مهم میباشد. mRNA همچنین میتواند در ارگانیسمهای پروکاریوتی پلیآدنیلیزه شود، جایی که دنباله پلی (آ)ها (poly(A) tail) فعالیت کرده تا ازهمپاشیدگی اگزونوکلئولیتیک را مهیا کند به جای آنکه مانع آن شود. پلی آدنیلاسیون، در مدتزمان و همچنین بلافاصله پس از رونویسی DNA در RNA رخ میدهد. پس از آنکه رونویسی به اتمام رسید، زنجیره mRNA در حین فعالیت کمپلکس اندونوکلئاز که همراه با RNA-پلیمراز است، شکسته میشود. پس از آنکه mRNA شکسته شد، در حدود ۲۵۰ اسیدآمینه آدنین به 3'end آزاد در محل شکستن اضافه میشوند. این واکنش به وسیله پلیمراز پلیآدنیلیزه کاتالیز میشود. همانند اسپلایسینگ جایگزین، بیش از یکی از انواع پلی آدنیلاسیون یک mRNA میتواند موجود باشد.
انتقال
تفاوت دیگر مابین یوکاریوتها و پروکاریوتها در انتقال mRNA میباشد، چونکه رونویسی و ترجمه یوکاریوتی از همدیگر جدا میباشند، mRNAهای یوکاریوتی باید از هسته به سیتوپلاسم خارج شوند. mRNAهای بالغ بهوسیله تغییرات پردازششدهشان شناسایی میشوند و سپس از طریق روزنه هسته خارج میشوند. در نورونها، mRNA باید از سوماً به دندریتها انتقال یابد، جایی که ترجمه محلی در پاسخ به محرک خارجی رخ میدهد.[2] بسیاری از پیامها توسط «زیپکد»ها که انتقالشان را به یک مکان خاص در نظر میگیرند، نشانهگذاری میشوند.[3]
ترجمه
از آنجایی که mRNA پروکاریوتی نیازی ندارد که پردازش شود یا انتقال پیدا کند، ترجمه توسط ریبوزومها میتواند سریعاً پس از پایان رونویسی آغاز شود؛ بنابراین میتوان گفت که ترجمه پروکاریوتی با رونویسی همراه میشود و رونویسی همکارانه رخ میدهد. mRNA یوکاریوتی که پردازش شده و به سیتوپلاسم منتقل شدهاست (به عبارت دیگر mRNA بالغ)، میتواند توسط ریبوزوم ترجمه شود. ترجمه ممکن است که در ریبوزومهای آزاد شناور در سیتوپلاسم رخ دهد یا مستقیماً توسط signal recognition particle در شبکهٔ درمیانیاختهای اتفاق بیفتد؛ بنابراین برخلاف پروکاریوتها، ترجمه یوکاریوتی بهطور مستقیم با رونویسی همراه نمیباشد.
ساختار
کپ ۵
کپ ۵َ یک نوکلئوتید گوانین تغییر یافتهاست که به «جلو» (سمت و سو) از pre-mRNA با استفاده از یک پیوند ۵َ-۵َ-فسفات اضافه شدهاست. این تغییر برای شناسایی و ضمیمه درست mRNA به ریبوزوم، حیاتی است همانطور که محافظت از ۵' اگزونوکلئاز مهم میباشد. همچنین برای فرایندهای حیاتی دیگر همچون اسپلایسینگ و انتقال مهم میباشد.
مناطق کدینگ
مناطق کدینگ از کدونها تشکیل شدهاست که این مناطق به وسیله ریبوزومها (در یوکاریوتها معمولاً به یکی و در پروکاریوتها معمولاً به چندتا) پروتئین رمزگشایی شده و ترجمه میشوند. مناطق کدینگ با یک کدون آغازین شروع شده و با یک کدون توقف پایان مییابند. بهطور کلی کدون آغازین، سهتایی AUG و کدون توقف، UAA، UAG یا UGA میباشد. مناطق کدینگ تمایل دارند که بهوسیلهٔ جفتبازهای داخلی ایجاد شوند که این مدل مانع از ازهمپاشیدگی میشود.[4][5] علاوه بر اینکه کدینگ پروتئینی میباشند، قسمتهایی از مناطق کدینگ ممکن است که به عنوان رشتههای تنظیمی در pre-mRNA به عنوان exonic splicing enhancers یا exonic splicing silencers باشند.
مناطق ترجمه نشده
مناطق ترجمه نشده (UTRs) بخشهایی از mRNA میباشند که قبل از کدون آغازین و پس از کدون توقف میباشند که ترجمه نشدهاند که به ترتیب منطقه ترجمه نشده 5' (5' UTR) و منطقه ترجمه نشده 3' (3' UTR) نامگذاری میشوند. این مناطق با منطقه کدینگ رونویسی میشوند و بنابراین exonic میباشند چون در mRNA بالغ موجود میباشند. چندین نقش در بیان ژن مربوط به مناطق ترجمه نشدهاست، همچون پایداری mRNA، محلی نمودن mRNA و کارایی ترجمهای. توانمندی یک UTR برای انجام این اعمال بستگی به رشته UTR دارد و در بین mRNAها میتواند متفاوت باشد. پایداری mRNAها توسط 5' UTR یا 3'UTR بر حسب تفاوت در وابستگی برای آنزیمهای کاهشی RNA که ریبونوکلئاز نامیده میشوند کنترل میشوند و همچنین نیز برای پروتئینهای کمکی که میتوانند کاهش RNA را بیشتر کرده یا از آن جلوگیری به عمل آورند. کارایی ترجمهای که گاهی اوقات شامل ممانعت کامل از ترجمه میباشد توسط UTRها کنترل میشود. پروتئینهایی که به ۳' یا 5' UTR متصل میشوند ممکن است توسط تأثیری که بر توانایی ریبوزوم در اتصال به mRNA دارند در ترجمه تأثیرگذار باشند. میکروRNAهایی که به[ 3'UTR ] نیز متصل میشوند ممکن است در کارایی ترجمهای یا پایداری mRNA تأثیر بگذارند. محلیسازی سیتوپلاسمی mRNA به عنوان عملکردی از 3' UTR در نظر گرفته میشود. پروتئینهایی که در مناطق خاصی از سلول مورد نیاز میباشند میتوانند در آنجا ترجمه شوند، در این موارد، 3'UTR ممکن است شامل رشتههایی باشد که اجازه دهد تا رونویسی در این محل برای ترجمه، محلی شود. بعضی از عناصر که در مناطق ترجمه نشده وجود دارند، هنگامی که به RNA رونویسی میشوند یک مشخصهای با عنوان[ساختار دوم] ایجاد میکنند. این عناصر mRNAهای ساختاری در تنظیم mRNAها دخالت میکنند. بعضی چون [SECIS element ]، اهداف پروتئینها برای اتصال میباشند. یک کلاس از عنصر [mRNA، [riboswitches، مستقیماً به مولکولهای کوچک متصل میشود، تاخوردگی آنها را تغییر میدهد تا در مراحل رونویسی یا ترجمه تغییر ایجاد کند. در این موارد، mRNA خود را تنظیم مینماید.
دنباله پلی(آ)
۳'دنباله پلی(آ) یک رشته بلند از نوکلئوتیدهای [آدنین] (حدود ۲۰۰) میباشد که به[ 3' end ]از pre-mRNA اضافه میشود. این دنباله، خارج شدن از هسته و ترجمه را بیشتر کرده و mRNA را از ازهمپاشیدگی محافظت میکند.
تک ژنی در برابر پلی سیسترونیک mRNA
به مولکول mRNA تک ژنی گفته میشود هنگامی که دارای اطلاعات ژنتیکی است که تنها یک پروتئین را ترجمه میکند که در مورد بیشتر mRNAهای یوکاریوتی میباشد.[6][7] به عبارت دیگر، پلی سیسترونیک mRNA، اطلاعات چندین ژن را حمل میکند که به چندین پروتئین ترجمه میشود.
حلقوی شدن mRNA
در یوکاریوتها مولکولهای mRNA برحسب تعامل مابین cap binding complex و poly(A)-binding protein تشکیل ساختارهای حلقهای میدهند.[8] حلقوی شدن سبب پیشرفت در بازسازی ریبوزومها بر روی یک پیام میشود که به ترجمه کارایی منجر میشود.
ازهمپاشیدگی
mRNAهای متفاوت درون یک سلول، دوره زندگی (پایداری) متفاوتی دارند. در سلولهای باکتریایی، هر یک از mRNAها از چند ثانیه تا بیش از یک ساعت میتوانند زندگی نمایند، در سلولهای پستانداران، دوره زندگی mRNAها از چند دقیقه تا چند روز متغیر است. پایداری بیشتر mRNA سبب تولید پروتئینهای بیشتر از آن mRNA میشود. دوره زندگی محدود mRNA یک سلول را قادر میکند تا به سرعت در پاسخ به نیازمندیهای در حال تغییر، سنتز پروتئین را تغییر دهد. مکانیسمهای زیادی وجود دارند که به نابود نمودن یک mRNA منجر میشود، تعدادی از آنها در زیر بیان میشوند.
ازهمپاشیدگی mRNAهای پروکاریوتی
ه طور کلی دوره زندگی در mRNAها کوتاهتر از یوکاریوتها است. پروکاریوتها پیامها را با استفاده از ترکیبی از ریبونوکلئازها که شامل اندونوکلئازها، ۳َ اگزونوکلئاز و ۵َ اگزونوکلئاز میباشد، از بین میبرند. در بعضی موارد، مولکولهای کوچک mRNA یا همان[sRNA]ها که به طول دهها تا صدها نوکلئوتید میباشد توسط جفت شدن بازها با رشتههای مکمل میتواند موجب ازهمپاشیدگی mRNAهای خاصی شود و شکسته شدن ریبونوکلئاز را فراهم نمایند. اخیراً نشان داده شدهاست که باکتریها گونهای از[ کپ۵'] را دارند که یک تریفسفات روی[5' end]دارد.[9] حذف دو فسفات، یک ۵َمونوفسفات بر جا میگذارد که سبب میشود تا[اندونوکلئاز] RNase E پیام را نابود کند.
تجدید mRNAهای یوکاریوتی
درون سلولهای یوکاریوتی، تعادلی بین فرایندهای[ ترجمه] و خرابی mRNA وجود دارد. پیامهایی که در حال ترجمه شدن هستند توسط[ریبوزوم]ها،[فاکتورهای آغازین یوکاریوتی]:[eIF-4E] و[eIF-4G ]و[پروتئین پلی(آ)-بایندینگ] گرفتار میشوند. eIF-4E و eIF-4G آنزیم دیکپینگ ([DCP2]) را بلاک میکنند و پروتئین پلی (آ)-بایندینگ،[exosome complex ] را که انتهای پیام را محافظت میکند، بلاک میکند. تعادل مابین ترجمه و خراب شدن در اندازه و فراوانی ساختارهای سیتوپلاسمی با عنوان[P-bodies ][10] نمود پیدا میکند.[دنباله پلی(آ)] از mRNA توسط اگزونوکلئاز خاصی که توسط ترکیبی از رشتههای تنظیمی سیس بر روی RNA و پروتئینهای ترانس مقید شده به RNA (trans-acting RNA-binding proteins) به RNAهای پیامرسان خاصی هدفگیری میشوند، کوتاه میشود. حذف دنباله پلی (آ) در نظر گرفته میشود که ساختار حلقوی پیام را از بین میبرد و[cap binding complex ] را بیثبات مینماید. پیام سپس با[exosome complex ] و یا[decapping complex ] به ازهمپاشیدگی مربوط میشود. با این روش، پیامهای ترجمهای غیرفعال میتوانند به سرعت نابود شوند، درحالی که پیامهای فعال، سالم میمانند. مکانیسمی که با آن ترجمه توقف مییابد و پیامی که کمپلکسها را از بین میبرد بهطور کامل شناخته نشدهاست.
ازبین رفتن عنصر AU-rich
حضور عناصر AU-rich در تعدادی از mRNAهای پستانداران سبب میشود تا رونوشتهایی که در خلال فعالیت پروتئینهای سلولی متصل به این رشتهها است بیثبات شوند و حذف نمودن دنباله پلی (آ) را سبب شود. نبود دنباله پلی (آ) سبب پیشرفت ازهمپاشیدگی mRNA توسط حمله کردن هر دوی[exosome complex ][11] و[decapping complex ][12] میشود. ازهمپاشیدگی سریع توسط عناصر AU-rich، یک مکانیسم حیاتی برای جلوگیری از تولید اضافی سیتوکینهای قوی همچون فاکتور فساد تومور (tumor necrosis factor(TNF)) و فاکتور تحریک گرانولوسیت ماکروفاژ کولونی (granulocyte-macrophage colony stimulating factor (GM-CSF)) میباشد.[13] عناصر AU-rich همچنین بیوسنتز فاکتورهای رونویسی پروتو-انکوژنیک (proto-oncogenic transcription factors) همچون[c-Jun] و[c-Fos ]را تنظیم مینمایند.[14]
فروپاشی واسطه بیمعنی
پیامهای یوکاریوتی توسط فروپاشی واسطه بیمعنی (NMD) نظارت میشوند که برای وقوع کدونهای توقف نابالغ (کدونهای بیمعنی) در پیام بررسی میشوند. اینها میتوانند از طریق اسپلایسینگ کامل نشده به وجود آیند:[ V(D)J recombination] در[ adaptive immune system]، جهش در DNA، خطاهای رونویسی،[ leaky scanning ]توسط ریبوزوم که سبب یک frame shift میشود و علتهای دیگر. یافتن کودون توقف نابالغ سبب ازهمپاشیدگی mRNA به وسیله ۵' دیکپینگ، حذف دنباله ۳َ پلی (آ) و یا[ endonucleolytic cleavage ]میشود.[15]
RNAهای کوچک مداخلهکننده
درmetazoans، RNAهای کوچک مداخلهکننده ((small interfering RNAs (siRNAs) که توسط[ Dicer] پردازش شدهاند در کمپلکسی با عنوان کمپلکس خاموشی ناشی از ((RNA-induced silencing complex (RISC) جاگرفتهاند. این کمپلکس دارای یک اندونوکلئاز میباشد که بهطور کامل، پیامهای مکمل را که siRNAها به آنها متصل میشوند را میشکافد. سپس بخشهای mRNA حاصل، به وسیله اگزونوکلئاز نابود میشوند. siRNAها بهطور معمول در آزمایشگاهها برای مسدود کردن عملکرد ژنها در کشت سلولها به کار میروند و همچنین به عنوان بخشی از سیستم ایمنی درونی به عنوان یک دفاع در برابر ویروسهای RNA دو رشتهای در نظر گرفته میشوند.[16]
میکروRNA
میکروRNAها RNAهای کوچکی هستند که بهطور جزئی مکمل رشتههای در RNAهای پیامرسان متازون (metazoan messenger RNAs) هستند.[17] اتصال یک miRNA به یک پیام میتواند ترجمه آن پیام را ازبین ببرد و حذف دنباله پلی (آ) را سرعت بخشد و بدین وسیله ازهمپاشیدگی mRNA را سرعت ببخشد. مکانیسم فعالیت miRNAها موضوع تحقیقات فعال میباشد.[18]
مکانیسمهای دیگر فروپاشی (Other decay mechanisms)
راههای دیگری نیز برای ازبین رفتن پیامها وجود دارد که شامل فروپاشی بدون توقف (non-stop decay)، خاموشی توسط Piwi-interacting RNA (piRNA) و همچنین راههای دیگر وجود دارند.
منابع
- زیستشناسی (۳)-پایۀ دوازدهم دورۀ دوم متوسطه - ۱۱۲۲۱۶.
- Job, C.; Eberwine, J. (1912), "Localization and translation of mRNA in dendrites and axons" (w), Nat Rev Neurosci, 2001 (12): 889–98, doi:10.1038/35104069, PMID 11733796
- Ainger, Kevin; Avossa, Daniela; Diana, Amy S.; Barry, Christopher; Barbarese, Elisa; Carson, John H. (1997), "Transport and Localization Elements in Myelin Basic Protein mRNA", The Journal of Cell Biology, 138 (5): 1077–1087, doi:10.1083/jcb.138.5.1077, PMC 2136761, PMID 9281585
- Shabalina SA, Ogurtsov AY, Spiridonov NA (2006), "A periodic pattern of mRNA secondary structure created by the genetic code", Nucleic Acids Res., 34 (8): 2428–37, doi:10.1093/nar/gkl287, PMC 1458515, PMID 16682450
- Katz L, Burge CB (2003), "Widespread selection for local RNA secondary structure in coding regions of bacterial genes", Genome Res., 13 (9): 2042–51, doi:10.1101/gr.1257503, PMC 403678, PMID 12952875 Unknown parameter
|month=ignored (help) -
Kozak, M. (1983), "Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles", Microbiological Reviews, 47 (1): 1–45, PMC 281560, PMID 6343825 Unknown parameter
|month=ignored (help);|access-date=requires|url=(help) - Niehrs C, Pollet N (1999), "Synexpression groups in eukaryotes", Nature, 402 (6761): 483–7, doi:10.1038/990025, PMID 10591207 Unknown parameter
|month=ignored (help) - Wells, S.E.; Hillner, P.E.; Vale, R.D.; Sachs, A.B. (1998), "Circularization of mRNA by Eukaryotic Translation Initiation Factors" (w), Molecular Cell, 2 (1): 135–140, doi:10.1016/S1097-2765(00)80122-7, PMID 9702200
- Deana, Atilio; Celesnik, Helena; Belasco, Joel G. (2008), "The bacterial enzyme RppH triggers messenger RNA degradation by 5' pyrophosphate removal", Nature, 451 (7176): 355, doi:10.1038/nature06475, PMID 18202662
- Parker, R.; Sheth, U. (2007), "P Bodies and the Control of mRNA Translation and Degradation" (w), Molecular Cell, 25 (5): 635–646, doi:10.1016/j.molcel.2007.02.011, PMID 17349952
- Chen, C.Y.; Gherzi, R.; Ong, S.E.; Chan, E.L.; Raijmakers, R.; Pruijn, G.J.M.; Stoecklin, G.; Moroni, C.; Mann, M. (2001), "AU Binding Proteins Recruit the Exosome to Degrade ARE-Containing mRNAs", Cell, 107 (4): 451–464, doi:10.1016/S0092-8674(01)00578-5, PMID 11719186, archived from the original on 17 September 2011, retrieved 28 June 2011
- Fenger-Grøn M, Fillman C, Norrild B, Lykke-Andersen J (2005), "Multiple processing body factors and the ARE binding protein TTP activate mRNA decapping" (PDF), Mol. Cell, 20 (6): 905–15, doi:10.1016/j.molcel.2005.10.031, PMID 16364915, archived from the original (PDF) on 6 June 2011, retrieved 28 June 2011 Unknown parameter
|month=ignored (help) - Shaw G, Kamen R (1986), "A conserved AU sequence from the 3' untranslated region of GM-CSF mRNA mediates selective mRNA degradation", Cell, 46 (5): 659–67, doi:10.1016/0092-8674(86)90341-7, PMID 3488815 Unknown parameter
|month=ignored (help) - Chen, C.Y.A.; Shyu, A.B. (1995), "AU-rich elements: characterization and importance in mRNA degradation", Trends in Biochemical Sciences, 20 (11): 465–470, doi:10.1016/S0968-0004(00)89102-1, PMID 8578590
- Isken, O.; Maquat, L.E. (2007), "Quality control of eukaryotic mRNA: safeguarding cells from abnormal mRNA function", Genes & Development, 21 (15): 1833, doi:10.1101/gad.1566807, PMID 17671086
- Obbard, D.J.; Gordon, K.H.J.; Buck, A.H.; Jiggins, F.M. (2009), "Review. The evolution of RNAi as a defence against viruses and transposable elements", Philosophical Transactions of the Royal Society B: Biological Sciences, 364 (1513): 99, doi:10.1098/rstb.2008.0168, PMC 2592633, PMID 18926973
- Brennecke J, Stark A, Russell RB, Cohen SM (2005), "Principles of microRNA-target recognition", PLoS Biol., 3 (3): e85, doi:10.1371/journal.pbio.0030085, PMC 1043860, PMID 15723116 Unknown parameter
|month=ignored (help) - Eulalio, A.; Huntzinger, E.; Nishihara, T.; Rehwinkel, J.; Fauser, M.; Izaurralde, E. (2009), "Deadenylation is a widespread effect of miRNA regulation", RNA, 15 (1): 21, doi:10.1261/rna.1399509, PMC 2612776, PMID 19029310
