دیانای بیرمز
توالیهای دیانای بیرمز یا بیکد (به انگلیسی: Non-coding DNA)،اجزای دیانای یک موجود زنده هستند که توالیهای پروتئین را کد نمیکنند. برخی از دیانایهای بیرمز به مولکولهای عملگر آرانای بیرمز (مثلاً آرانای انتقال (tRNA)، آرانای ریبوزومی (rRNA) و آرانای مداخلهگر (RNAi)) رونویسی میشوند. از دیگر نقشهای دیانای بیرمز میتوان به ترجمه و رونویسی مقررات توالی کد کردن پروتئین، منطقه پیوند ماتریس، مکان آغازش همتاسازی دیانای، سانترومر و تلومرها اشاره کرد.
مقدار دیانای بیرمز در میان گونههای مختلف بسیار متفاوت است. معمولاً درصد کمی از ژنوم مسئول کد کردن پروتئینهاست و درصد زیادی از آنها وظایف تنظیم کنندگی دارند. همانگونه که در دههی ۱۹۶۰ پیشبینی شدهبود وقتی دیانای بیرمز بسیاری وجود دارد، به نظر میرسد بخش بزرگی از آن هیچ عملکرد بیولوژیکیای ندارد. از آن زمان، بهاین بخش غیرفعال "دیانایِ آشغال" میگویند که این نامگذاری بسیار بحثبرانگیز است. [1][2]
پروژهی دانشنامهٔ بینالمللی اجزای دی ان ای (ENCODE)، با روش بیوشیمیایی مستقیم روشن ساخت که حداقل ۸۰ درصد از دیانایِ ژنومی انسان دارای فعالیتهای بیوشیمیایی هستند.[3] هرچند رسیدن به این نتیجه با توجه به دههها تحقیقات و کشف بسیاری از مناطقی که بیرمز اما عملگر هستند، غیرهمنتظره نیست،[4]اما با این وجود برخی از دانشمندان از تلفیق کردن فعالیتهای بیوشیمیایی با عملکرد بیولوژیکی، انتقاد کردند.[5][6][7][8][9] تخمینها میگویند که نسبت ژنوم عملگر بیولوژیک به کل ژنوم در انسان، بر اساس ژنومیک مقایسهای بین ۸ تا ۱۵ درصد متغیر است.[10][11][12] با این حال، برخی دیگر به طور متقابل با تکیهی صرف بر برآورد بر پایهی ژنومیک مقایسهای، با توجه به دامنهی محدود آن، مخالفند چرا که با بررسی زیستشناسی رشدی فرگشتی، نقش دیانای بیرمز در اپی ژنتیک، شبکههای پیچیدهی شبکه تنظیمکننده ژن و فعل و انفعالات ژنتیکی یافت شده است.[13][11][14][15]
بخش بدون کد ژنومیک دیانای

مقدار کل ژنومیک دیانای بین موجودات زنده تغییرات گستردهای دارد و همچنین میزان دیانای بیکد و باکد در ژنوم نیز بسیار متغیر است. برای مثال نشان داده شده است که بیش از ۹۸٪ ژنوم انسان توالیهای بیکد اند و توالیهای پروتئین شامل توالیهای داخل اینترونها و بیشتر نواحی درون ژنی را کد نمیکند، درحالی که ۲۰٪ از ژنوم یک پروکاریوت معمولی را نواحی بیکد تشکیل میدهند.[17][4]
طبق مشاهدهای به نام انیگمای مقدار-سی ، در یوکاریوتها، سایز ژنوم و در نتیجهی آن میزان دیانای بیکد، به پیچیدگی گونه همبسته نیست. برای مثال مقدار ژنوم یک تکسلولی که به آن Polychaos dubium یا Amoeba dubia میگویند، حدود ۲۰۰ برابر بیشتر از مقدار ژنوم دیانای انسان گزارش شده است.[18] با این که اندازهی ژنوم ماهی بادکنکی تاکیفوگو تقریباً یک هشتم ژنوم انسان است، اما همچنان تعداد قابل مقایسهای ژن دارد؛ تقریباً ۹۰٪ از ژنوم تاکیفوگو دیانای بیکد است. بنابراین، بیشتر تفاوت ژنوم بخاطر تغییرات میزان دیانای باکُد نیست، بلکه بخاطر تفاوت در بخش بیکد دیانای است.
در سال ۲۰۱۳ یک رکورد جدید از بهینهترین ژنوم یک یوکاریوت در گونهای به نام علف انبانی گیبا کشف شد که فقط ۳٪ دیانای بیکد دارد و ۹۷٪ باقی دیانای باکد است. بخشهای دیانای بیکد از گیاه حذف شده است و ممکن است چنین بخشهایی برای یک گیاه آنقدری که برای یک انسان ضروری است، ضروری نباشند. [16]
انواع توالیهای بدون کد دیانای
آرانای عملگر بدون کد
آرانای بیرمز به مولکولهای عملگر آرانای میگویند که به پروتئین ترجمه نمیشوند. از آرانایهای بیرمز میتوان به آرانای ریبوزومی، آرانای حامل، پی-آرانای و ریزآرانای اشاره کرد. تخمین زده شده است که ریزآرانایها، حدود ۳۰٪ از فعالیتهای مرتبط با ترجمهی کد شدن پروتئینهای پستانداران را کنترل میکنند و ممکن است نقش حیاتی در پیشرفت یا درمان بیماریهایی مانند سرطان، بیماریهای قلبی-عروقی داشته و همچنین پاسخ دستگاه ایمنی به عفونت باشند.[19]
عناصر تنظیمکنندهی ژنهای نزدیک و دور
سامان دهندههای همسو یا عناصر تنظیم کنندهی ژنهای نزدیک توالیهایی هستند که رونویسی ژنهای نزدیک را کنترل میکنند. خیلی از این عناصر در زیستشناسی تکاملی درگیرند.[20] عناصر تنظیم کنندهی ژنهای نزدیک ممکن است در پایانهی '5 یا '3 بخش ترجمهنشده و یا درون اینترونها واقع شده باشند. عناصر تنظیمکنندهی ژنهای دور رونویسی ژنهای دور را کنترل میکنند.
پروموترها رونویسی از یک ژن خاص را آسانتر میکنند و معمولاً در بالای ناحیهی کد شده هستند. توالیهای افزاینده هم ممکن است تاثیرات گسترده و مختلفی بر روی میزان رونویسی ژنها داشته باشند.[21]

اینترونها
اینترونها نواحی بیکد و کدونها نواحی باکد ژن هستند. اینترونها به آرانای پیامرسان پیشرو رونویسی میشوند اما در نهایت توسط فرایند پیرایش آرانای در طی پروسهی تبدیل به آرانای پیامرسان بالغ حذف میشوند. بیشتر اینترونها به عنوان عناصر متحرک ژنتیکی ظاهر میشوند. [22] [23]
مطالعه برروی اینترونهای گروه ۱ تکیاختگان تتراهایمن نشان میدهد که بعضی از اینترونها عناصر خودخواه ژنتیکی اند و نسبت به میزبان خنثیاند، در واقع یعنی آنها خود را از کنار اگزونها بودن در مراحل پردازش آرانای خلاص میکنند و بدون توجه به حضور اینترونها، بایاس بیان بین اللها ایجاد نمیکنند.[22]
بعضی از اینترونها بنظر میرسد که عملکردهای بیولوژیکی مهمی دارند و احتمالاً در عملکرد ریبوزیم، فعالیت آرانای حامل و آرانای ریبوزومی و همچنین بیان ژنهای مرتبط با کد کردن پروتئین را کنترل میکنند. [22]
شبهژنها
شبهژنها توالیهایی از دیانای هستند که به ژنهای شناخته شدهای که قابلیت کد کردن پروتئین خود را از دست دادهاند و یا دیگر در سلول بیان نمیشوند، مربوط اند. شبهژنها از انتقال مجدد و یا تکثیر ژنومیک ژنهای عملگر ایجاد میشوند و نهایتاً تبدیل به "فسیل ژنومیک" میشوند که یعنی در طی جهشهایی در بخشهایی مانند ناحیهی درونی پروموتر ژن و یا تغییر مرگبار در ترجمهی ژن (شامل جایگشت یافتن کدون خاتمه یا تغییر فریم ریبوزومی) تغییراتی میکنند که باعث جلوگیری از رونویسی ژنها و غیرعملگر شدن آنها میشود.[24]
شبهژنهایی که از انتقال مجدد یک آرانای واسط به دست میآیند بهعنوان شبهژن پردازش شده شناخته میشوند؛ ژنهایی که از بقایای ژنومیک ژنهای تکثیر شده و یا باقیماندهی ژنهای غیرفعال بهدست میآیند بهعنوان ژنهای پردازش نشده شناخته میشوند.[24] یک نوع دیگر از شبهژنها از انتقال ژنهای عملگر بخش میتوکندری از سیتوپلاسم به هسته حاصل میشوند که با عنوان بخش هستهای میتوکندریای دیانای یا NUMT شناخته میشود.[25] این نوع از شبهژن در بسیاری از گونههای یوکاریوتها ایجاد میشود.
با این حال قانون بازگشتناپذیری دولو میگوید که از دست رفتن عملکرد شبهژنها احتمالاً دائمی است، ولی ممکن است ژنهای ساکت شده (ژنهایی که دیگر بیان نمیشوند و تبدیل به شبهژن شدهاند)، بتوانند پس از میلیونها سال مجدداً فعال شوند و عملکرد خود را در کد کردن توالیهای پروتئین بهدست آورند[26] و تا به حال تعداد قابلتوجهی از شبهژنها بهصورت فعالی رونویسی شدهاند.[24][27] چون که فرض میشود شبهژنها تحت شرایط تکاملی بدون تغییر باقی میمانند، میتوان از آنها به عنوان مدلهای مناسبی برای شناخت نوع و تکرارهای انواع جهشهای ژنتیکی خودجوش استفاده کرد.[28]
تکرار توالیها، عناصر متحرک ژنتیکی و عناصر ویروسی
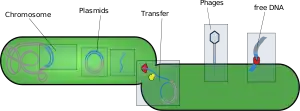
سازههای جابجاشدنی و ژنهای انتقالی، عناصر متحرک ژنتیکی هستند. توالیهای تکرارشونده ژنهای انتقالی که شامل عناصر هستهای پراکندهی بلند و عناصر هستهای پراکندهی کوتاه هستند، بخش بزرگی از توالیهای ژنومیک بسیاری از گونهها حساب میشوند. توالیهای Alu که در دستهی عناصر هستهای پراکندهی کوتاه قرار میگیرند، فراوانترین عناصر محرک ژنوم انسان اند. بعضی مثالهایی یافت شده که نشان میدهد عناصر هستهای پراکندهی کوتاه، نقش کنترلکننده در رونویسی و کد کردن پروتئین بعضی از ژنها دارند.[29][30][31]
تلومرها
تلومرها نواحی تکرارشوندهی دیانای هستند که در بخش انتهایی کروموزوم قرار گرفته و از آن در برابر زوال رفتن کروموزوم در حین فرایند همانندسازی دیانای محافظت میکند. تلومر در واقع بخش اساسیای از سلول انسان است که برروی عمر سلول تاثیر دارد.[32][33] مطالعات اخیر نشان میدهند که عملکرد تلومرها کمک به پایداری خودشان است. به رونویسیهایی که از اشتقاق تلومر به دست میآید، تلومرِ به صورت تکرارشوندهی شامل آرانای (به انگلیسی: (Telomeric repeat-containing RNA (TERRA) میگویند. وظیفهی TERRA برقرار نگهداشتن فعالیت تلومراز و درست کردن اندازهی انتهای کروموزوم است.[34]
جستارهای وابسته
منابع
- https://www.britannica.com/topic/ENCODE#ref1185700
- Pennisi, E. (6 September 2012). "ENCODE Project Writes Eulogy for Junk DNA". Science. 337 (6099): 1159–1161. doi:10.1126/science.337.6099.1159. PMID 22955811.
- The ENCODE Project Consortium (2012). "An integrated encyclopedia of DNA elements in the human genome". Nature. 489 (7414): 57–74. Bibcode:2012Natur.489...57T. doi:10.1038/nature11247. PMC 3439153. PMID 22955616..
- Costa, Fabrico (2012). "7 Non-coding RNAs, Epigenomics, and Complexity in Human Cells". In Morris, Kevin V. Non-coding RNAs and Epigenetic Regulation of Gene Expression: Drivers of Natural Selection. Caister Academic Press. ISBN 978-1904455943.
- Robin McKie (24 February 2013). "Scientists attacked over claim that 'junk DNA' is vital to life". The Observer.
- Sean Eddy (2012) The C-value paradox, junk DNA, and ENCODE بایگانیشده در ۲۳ اکتبر ۲۰۱۳ توسط Wayback Machine, Curr Biol 22(21):R898–R899.
- Doolittle, W. Ford (2013). "Is junk DNA bunk? A critique of ENCODE". Proc Natl Acad Sci USA. 110 (14): 5294–5300. Bibcode:2013PNAS..110.5294D. doi:10.1073/pnas.1221376110. PMC 3619371. PMID 23479647.
- Palazzo, Alexander F.; Gregory, T. Ryan (2014). "The Case for Junk DNA". PLoS Genetics. 10 (5): e1004351. doi:10.1371/journal.pgen.1004351. ISSN 1553-7404. PMC 4014423. PMID 24809441.
- Dan Graur, Yichen Zheng, Nicholas Price, Ricardo B. R. Azevedo1, Rebecca A. Zufall and Eran Elhaik (2013). "On the immortality of television sets: "function" in the human genome according to the evolution-free gospel of ENCODE". Genome Biology and Evolution. 5 (3): 578–90. doi:10.1093/gbe/evt028. PMC 3622293. PMID 23431001.
- Ponting, CP; Hardison, RC (2011). "What fraction of the human genome is functional?". Genome Research. 21: 1769–1776. doi:10.1101/gr.116814.110. PMC 3205562. PMID 21875934.
- Kellis, M.; et al. (2014). "Defining functional DNA elements in the human genome". PNAS. 111 (17): 6131–6138. Bibcode:2014PNAS..111.6131K. doi:10.1073/pnas.1318948111. PMC 4035993. PMID 24753594.
- Chris M. Rands, Stephen Meader, Chris P. Ponting and Gerton Lunter (2014). "8.2% of the Human Genome Is Constrained: Variation in Rates of Turnover across Functional Element Classes in the Human Lineage". PLoS Genet. 10 (7): e1004525. doi:10.1371/journal.pgen.1004525. PMC 4109858. PMID 25057982.
- Carey, Nessa (2015). Junk DNA: A Journey Through the Dark Matter of the Genome. Columbia University Press. ISBN 978-0-231-17084-0.
- Mattick JS, Dinger ME (2013). "The extent of functionality in the human genome". The HUGO Journal. 7 (1): 2. doi:10.1186/1877-6566-7-2.
- Morris, Kevin, ed. (2012). Non-Coding RNAs and Epigenetic Regulation of Gene Expression: Drivers of Natural Selection. Norfolk, UK: Caister Academic Press. ISBN 1-904455-94-8.
- "Worlds Record Breaking Plant: Deletes its Noncoding "Junk" DNA". Design & Trend. May 12, 2013. Retrieved 2013-06-04.
- Elgar G, Vavouri T (July 2008). "Tuning in to the signals: noncoding sequence conservation in vertebrate genomes". Trends in Genetics. 24 (7): 344–52. doi:10.1016/j.tig.2008.04.005. PMID 18514361.
- Gregory TR, Hebert PD (April 1999). "The modulation of DNA content: proximate causes and ultimate consequences". Genome Research. 9 (4): 317–24. doi:10.1101/gr.9.4.317 (inactive 2019-07-03). PMID 10207154.
- Li M, Marin-Muller C, Bharadwaj U, Chow KH, Yao Q, Chen C (April 2009). "MicroRNAs: control and loss of control in human physiology and disease". World Journal of Surgery. 33 (4): 667–84. doi:10.1007/s00268-008-9836-x. PMC 2933043. PMID 19030926.
- Carroll SB (July 2008). "Evo-devo and an expanding evolutionary synthesis: a genetic theory of morphological evolution". Cell. 134 (1): 25–36. doi:10.1016/j.cell.2008.06.030. PMID 18614008.
- Visel A, Rubin EM, Pennacchio LA (September 2009). "Genomic views of distant-acting enhancers". Nature. 461 (7261): 199–205. Bibcode:2009Natur.461..199V. doi:10.1038/nature08451. PMC 2923221. PMID 19741700.
- Nielsen H, Johansen SD (2009). "Group I introns: Moving in new directions". RNA Biology. 6 (4): 375–83. doi:10.4161/rna.6.4.9334. PMID 19667762.
- Mandal, Ananya (26 Feb 2016). Sally Robertson, ed. "Article".
- Zheng D, Frankish A, Baertsch R, Kapranov P, Reymond A, Choo SW, Lu Y, Denoeud F, Antonarakis SE, Snyder M, Ruan Y, Wei CL, Gingeras TR, Guigó R, Harrow J, Gerstein MB (June 2007). "Pseudogenes in the ENCODE regions: consensus annotation, analysis of transcription, and evolution". Genome Research. 17 (6): 839–51. doi:10.1101/gr.5586307. PMC 1891343. PMID 17568002.
- Lopez, J. V., Yuhki, N., Masuda, R., Modi, W., & O'Brien, S. J. (1994). Numt, a recent transfer and tandem amplification of mitochondrial DNA to the nuclear genome of the domestic cat. Journal of Molecular Evolution, 39(2), 174-190.
- Marshall CR, Raff EC, Raff RA (December 1994). "Dollo's law and the death and resurrection of genes". Proceedings of the National Academy of Sciences of the United States of America. 91 (25): 12283–7. Bibcode:1994PNAS...9112283M. doi:10.1073/pnas.91.25.12283. PMC 45421. PMID 7991619.
- Tutar Y (2012). "Pseudogenes". Comparative and Functional Genomics. 2012: 1–4. doi:10.1155/2012/424526. PMC 3352212. PMID 22611337.
- Petrov DA, Hartl DL (2000). "Pseudogene evolution and natural selection for a compact genome". The Journal of Heredity. 91 (3): 221–7. doi:10.1093/jhered/91.3.221. PMID 10833048.
- Ponicsan SL, Kugel JF, Goodrich JA (April 2010). "Genomic gems: SINE RNAs regulate mRNA production". Current Opinion in Genetics & Development. 20 (2): 149–55. doi:10.1016/j.gde.2010.01.004. PMC 2859989. PMID 20176473.
- Häsler J, Samuelsson T, Strub K (July 2007). "Useful 'junk': Alu RNAs in the human transcriptome". Cellular and Molecular Life Sciences (Submitted manuscript). 64 (14): 1793–800. doi:10.1007/s00018-007-7084-0. PMID 17514354.
- Walters RD, Kugel JF, Goodrich JA (August 2009). "InvAluable junk: the cellular impact and function of Alu and B2 RNAs". IUBMB Life. 61 (8): 831–7. doi:10.1002/iub.227. PMC 4049031. PMID 19621349.
- Mariela J, Florian L M, Ji-Hye P, Emily T, Shan J, Andrew A, Ergun S, Maria K, Alexei P, Juan C, James W H, Eleftheria M, and Ronald A D (6 Jul 2011). "Telomerase reactivation reverses tissue degeneration in aged telomerase deficient mice". Vancouver style error: initials (help)
- Sahin E, Depinho R (25 Mar 2010). "Linking functional decline of telomeres, mitochondria and stem cells during ageing". Vancouver style error: punctuation (help)
- Cusanelli E, Chartrand P (May 2014). "Telomeric noncoding RNA: telomeric repeat-containing RNA in telomere biology". Wiley Interdisciplinary Reviews: RNA. 5 (3): 407–19. doi:10.1002/wrna.1220. PMID 24523222.
- مشارکتکنندگان ویکیپدیا. «Noncoding DNA». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۹ دسامبر ۲۰۱۶.
پیوند به بیرون
- Plant DNA C-values Database در باغ گیاهشناسی، کییو
- Fungal Genome Size Database در مؤسسه استونیایی جانورشناسی و گیاهشناسی
- ENCODE: The human encyclopaedia در رمزگذاری طبیعت Nature ENCODE ایانسیاُدیای
