تلومر
تلومر (Telomere) پایانه فیزیکی کروموزمهای خطی میباشد که از یک توالی غیر کدکننده تشکیل یافتهاست. در پستانداران تلومر مرکب از تعداد متغیری توالیهای تکراری، با رمز TTAGGG میباشد. توالی تکرار شونده تلومری در سایر جانداران نیز دارای فرمول کلی مشابهی است که این شباهت نشاندهنده نقش حیاتی و در نتیجه محفوظ باقیماندن ساختار تلومر میباشد. کشف کارکرد تلومر و آنزیم تلومراز در دهه ۱۹۹۰ توسط سه دانشمند آمریکایی به نامهای الیزابت بلکبرن، خانم کرول گریدر و آقای جک زوستاک، منجر به اهدای جایزه نوبل سال ۲۰۰۹ به این سه نفر شد.
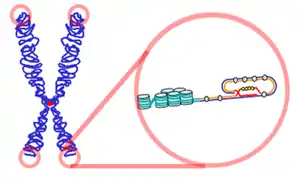
با وجود اینکه تلومر به صورت DNA دورشتهای (Double strand) است اما در انتهاییترین منطقه یک توالی کوتاه (۱۴ تا ۱۶ نوکلوئیدی) غنی از T و A دارد که با جفت شدن با یک ناحیه داخلی تر تلومر ساختاری به نام حلقهT یا T-loop به وجود میآیدکه با اتصال پروتئینهای متصل شونده به تلومر تثبیت میگردد
کارکرد تلومر
انتهای مولکول خطی که معمولاً چسبنده میباشد، با حضور تلومر و ساختمان آن این چسبندگی را از دست میدهد. از این رو تلومر مانند سپری کروموزم را از ایجاد پیوستگیهای نابجا و غیر صحیح و تخریب بهوسیله آنزیمهای اگزونوکلئاز سلول محافظت مینماید. همچنین، مشخص شدهاست که تلومر درمکان یابی و جایگیری کروموزم در هسته و خاموشی انتخابی ژنهای مجاور خود، ایفای نقش میکند علاوه برا ین، تلومر نقش اساسی دیگری در ابتدای سنتز خود ایفا میکند که در ارتباط با رونویسی میباشد. در واقع در انتهای یک DNA خطی کار آنزیمهای همانند ساز در رشته پیرو به مشکل برخورد میکند چرا که این آنزیمها برای برداشتن آخرین پرایمر و قراردادن آخرین بازها، پایانه OH3'- در اختیار ندارند. آنزیم تلومراز (Telomerase) این مشکل را با سنتز تلومر حل میکند.
کنترل اندازه تلومر
با توجه به اینکه در هر دور همانندسازی با فعالیت تلومراز به طول تلومر افزوده میشود[1] به نظر میرسد که اندازه تلومر پیوسته افزایش مییابد اما در واقع چنین مسئلهای رخ نمیدهد بلکه حتی در سلولهای سوماتیک جانداران پر سلولی مثل انسان طول تلومر پیوسته کاهش مییابد. این سلولها طی تمایز، توانائی تولید آنزیم تلومراز را از دست دادهاند بنابراین در هر دور همانند سازی در این سلولها آنزیمهای درگیر درانتهای تلومر با مشکل عدم وجود پایانه روبرو شده وقسمتی از انتهای تلومر همانندسازی نمیگردد. این مسئله طی تقسیمات متوالی باعث کاهش تدریجی طول تلومر میگردد.[2]
البته سلولهای سوماتیکی که به سرعت تقسیم میشوند و سلولهای تولید مثلیٍ، توانائی تولیدمثل تلومراز را دارند وبنابراین دچار این کاهش در طول تلومر نمیگردد.
علاوه بر آنچه بالا گفته شد احتمال وجود سیستم کاهش طول وابسته به پروتئین که به اصطلاح باعث فرسایش یا خوردگی تلومر میشود نیز مطرح شدهاست.
بدیهی است که تلومر در سلولهای عصبی و همچنین عضله قلبی و باقی سلولهایی که فاقد مکانیسم تقسیم هستند. تغییر اندازه پیدا نمیکنند.
مشاهدات و آزمایشها انجام شده بر روی سلولهای مخمر نشان دادهاند که نوعی تعادل بین کاهش وافزایش طول تلومر در این سلولها وجود دارد. بدین صورت که سیستمهای مولکولی خاصی با کاهش تدریجی طول تلومر و رسیدن آن به یک آستانه معین امکان افزایش طول آن را فراهم میآورند.
به عنوان مثال پیشنهاد شدهاست که پروتئین متصل شونده به تلومر به نامTelomere Binding Protein دارای تعدادی جایگاه اتصال روی تلومر است، هرگاه که این پروتئین به تعداد معین (یا بیشتر از آن) در اتصال با تلومر وجود داشته باشد تلومراز امکان اتصال و سنتز دنباله تلومر را نمییابد. اما وقتی به علت کاهش طول تلومر، چه با فرسایش و چه با همانندسازی ناقص، تعداد جایگاههای TBPو در نتیجه تعداد مولکولهای این پروتئین بر روی تلومر کاهش پیدا کند، تلومراز اجازه مییابد به تلومر متصل شده و آن را طویل کند این طویل شدن باعث ایجاد جایگاههای جدید برای اتصال تعدادی از مولکولهای این پروتئین به تلومر میشود که این امر دوباره باعث جلوگیری از افزایش طول مجدد تلومر توسط تلومراز شده و تعادل بین کاهش وافزایش طول حفظ میشود.[3]
تلومر وطول عمر
همانطورکه گفته شد وجود تلومر به عنوان سپر حفاظتی برای محافظت از ژنوم سلول یوکاریوتی اهمیت حیاتی دارد وکاهش زیاد طول تلومر منجر به از بین رفتن توانائی عملکرد این ساختار در انجام وظایف خود شده ودرنهایت سلول را به سوی نابودی میبرد. مشاهدات متعدد نشان دادهاند که سلولهای سوماتیک انسانی طبیعی، که در سیستم در شیشه کشت داده شدهاند، تنها میتوانند تعداد محدودی تقسیم را انجام دهد و پس از آن رشد آنها متوقف شده و سلولها دچار سالخوردگی میشوند پس از اینکه کاهش طول تلومر به حد بحرانی برسد فرکانس بالائی از نوترکیبیهای کروموزمی مشاهده میشود همین امر میتواند عامل سالخوردگی ونهایتاٌ نابودی سلول گردد. این اتفاق درونجانداری نیز رخ میدهد و تحقیقات ارتباط طول عمر موجودات زنده پرسلولی وکاهش طول تلومر را نشان میدهند. به عنوان مثال در یک بررسی بر روی موش صحرایی مشاهده شد که کاهش طول عمر تلومر در بافتهای سوماتیک این جانور در جنس نر بیشتر (سریعتر) از جنس مادهاست؛ و این مطلب با طول عمر آنها که در مادهها بیش از نرهاست مطابقت دارد.
همین مسئله باعث شد که بحثهائی پیرامون افزایش مدت عمر بشر و حتی جاودانگی بشر مطرح گردد و دانشمندان در تلاش هستند که ابتدا اینکار را با ساختن حیوانات آزمایشگاهی مثلاً موشهائی با عمرهای طولانیتر ازحد معمول به مرحله عمل برسانند.
تلومر و سرطان
برخلاف سلولهای سوماتیک طبیعی، سلولهای سرطانی میتوانند بطورمتوالی تقسیم شده و خطوط سلولی نامحدود تولید نمایند. (مثل سلولهای هلا) برای داشتن چنین خصوصیتی، این سلولها میباستی قادر به حفظ طول تلومر خود باشند. این سلولها میتوانند این توانایی را با تولید آنزیم تلومراز بدست آوردند. در واقع ایجاد توانایی تولید این آنزیم که میتواند توسط ویروسها یا سایر عوامل جهش زا، در سلولهای سوماتیک بدن ایجاد گردد یکی از عوامل سرطانی شدن این سلولها بهشمار میرود.
از سوی دیگر همین مسئله از سوی پژوهشگران به عنوان پاشنه آشیلی برای سلولهای سرطانی تلقی میشود. چراکه با طراحی درمانهایی که سازوکار حفظ تلومر را در این سلولها هدف قرار میدهد میتوان این سلولهای نامیرا را به سلولهایی با تقسیم محدود و در واقع میرا تبدیل کرده و نابود نمود.
یکی از راحترین راهها برای انجام اینکار هدف قراردادن تلومراز است. چراکه این آنزیم مسئول نامیرایی در سلولهای سرطانی است. اما از سوی دیگر مشخص شدهاست که گاهی چنین مباررزهای تأثیر معکوس میدهد به عنوان مثال در یک مطالعه درموشهای آزمایشگاهی مشاهده شدهاست که این نوع درمان اگر چه باعث کاهش توان حیاتی سلولهای سرطانی میشود اما فراوانی لنفوما را در این موشها افزایش میدهد. این امر ممکن است به علت افزایش امکان ایجاد نابسامانیهای کروموزمی به علت کاهش طول تلومرها باشد به بیان دیگر در این روش امکان به وجود آمدن خطوط سلولی جدید که نسبت به درمان مقاومت نشان میدهند وجود دارد.
ایراد دیگر این روش این است که پس از تحت تأثیر قرار دادن آنزیم تلومراز (که به طرق مختلف مثلاً طراحی شناساگرهای مکمل برای بخش رِنا این ریبونوکلئوپروتئین که کار آن را مختل میکند، امکانپذیر است) بایدمنتظر ماند تا عوامل کاهش طول تلومر به تدریج اندازه تلومرها را کاهش دهند و این امر مستلزم سپری شدن چندین مرحله تقسیم سلولی است؛ بنابراین، درمانهای مبتنی بر توقف فعالیت تلومراز نمیتوانند بهطور مستقیم وبی واسطه بر سلولهای سرطانی تأثیرگذار باشند وراه بهتر برای انجام درمان براساس تلومر هدف قراردادن پروتئینهای شرکتکننده در ساختمان آن برای از هم پاشاندن این ساختار یا هدف قراردادن پروتئینهای شرکتکننده در مسیرها و واکنشهای منتهی به ایجاد ساختار یا هدف قراردادن پروتئینهای آن میباشد؛ که این امر خود مستلزم شناخت دقیقتر از ساختمان تلومر و چگونگی تشکیل آن با انجام پژوهشهای بیشتر در این زمینهاست.
جستارهای وابسته
منابع
- molecular biology of the cell;forth edition: alberts,... page 265
- همان
- Lee WK, Cho MH (۲۰۱۶). «Nucleic Acids Research». PUBMED.
