جابهجایی کروموزومی
در علم ژنتیک جابهجایی کروموزومی یک اختلال در کروموزوم است. کروموزومها در بدن انسان به صورت ۲۳جفت قرار دارند. جابهجایی کروموزومی به دلیل جابهجایی میانکروموزومهایِ غیرِ جفت اتفاق میافتد. این اختلال زمانی اتفاق میافتد که کروموزوم میشکند و قطعات آن به کروموزوم دیگری متصل میشود. بهطور کلی جابهجایی کروموزومی به دو دسته تقسیم میشود: ۱) جابهجایی متقابل (دوطرفه) ۲) جابهجایی روبرتسونی. زمانی که بخشی از یک کروموزوم به کروموزوم دیگری متصل میشود، ممکن است دو ژن با هم ادغام شوند. جابهجایی در سیتوژنتیک یا کاریوتیپ یک سلول آسیبدیده مورد بررسی قرار میگیرد. جابهجاییها میتوانند متعادل (در یک تبادل برابر شامل موادی بدون اطلاعات ژنتیکی اضافه یا از دست رفته و در حالت ایدئال دارای عملکرد کامل و بدون عیب و نقص) یا نامتعادل (تبادل نابرابر میان مواد کروموزومها که باعث به وجود آمدن ژنهای اضافه یا ازبینرفته آنها میشود) باشد.[1][2] در هر دو حالت جابهجایی میتواند متعادل یا نامتعادل باشد.[3]
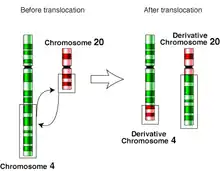
تاریخچه
در سال ۱۹۳۸، کارل ساکس در آزمایشگاه بیولوژی دانشگاه هاروارد مقالهای را با عنوان ""Chromosome Aberrations Induced by X-rays" منتشر کرد که نشان میداد که پرتوها میتوانند با ایجاد جابهجایی کروموزومی منجر به تغییرات ژنتیکی زیادی در موجودات زنده بشود. این مقاله آغازی در زمینهٔ یاختهشناسی پرتوها شد و سبب شد تا کارل ساکس به عنوان پدر یاختهشناسی پرتوها شناخته شود. علم یاختهشناسی پرتوها تأثیر پرتوها را بر سلولهای زنده بررسی میکند.
توضیحات تکمیلی در مورد سلولهای توموری که جابهجایی در آنها شناسایی شده بود، توسط شخصی به نام تئودور بووری ارائه شد. بووری فرض کرد که سلولهای توموری دارای «کروموزومهای تحریک رشد» هستند که باعث ایجاد تومورهای بدخیم میشوند. در آن زمان امکان شناسایی تغییرات دقیق کروموزومها وجود نداشت، اما امروزه میدانیم که فرضیهٔ بووری صحیح بودهاست و جابهجایی عامل مشترکی است که در سلولهای آسیبدیده مشاهده میشود. جابهجایی سبب تولید آنکوژنهایی در بدن میشود که عامل دگرگونیهای بدخیم هستند.[4]
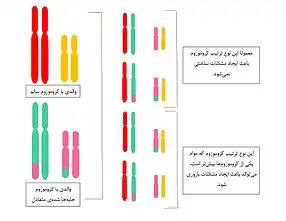
جابهجاییهای متقابل
جابهجاییهای متقابل معمولاً شامل جابهجایی مواد میان کروموزومهای غیرجفت است.
احتمال وقوع این خطا به شکل ۱ نفر از میان ۵۰۰[5] کودک تازه به دنیا آمده تا ۱ نفر از ۶۲۵[6] کودک انسان تخمین زده شدهاست. چنین جابهجاییهایی معمولاً بدون خطر بوده و به کمک تشخیص پیش از تولد شناسایی میشوند. با این وجود، داشتن جابهجایی کروموزومی متعادل، باعث افزایش خطر ساخت گامتهایی با جابهجایی کروموزومی نامتعادل شده که باعث سقط جنین یا تولد کودکان همراه با ناهنجاری میشود. مشاورهٔ ژنتیکی و ازمایشهای ژنتیک برای خانوادههایی که احتمال جابهجایی در آنها وجود دارد پیشنهاد میشود. بیشتر افراد حامل جابهجایی متعادل سالم هستند و علامتی ندارند، اما نزدیک به ۶درصد از آنها علایمی مانند اوتیسم، کمتوانی ذهنی یا ناتوانیهای مادرزادی را به همراه دارند. خراب شدن یک ژن یا عدم بیان ژن در یک نقطهٔ شکسته شده میتواند باعث ایجاد علایم مذکور شود.
آنچه اهمیت دارد، آن است که میان جابهجایی کروموزومی رخ داده در فرایند گامتزایی است که بر اثر اختلال در فرایند میوز به وجودامده و جابهجایی حاصل از تقسیم سلولی در سلولهای سومتیک که ناشی از خطا در فرایند میتوز است، تفاوت قایل شویم. جابهجایی به وجود آمده در تقسیم میوز باعث ایجاد ناهنجاری در تمام سلولهای فرزند میشود، در حالیکه جابهجایی در سلولهای سومتیک باعث ایجاد ناهنجاری تنها در سلولهای لایهٔ تحت تأثیر قرار گرفته میگردد، مانند لوسمی مزمن مغز استخوان که به دلیل جابهجایی کروموزومی در کروموزوم فیلادلفیا به وجود میآید. کروموزوم فیلادلفیا نام ناهنجاریای است که بر اثر جابهجایی میان کروموزومهای ۹ و ۲۲ به وجود میآید. در این جابهجایی ژن BCR در کروموزوم ۲۲ و پروتوآنکوژن ABL در کروموزوم ۹ ادغام شده و باعث بهوجود آمدن ژن BCR-ABL میشود. این ژن باعث ایجاد پروتئینی میشود که سبب تقسیم سلولی غیرقابل کنترل میگرد. به کروموزوم ۲۲ تغییر یافته کروموزوم فیلادلفیا گفته میشود.
جابهجایی روبرتسونی
جابهجایی روبرتسونی نمونهای از جابهجایی کروموزومی است که به وسیلهٔ شکستگی در سانترومر یا نواحی نزدیک سانترومر در یک جفت کروموزوم آکروسنتریک به وجود میآید. کروموزوم آکروسنتریک به کروموزومی گفته میشود که سنترومر آن به یکی از دو انتهای کروموزوم نزدیکتر بوده و سبب کوتاه شدن یکی از بازوهای کروموزوم نسبت به بازوی دیگر میشود. جابهجایی متقابل باعث ایجاد یک کروموزوم متاسنتریک و یک کروموزوم بسیار کوچک میشود که ممکن است بر اثر تأثیر کوچکی از ارگانیسم خارج شود، زیرا تعداد ژنهای محدودی را در خود دارد. کروموزوم متاسنتریک کروموزومی با شکل X است که طول بازوهای آن با هم دقیقاً برابر باشند. در این حالت تنها ۴۵ کروموزوم در بدن انسان باقی میماند، زیرا دو کروموزوم با هم ترکیب شدهاند.[7] این تغییر تأثیری روی فنوتیپها ندارد، زیرا تنها ژنهای موجود روی بازوی کوتاه کروموزوم آکروسنتریک در بخشهای تکراری ژنوم انسان قرار دارند (ژنهای ساماندهندهٔ هسته).
جابهجایی روبرتسونی در تمام حالتهای ممکن برای ترکیب کروموزومهای آکروسنتریک دیده شدهاست. شایعترین جابهجایی کروموزومی در بدن انسان، جابهجایی میان کروموزومهای ۱۳ و ۱۴ است که در حدود ۰٫۹۷ از ۱۰۰۰ کودک تازه به دنیا آمده دیده شدهاست.[8] حاملان جابهجایی کروموزومی روبرتسونی علایم ظاهری مشخصی ندارند و ناهنجاریای در فنوتیپهای آنها دیده نمیشود، این در حالی است که خطر گامت نامتعادل و به تبع آن سقط جنین یا تولد فرزندانی با مشکل ناهنجاری در آنها وجود دارد. بهطور مثال حاملان جابهجایی روبرتسونی در کروموزوم ۲۱ شانس بالاتری برای داشتن فرزندانی با بیماری سندروم داون دارند. از این نوع جابهجایی با نام «جابهجایی داون» یاد میشود. این موضوع به دلیل اشکال در هنگام تفکیک کروموزومهای خواهر در فرایند گامتزایی ایجاد میشود. خطر انتقال توسط مادر (۱۰٪) بیشتر از خطر انتقال توسط پدر (۱٪) است. در جابهجایی روبرتسونی در کروموزوم ۱۴ خطر کمی برای تکرار کروموزوم ۱۴ یکی از والدین بر اثر فرایند رهایی تریزومی وجود دارد. منظور از رهایی تریزومی پدیدهای است که در آن سلول تخم به اشتباه حامل ۳ کروموزوم شده و یکی از کروموزومها را از دست میدهد تا به فرایند عادی بازگردد. در صورتی که ۲ کروموزوم باقی مانده در سلول مربوط به یکی از والدین باشد، پدیدهٔ تکرار کروموزوم یکی از والدین به وجود میآید.
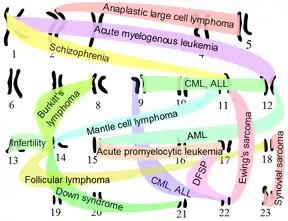
تأثیر در بیماریها
تعدادی از بیماریها که بر اثر جابهجایی کروموزومی ایجاد میشود به شرح زیر هستند:
سرطان: بخشی از انواع سرطانها بر اثر جابهجایی کروموزومی ایجاد میشوند. این موضوع بهطور مشروح در صفحات سرطان خون، لوسمی حاد مغز استخوان و لوسمی مزمن مغز استخوان توضیح داده شدهاست. جابهجایی میتواند باعث ایجاد تومورهای بدخیم مانند سارکوم یوئینگ بشود.
ناباروری: زمانی که یکی از والدین حامل جابهجایی متعادل باشد، اگرچه والد نشانهای ندارد، اما جنین در رحم مادر دوام نمیآورد.
سندروم داون: این سندروم در کمتر از ۵ درصد از مواردی که دارای جابهجایی روبرتسونی از بازوی بزرگ کروموزوم ۲۱ به کروموزوم بازوی بزرگ کروموزوم ۱۴ هستند، اتفاق میافتد.[9]
جابهجایی کروموزومی در میان کروموزومهای سلول جنسی میتواند باعث ایجاد برخی شرایط ژنتیکی مانند سندروم دلاچاپل میشود. در این سندروم، جابهجایی ژن SRY از کروموزوم Y به کروموزوم X اتفاق میافتد.
تشخیص در جنین
در حال حاضر سریعترین آزمایش برای تشخیص بیماری در کودکان استفاده از آزمایش نمونهگیری از پرزهای جفتی است که در زمان ۱۱ تا ۱۳ هفتگی بارداری انجام میشود. در این روش پرزهای کوریونی از جفت جنین استخراج شده و مورد آزمایش قرار میگیرد. از سوی دیگر کروموزوم جنین میتواند از طریق تکنیک آمنیوسنتز مورد آزمایش قرار بگیرد. این روش در ۱۶ هفتگی بارداری قابل استفاده است. در این روش مقدار کمی از مایع اطراف جنین در رحم مادر توسط سوزن خارج شده و مشکلات ژنتیکی بررسی میشود. اگرچه روش اول دقت پایینتری دارد، اما امکان انجام آن در سهماههٔ اول بارداری باعث برتری میشود. لازم است ذکر شود که آزمایشهای نامبرده تنها مشخص میکنند که جنین دارای مواد کروموزوم بیشاز حد یا کمتر از حد معمول است، اما مشخص نمیکند که آیا جنین تحت تأثیر مقدار غیرمعمول قرار میگیرد یا خیر، هرچند که معمولاً کودکان با کروموزوم نامتعادل نیاز به مراقبتهای پزشکی دارند.[10]
در کروموزوم
نمایش
برای نمایش جابهجایی کروموزومی از سامانهٔ جهانی نامگذاری سیتوژنتیک انسان (ISCN) استفاده میشود.[12] نمایش به شکل
(t(A;B)(p1;q2 برای نمایش جابهجایی میان کروموزومهای A و B استفاده میشود. پرانتز دوم نشاندهندهٔ جایگاه دقیق درون کروموزومهای A و B است که در آن p نشانگر بازوی کوتاه کروموزوم و q نشانگر بازوی بلند آن است. اعداد بعد از p و q نمایشدهندهٔ ناحیه، بند و زیربندی است که در هنگام رنگزنی کروموزوم دیده شدهاست.[13] برای اطلاعات بیشتر میتوانید به صفحهٔ جایگاه کروموزومی مراجعه کنید.
مثال
برای فهم دقیقتر سمبلها و خلاصههای مثال زیر به نشانههای سیتوژنتیک مراجعه فرمایید.
| جابهجایی | بیماری مرتبط | ژنها/پروتئینهای ادغام شده | |
| دومین | اولین | ||
| (t(8;14)(q24;q32 | لنفوم بورکیت | ناحیهٔ @IGH روی کروموزوم ۱۴که شامل ژن برای تولید زنجیرهای از پادتن انسانی است. این ناحیه باعث تحریک بیشاز اندازهٔ پروتئین ادغام شده میشود. | ژن c-myc در کروموزوم ۸ که باعث میشود پروتئین ادغامی توانایی لنفوسیت-پرولیفراتیو را داشته باشد. |
| (t(11;14
(q13;q32) |
لنفوم سلول منتل[14] | ناحیهٔ @IGH[14] روی کروموزوم ۱۴که شامل ژن برای تولید زنجیره از پادتن انسانی است. این ناحیه باعث تحریک بیش از اندازهٔ پروتئین ادغام شده میشود. | پروتئین Cyclin-D1[14] که توسط ژن CCND1 در بدن انسان تولید میشود و روی کروموزوم ۱۱ قرار دارد. به پروتئین ادغامی توانایی سلول-پرولیفراتیو میدهد. |
| (t(14;18
(q32;q21) |
لنفوم فولیکولار (در ۹۰ درصد موارد)[15] | پروتئین Bcl-2 که تنظیمکنندهٔ مرگ سلول است و روی کروموزوم ۱۸ قرار دارد و به پروتئین ادغامی خاصیت ضد آپوپتوزی میدهد. | ناحیهٔ @IGH[14] روی کروموزوم ۱۴که شامل ژن برای تولید زنجیرهای از پادتن انسانی است. این ناحیه باعث تحریک بیش از اندازهٔ پروتئین ادغام شده میشود. |
| ((t(10;(various
((q11;(various) |
سرطان پاپیلاری تیروئید[16] | PTC (سرطان پاپیلاری تیروئید) - حفرهای برای همه یا بسیاری از ژنهای دیگر[16] | پروتوآنکوژن رت[16] روی کروموزوم ۱۰ |
| (t(2;3
(q13;p25) |
سرطان فولیکولار تیروئید[16] | گیرندهٔ تکثیرفعال پروکسیزوم گاما (PPARγ1)[16] روی کروموزوم ۳ | پروتئین PAX 8[16] روی کروموزوم ۲ |
| (t(8;21
(q22;q22)[15] |
لوسمی حاد میلوبلاستیک | پروتئین AML1 (تولید شده از ژن RUNX1) روی کروموزوم ۲۱ (در حدود ۷ درصد موارد AML
(لوسمی حاد مغز استخوان)، نسبت به درمان توسط سیتوزین آرابینوزید نتایج مطلوبی داشتهاست).[15] |
پروتئین ETO (تولید شده از ژن RUNX1T1) روی کروموزوم ۸ |
| (t(9;22
(q34;q11) کروموزوم فیلادلفیا |
لوسمی حاد لنفاوی - لوسمی حاد مغز استخوان | پروتئین BCR که توسط ژن BCR روی کروموزوم ۲۲ تولید میشود.[17] | پروتئین ABL1 که توسط ژن ABL1 روی کروموزوم ۹ تولید میشود.[17] |
| (t(15;17
(q22;q21)[15] |
لوسمی پرومیلوسیتیک حاد | پروتئین RAR-α که توسط ژن RARA روی کروموزوم ۱۷ تولید میشود. | پروتئین PML روی کروموزوم ۱۵[15] |
| (t(12;15
(p13;q25) |
لوسمی حاد مغز استخوان - فیبروسارکوما مادرزادی- سرطان سینهٔ ترشحی | دریافتکنندهٔ TrkC روی کروموزوم ۱۵ | پروتئین TEL روی کروموزوم ۱۲ |
| (t(9;12
(p24;p13) |
CML (لوسمی مزمن مغز استخوان)
ALL (لوسمی حاد لنفاوی) |
TEL روی کروموزوم ۱۲ | JAK روی کروموزوم ۹ |
| (t(12;21
(p12;q22) |
ALL (لوسمی حاد لنفاوی) | AML1 روی کروموزوم ۲۱ | TEL روی کروموزوم ۱۲ |
| (t(11;18
(q21;q21) |
لنفوم MALT[18] | MLT[18] | API-2 |
| (t(1;11
(q42.1;q14.3) |
اسکیزوفرنی[11] | ||
| (t(2;5
(p23;q35) |
لنفوم سلول بزرگ آنا پلاستیک | NPM1 | ALK |
| (t(11;22
(q24;q11.2-12) |
سارکوم یوئینگ | EWS | FLI1 |
| (t(17;22 | تومور درماتوفیبروسارکوما پروتوبرنس
(DFSP) |
پروتئین پلاکت رشد مشتق شده از فاکتور بی (PDGFB) | Collagen I روی کروموزوم ۱۷ |
| (t(1;12
(q21;p13) |
لوسمی حاد مغز استخوان | ||
| (t(X;18
(p11.2;q11.2) |
تومور بدخیم سینوویال سارکوما | ||
| t(1;19)(q10;p10) | تومور الیگو دندرو گلیوما و تومور مغزی الیگوآستروسیتوما | ||
| (t(17;19
(q22;p13) |
ALL (لوسمی حاد لنفاوی) | ||
| t(7,16) (q32-34;p11) or t(11,16) (p11;p11) | فیبرو میکسوئید سارکوما | CREB3L2 یا CREB3L1 | FUS |
منابع
- "EuroGenTest Chromosome Translocations". Retrieved March 5, 2016.
- "Balanced translocation". Retrieved March 4, 2016.
- "Chromosomal Translocations". Archived from the original on 15 March 2016. Retrieved 28 December 2016.
- «Human Chromosome Translocations and Cancer | Learn Science at Scitable». www.nature.com. دریافتشده در ۲۰۱۶-۱۲-۳۰.
- Caroline Mackie Ogilvie; Paul N Scriven (December 2002). "Meiotic outcomes in reciprocal translocation carriers ascertained in 3-day human embryos". European Journal of Human Genetics. European Society of Human Genetics. 10 (12): 801–806. doi:10.1038/sj.ejhg.5200895. PMID 12461686. Retrieved December 26, 2008.
- M. Oliver-Bonet; J. Navarro1; M. Carrera; J. Egozcue; J. Benet (October 2002). "Aneuploid and unbalanced sperm in two translocation carriers: evaluation of the genetic risk". Molecular Human Reproduction. Oxford University Press for the European Society for Human Reproduction and Embryology. 8 (10): 958–963. doi:10.1093/molehr/8.10.958. ISSN 1460-2407. PMID 12356948. Retrieved December 26, 2008.
- Hartwell, Leland H. (2011). Genetics: From Genes to Genomes. New York: McGraw-Hill. p. 443. ISBN 978-0-07-352526-6.
- E. Anton; J. Blanco; J. Egozcue; F. Vidal (April 29, 2004). "Sperm FISH studies in seven male carriers of Robertsonian translocation t(13;14)(q10;q10)". Human Reproduction. Oxford University Press. 19 (6): 1345–1351. doi:10.1093/humrep/deh232. ISSN 1460-2350. PMID 15117905. Retrieved December 25, 2008.
- http://www.nhs.uk/Conditions/Downs-syndrome/Pages/Causes.aspx
- Johne. Ott, Arthur Robinson, Davidc. Peakman. "Balanced translocations" (PDF). Archived from the original (PDF) on 17 May 2017. Retrieved 30 December 2016.
- "Identification of genes from a schizophrenia-linked translocation breakpoint region". Genomics. 73 (1): 123–6. April 2001. doi:10.1006/geno.2001.6516. PMID 11352574.
- Schaffer, Lisa. (2005) International System for Human Cytogenetic Nomenclature S. Karger AG ISBN 978-3-8055-8019-9
- "Characteristics of chromosome groups: Karyotyping". rerf.jp. Radiation Effects Research Foundation. Retrieved June 30, 2014.
- "Detection of translocation t(11;14)(q13;q32) in mantle cell lymphoma by fluorescence in situ hybridization". Am. J. Pathol. 154 (5): 1449–52. May 1999. doi:10.1016/S0002-9440(10)65399-0. PMC 1866594. PMID 10329598.
- Burtis, Carl A.; Ashwood, Edward R.; Bruns, David E. (December 16, 2011). "44. Hematopoeitic malignancies". Tietz Textbook of Clinical Chemistry and Molecular Diagnostics. Elsevier Health Sciences. pp. 1371–1396. ISBN 978-1-4557-5942-2. Retrieved November 5, 2012.
- Chapter 20 in: Robbins Basic Pathology. Philadelphia: Saunders. 2003. ISBN 1-4160-2973-7. 8th edition.
- "Philadelphia chromosome-positive leukemias: from basic mechanisms to molecular therapeutics". Ann. Intern. Med. 138 (10): 819–30. May 2003. doi:10.7326/0003-4819-138-10-200305200-00010. PMID 12755554.
- Page 626 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson (1997). Robbins Basic Pathology. Philadelphia: Saunders. ISBN 1-4160-2973-7. 8th edition.