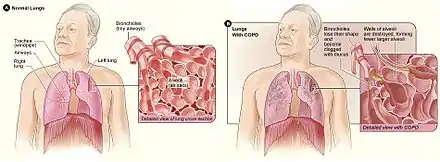
بیماری مزمن انسدادی ریه
بیماری انسدادی مزمن ریه (به انگلیسی: Chronic obstructive pulmonary disease یا COPD) که همچنین به نامهای دیگری همچون بیماری انسدادی مزمن شُش (به انگلیسی: chronic obstructive lung disease یا COLD) و بیماری مزمن انسدادی مسیر هوایی (به انگلیسی: chronic obstructive airway disease یا COAD) معروف است، نوعی بیماری انسدادی ریوی است که با محدود بودن علامت مسیر هوایی به صورت مزمن شناسایی میشود. این بیماری به مرور زمان بدتر میشود. اصلیترین نشانههای این بیماری شامل مواردی همچون تنگی نفس، سرفه و ایجاد خلط سینه است.[1] بیشتر افرادی که برونشیت مزمن دارند، به COPD مبتلا میشوند.[2]
| بیماری مزمن انسدادی ریه | |
|---|---|
 | |
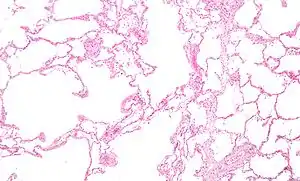
| آسیبهای قابل مشاهده در یک ریه پیآمد آمفیزم بعلت کشیدن سیگار. در تصویر ذرات کربن به وضوح دیده میشوند. | |
| طبقهبندی و منابع بیرونی | |
| تخصص | پزشکی ریه |
| آیسیدی-۱۰ | J40–J44, J47 |
| آیسیدی-9-CM | 490–492, 494–496 |
| اُمیم | ۶۰۶۹۶۳ |
| دادگان بیماریها | 2672 |
| مدلاین پلاس | 000091 |
| ئیمدیسین | med/۳۷۳ emerg/99 |
| پیشنت پلاس | بیماری مزمن انسدادی ریه |
| سمپ | C08.381.495.389 |
معمولترین عامل ایجاد COPD استعمال دخانیات است، البته عوامل دیگری همچون آلودگی هوا و وراثت نیز نقش کمتری در ایجاد آن دارند.[3] در کشورهای در حال توسعه، یکی از منابع اصلی آلودگی هوا، آتشهای خوراکپزی و بخاریهایی است که تهویهٔ مناسبی ندارند. در صورتی که افراد به صورت مداوم در معرض این عوامل تحریککننده باشند، ریههای آنها دچار التهاب و واکنش همراه با آماس میشود که ناشی از تنگ شدن مسیرهای هوایی کوچک و بافت ریوی موسوم به آمفیزم است.[4] تشخیص این بیماری بر اساس تنگی نفس صورت میگیرد که میزان آن با آزمایشهای عملکرد ریه اندازهگیری میشود.[5] بر خلاف بیماری آسم، تنگی نفس در این بیماری با استفاده از دارو کاهش نمییابد.
با کم کردن میزان قرار گرفتن در معرض عوامل شناخته شده این بیماری میتوان از آن جلوگیری کرد. این امر با تلاشهایی برای کاهش سیگار کشیدن و افزایش کیفیت هوای محیطهای داخلی و خارجی نیز همراه است. درمانهای بیماری COPD شامل این موارد میشود: ترک سیگار، واکسیناسیون، توانبخشی و مواد استنشاقی گشادکننده برونش و کورتیکواستروئیدها. درمان طولانیمدت با اکسیژن یا پیوند ریه میتواند برای برخی افراد مناسب باشد.[4] برای آنهایی که بدتر شدن و حاد شدن را به صورت دورهای دارند، ممکن است به استفاده از داروهای متعدد و بستری شدن در بیمارستان نیاز باشد.
در جهان، این بیماری حدود ۳۲۹ میلیون نفر، تقریباً پنج درصد از جمعیت دنیا را مبتلا ساختهاست. در سال ۲۰۱۲، این بیماری سومین عامل اصلی در مرگ افراد بوده که بیش از ۳ میلیون نفر را به کام مرگ فرستادهاست.[6] این میزان مرگ به دلیل افزایش نرخ سیگارکشیدن و بالارفتن میانگین سنی جمعیت در بسیاری از کشورها افزایش مییابد.[7]
علامتها و نشانههای بیماری
 |
Wheezing
صدای شنیده شده توسط گوشی پزشکی. |
| در پخش این پرونده مشکل دارید؟ ویکیپدیا:راهنمای رسانه را ببینید. | |
معمولترین نشانههای بیماری COPD تولید خلط سینه دشواری تنفس و ایجاد سرفه است.[8] این نشانهها به مدتی طولانی همراه بیمار خواهند بود.[4] هنوز مشخص نیست که انواع مختلفی از بیماری COPD وجود دارد یا خیر.[3] در حالی که در گذشته، این بیماری به دو نوع آمفیزم و برونشیت مزمن تقسیم میشد، اما آمفیزم تنها توصیف تغییرات ریوی است و خودش بیماری به حساب نمیآید و برونشیت مزمن نیز توصیف نشانهای است که میتواند همراه با COPD ظاهر شود یا این که نشود.[1]
سرفه
سرفهٔ مزمن معمولاً اولین نشانهای است که اتفاق میافتد. در صورتی که سرفه در بیش از سه ماه یک سال و در دو سال متوالی همراه با تولید خلط و بدون هیچ گونه دلیلی وجود داشته باشد طبق تعریف میتواند نشانهٔ برونشیت مزمن باشد. این شرایط ممکن است که قبل از پیشرفت کامل COPD اتفاق بیفتد. ممکن است میزان خلطی که ایجاد میشود در ساعتها و روزهای مختلف متفاوت باشد. در برخی موارد امکان دارد که سرفه در بیمار وجود نداشته باشد یا تنها گاهی اوقات ایجاد شود و همچنین ممکن است به همراهش خلط رخ ندهد. برخی افراد ممکن است نشانههای این بیماری را با سرفهٔ افراد سیگاری اشتباه بگیرند. ممکن است بسته به عوامل فرهنگی یا اجتماعی برخی خلط را فرو برند یا اینکه تف کنند. سرفههای شدید ممکن است باعث شکستگی دندهها یا از دست دادن هوشیاری به مدت کوتاه گردد. افرادی که به بیماری COPD مبتلا میشوند، معمولاً سابقهٔ بیماری سرماخوردگی معمولی دارند که مدت زمانی طولانی به طول میانجامد.[8]
تنگی نفس
تنگی نفس اغلب نشانهای است که افراد را بیش از همه اذیت میکند.[9] معمولاً افراد این نشانه را این گونه توصیف میکنند: «نفس کشیدن مرا به زحمت میاندازد،» «حس میکنم که نفسم بند آمده» یا «نمیتوانم نفس عمیقی بکشم و هوای زیادی را وارد ریههایم کنم.»[10] البته ممکن است که عبارات مختلفی در فرهنگهای گوناگون استفاده شود. معمولاً تنگی نفس با اعمال فشار بدتر میشود و مدتی طولانی ادامه مییابد و به مرور اوضاع به مراتب ناخوشایندتر نیز میگردد.[8] در مراحل پیشرفته این اتفاق ممکن است که در مواقع استراحت و در همه حال رخ دهد.[11][12] افرادی که بیماری COPD دارند، این بیماری نشانهٔ آشفتگی و کیفیت بد زندگی آنهاست.[8] بسیاری از افراد با نمونههای شدید بیماری COPD مجبور به نفس کشیدن از طریق لبهای فشرده میشوند و این امر در برخی افراد میتواند تنگی نفس را بهتر کند.[13][14]
ویژگیهای دیگر
در بیماری COPD ممکن است که بازدم بیشتر از دم طول بکشد.[15] تنگ شدن قفسهٔ سینه ممکن است اتفاق بیفتد[8] اما معمول نیست و ممکن است که به خاطر مشکل دیگری ایجاد شده باشد.[9] آنهایی که مسیر هواییشان مسدود شده، ممکن است خس خس کردن داشته باشند یا هنگام معاینه سینه با گوشی پزشکی و موقعی که میخواهند نفس را به داخل ریهها بفرستند، صدای خفیفی شنیده شود.[15] گشاد شدن سینه یکی از علائم بیماری COPD است. اما نسبتاً نامحتمل است.[15] نشستن به شکل چمباتمه با بدتر شدن بیماری رخ میدهد.[2] نمونههای پیشرفتهٔ بیماری COPD باعث فشار بالا در شریانهای شُش میشود که باعث مواردی همچون از کار افتادن بطن راست قلب میشود.[4][16][17] این وضعیت نارسایی قلبی ریوی نامیده میشود و به تورم پاها[8] و تورم ورید گردن[4] منجر میگردد. بیماری COPD بیش از هر بیماری ریوی دیگری عامل نارسایی قلبی ریوی است.[16] از زمان استفاده از اکسیژن مکمل، دیگر نارسایی قلبی ریوی کمتر اتفاق میافتد.[2] بیماری COPD اغلب به همراه وضعیتهای دیگری نیز پیش میآید که بخشی از آن به خاطر عوامل خطر مشترک است.[3] این وضعیتها شامل این موارد میشوند: بیماری ایسکمیک قلب، فشار خون بالا، مرض دیابت، از بین رفتن حجم ماهیچهها، پوکی استخوان، سرطان ریه، اختلال اضطراب، افسردگی.[3] ممکن است در کسانی که به نمونهٔ شدید این بیماری مبتلا هستند، که احساس همیشگی خسته بودن علامتی طبیعی باشد.[8] چماقی شدن ناخن انگشتها ویژگی انحصاری بیماری COPD نیست و لازم است تحقیقات سریعی برای روشن شدن احتمال بیماری سرطان ریه انجام شود.[18]
نوع شدید
نوع شدید و حاد COPD به این شکل تعریف میشود: افزایش تنگی نفس، افزایش تولید خلط سینه، تغییر رنگ خلط سینه از سفید شفاف به سبز یا زرد، یا افزایش میزان سرفه در شخصی که به COPD مبتلاست.[15] این امر میتواند نشانههای تنفس بیش از حد همچون سریع شدن تنفس، بالارفتن میزان تپش قلب، عرق ریختن، استفاده شدید از ماهیچههای گردن، یک نوع کبودی آبی رنگ روی پوست و آشفتگی یا در نمونههای بیماری بسیار شدید رفتار تهاجمی باشد.[15][19] همچنین ممکن است که هنگام معاینه با گوشی پزشکی از ریهها صدای ترق توروق شنیده شود.[20]
عامل بیماری
عامل اصلی بیماری COPD کشیدن دخانیات یا قرار گرفتن در معرض بیماری به خاطر شغل و آلودگی آتشهای محیطهای داخلی است که در برخی از کشورها عوامل بسیار مهمی هستند.[1] عموماً این نوع در معرض قرار گرفتن باید در طول چندین دهه اتفاق بیفتد تا عوارض این بیماری ظاهر شود.[1] سابقهٔ ژنتیکی فرد نیز میتواند بر روی این خطر تأثیرگذار باشد.[1]
سیگار کشیدن
دقت کنید که معیار استفاده شده برای زنان متفاوت از مردان است.
[21]عامل خطر اصلی برای بیماری COPD در سطح جهانی دخانیات است.[1] حدود بیست درصد از افراد سیگاری در معرض خطر ابتلا به COPD هستند،[22] و نیمی از آنهایی که در تمام عمرشان سیگار کشیدهاند، به این بیماری مبتلا خواهند شد.[23] در ایالات متحده و بریتانیا، ۸۰ تا ۹۵ درصد از افراد مبتلا به COPD یا در حال حاضر سیگاری هستند یا این که قبلاً سیگار میکشیدهاند.[22][24][25] احتمال پیشرفت بیماری با میزان زمان کلی قرار گرفتن در معرض دود سیگار افزایش مییابد.[26] علاوه بر اینها، زنان بیشتر از مردان در برابر اثرات زیانبار سیگار کشیدن آسیبپذیر هستند.[25] برای افراد غیرسیگاری، استنشاق دود سیگار افراد سیگاری در بیست درصد از موارد عامل این بیماری بودهاست.[24] دیگر انواع دخانیات مانند، ماریجوانا، سیگار برگ و قلیان نیز ممکن است ایجاد خطر نمایند.[1] زنانی که در دورهٔ بارداری خود سیگار میکشند، ممکن است که خطر ابتلای کودک خود به بیماری COPD را افزایش دهند.[1]
آلودگی هوا
آن دسته از آتشهای پختوپز خانه که بهندرت تهویه میشوند و اغلب با سوختهایی همچون سوخت زیستتوده همچون چوب و فضولات حیوانات ایجاد میشوند، باعث آلودگی هوای محیطهای داخلی میشوند و یکی از عوامل اصلی بیماری COPD در کشورهای درحال توسعه محسوب میشوند.[27] این نوع آتشها توسط حدود سه میلیارد انسان برای پختوپز و گرم کردن به کار میروند که در نتیجه سلامت این افراد تحت تأثیر این آتشها قرار میگیرد و در این میان زنان به خاطر در معرض بودن زیادتر تأثیر بیشتری میبینند.[1][27] این سوختها به عنوان سوخت اصلی در هشتاد درصد خانههای هندوستان، چین و کشورهای جنوب صحرای آفریقا به کار میروند.[28] مردمی که در شهرهای بزرگ زندگی میکنند، در مقایسه با مردم مناطق روستایی بیشتر در معرض بیماری COPD هستند.[29] در حالی که آلودگی هوای شهری عاملی کمکی در تشدید این بیماری است، نقش کلی آن به عنوان عامل بیماری COPD نامشخص میباشد.[1] در مناطقی که کیفیت هوای نامناسبی دارند، به عنوان مثال آنهایی که تحت تأثیر گازهای خروجی هستند، عموماً میزان بیشتری بیماری COPD مشاهده میشود.[28] اگرچه به اعتقاد بسیاری از کارشناسان اثر کلی آن در برابر دود سیگار کمتر است.[1]
در معرض بودن به خاطر حرفه
در معرض بودن شدید و به مدت طولانی در محیطهای کاری که آلوده به گرد و خاک، مواد شیمیایی و دود است، خطر ابتلا به بیماری COPD را در افراد سیگاری و غیرسیگاری افزایش میدهد.[30] به اعتقاد کارشناسان در معرض بودن به خاطر محیط کاری عامل ده تا بیست درصد موارد ابتلای این بیماری است.[31] کارشناسان ایالات متحده معتقدند که در این کشور این موارد، عامل بیماری تا سی درصد ابتلای کسانی باشد که هیچگاه سیگار نکشیدهاند و در کشورهایی که قوانین الزامآور مناسبی ندارند، احتمال خطر بیشتری وجود دارد.[1] تعدادی از صنایع و منابع عوامل این بیماری شامل میشوند که از این قبیل میتوان[28] به جاهایی که گرد و غبار زیادی دارند، مشاغلی که با موادی همچون کادمیم و ایزوسینات درگیر هستند و دودهای ناشی از جوشکاری اشاره کرد.[30] کارهای کشاورزی نیز یکی از موارد خطرناک بهشمار میرود.[28] در بعضی مشاغل، خطرات برابر با نصف تا دو پاکت سیگار در روز برآورد شدهاست.[32] در معرض غبار سیلیس بودن نیز میتواند باعث بیماری COPD گردد که برای سیلیکوزیس خطر غیرمرتبط گزارش شدهاست.[33] اثرات منفی قرار گرفتن در معرض گرد و غبار و همچنین دود سیگار رو به افزایش و احتمالاً بیش از اینها است.[32]
عامل وراثت
عامل وراثت در پیشرفت و افزایش بیماری COPD نقش دارد.[1] احتمال این امر در میان بستگان افرادی که این بیماری را دارند و سیگاری هستند در مقایسه با غیرسیگاریها بیشتر است.[1] در حال حاضر، تنها عامل خطر ناشی از وراثت که مشخص شده، کمبود آلفا-۱ آنتیتریپسین (AAT) است.[34] این خطر عملاً در صورتی است که شخص دارای کمبود آلفا-۱ آنتیتریپسین همچنین سیگاری هم باشد.[34] این عامل در یک تا پنج درصد از موارد باعث ابتلا به بیماری میشود[34][35] و این شرایط در میان تقریباً هر سه تا چهار نفر از ده هزار نفر وجود دارد.[2] عوامل وراثتی دیگری نیز تحت مطالعه و تحقیق قرار دارند[34] که این عوامل میتواند زیاد باشد.[28]
سایر عوامل
عوامل دیگری هستند که ارتباط کمتری با بیماری COPD دارند. میزان خطر در افراد فقیر بیشتر است، اگرچه مشخص نیست که خودِ فقر باعث این بیماری است یا عوامل دیگر مرتبط با فقر همچون، آلودگی هوا و سوءتغذیه.[1] شواهد اولیه نشان میدهد که افراد مبتلا به آسم و بیشفعالیت مسیر هوا در معرض خطر بیشتری از بیماری هستند.[1] عوامل مرتبط با تولد از قبیل وزن کم هنگام تولد نیز ممکن است در این امر نقش داشته باشد، درست همانطور که بیماریهای مسری دیگری همچون اچآیوی و مرض سل با این بیماری ارتباط دارند.[1] عفونت تنفسی همچون ذاتالریه به نظر در افزایش بیماری COPD، حداقل در بزرگسالان تأثیری ندارند.[2]
تشدید بیماری
تشدید حاد بیماری (بدتر شدن ناگهانی علائم)[36] معمولاً با عفونت یا آلایندههای محیطی یا گاهی اوقات با عوامل دیگری همچون درمانهای نامناسب بیشتر میشود.[37] عفونت در ۵۰ تا ۷۵ درصد از موارد، منشأ آلودگی به این بیماری است.[37][38] که در این میان باکتریها ۲۵ درصد، ویروسها ۲۵ درصد و هر دو با هم نیز ۲۵ درصد را به خود اختصاص دادهاند.[39] آلایندههای محیطی هم شامل کیفیت هوای داخلی و هم کیفیت هوای خارجی میشود.[37] قرار گرفتن در معرض دود سیگار خود یا دیگران خطر را افزایش میدهد.[28] همچنین هوای سرد نیز میتواند نقش داشته باشد، چرا که بیشتر موارد تشدید بیماری معمولاً در زمستان اتفاق میافتد.[40] کسانی که به بیماریهای شدید پنهان دیگر مبتلا هستند، موارد تشدید بیماری بیشتری دارند: در بیماری خفیف ۱٫۸ در هر سال، در بیماری حالت متوسط دو تا سه در هر سال، و حالت شدید ۳٫۴ در سال.[41] کسانی که موارد بسیاری از تشدید بیماری را دارند، میزان کاهش عملکرد ریههایشان بیشتر است.[42] آمبولی ریوی (لخته شدن خون در ریهها) میتواند نشانههای بیماری را در افرادی که از قبل مبتلا به COPD شدهاند، بدتر نماید.
فیزیولوژی آسیب
این بیماری نوعی بیماری ریوی خفهکننده است که در آن محدود شدن مسیر هوایی به صورت مزمن و کاملاً قابل برگشت است و عمل بازدم به صورت کامل (به صورت محبوس شدن هوا) به سختی انجام میشود.[3] مسیر هوایی محدود و نامناسب نتیجهٔ از کارافتادگی بافت ریه (معروف به امفیزیم) و کاهش مسیرهای هوایی کوچک معروف به برونش مسدودکننده نیز میباشد. نتیجهٔ نسبی این دو عامل در میان افراد متفاوت است.[1] از بین رفتن مسیرهای هوایی در حالت شدید میتواند باعت تشکیل کیسههای هوایی بزرگ شود — که به bullae معروف است و جایگزین بافت ریهها میشود. این نوع تشکیل بیماری امفیزم bullous نام دارد.[43]
بیماری COPD به عنوان واکنش ویژه و مزمن عفونتی در مقابل عوامل محرکی شکل میگیرد که وارد ریه شده و همراه با تنفس پیشرفت میکند.[1] عفونتهای باکتریایی مزمن نیز میتوانند به این حالت عفونتی بیفزایند.[42] سلولهای عفونتی که درگیر این بیماری میشوند شامل neutrophil granulocyteها و یاخته بیگانهخوار بزرگ هستند که دو نوع از سلولهای گلبول سفید خونی بهشمار میروند. افرادی که سیگار میکشند همچنین دارای eosinophil هستند که مشابه آسم است. بخشی از این واکنش سلولی از سوی واسطهای عفونی از قبیل chemotactic factors ایجاد میشود. روندهای دیگری که در آسیب دیدن ریهها دخیل هستند، شامل تنش اکسایشی ایجاد شده توسط مقادیر زیاد رادیکالهای آزاد در دود دخانیات هستند و با سلولهای عفونتی و ازکارافتادگی بافت متصلکننده در ریهها به وسیلهٔ پروتازها آزاد میگردند که بازدارندههای پروتازی به حد کافی جلوی آنها را نگرفتهاست. نابودی بافت متصلکنندهٔ ریهها چیزی است که در نهایت منجر به امفیزم میشود و به دنبال آن جریان هوا کم میشود و در نهایت جذب و آزادسازی اندک گازهای تنفسی را به دنبال میآورد.[1] بخشی از نابودی ماهیچهای که در بیماری COPD رخ میدهد، ممکن است به خاطر آن دسته از واسطهای عفونی باشد که توسط ریهها وارد خون میشود.[1]
محدود شدن مسیرهای هوایی به دلیل عفونت و آسیب دیدن درون آنها رخ میدهد. بدین وسیله فرد نمیتواند در نهایت به صورت کامل هوا را از ریههای خود خارج کند. بیشترین میزان محدود شدن مسیر هوایی هنگام بیرون دادن نفس اتفاق میافتد، چرا که در این زمان فشار موجود در سینه این مسیرها را متراکم میسازد.[44] در نتیجه، در هنگام آغاز تنفس جدید هوای بیشتری از تنفس قبلی درون ریهها باقی میماند و همین امر باعث افزایش حجم هوای موجود در ریهها در زمان معین میگردد، روندی که تورم حاد یا حبس هوا نام دارد.[44][45] برخی موارد شامل اندکی از hyperresponsiveness مسیر هوایی به عوامل محرک میشود که در آسم یافت میشود.[2]
سطح پایین میزان اکسیژن و در نهایت، سطح بالایی از دیاکسید کربن در خون میتواند به خاطر کم بودن تبادل گاز اتفاق بیفتد که ناشی از کاهش تجدید هوا در اثر مسدود شدن مسیرهای هوایی است و التهاب شدید و کاهش میزان نفس کشیدن را موجب میشود.[1] هنگام تشدید بیماری، التهاب مسیرهای هوایی نیز افزایش مییابد که باعث زیاد شدن میزان التهاب شدید و محدود شدن مسیر هوای تنفسی و بدتر شدن روند انتقال گاز شود. این امر ممکن است منجر به تجدید هوای ناکافی و در نهایت پایین آمدن سطح اکسیژن خون گردد.[4] سطح پایین اکسیژن، در صورتی که به مدت زیادی ادامه یابد، میتواند باعث تنگ شدن عروق خونی در ریهها شود، در حالی که امفیزم باعث از بین رفتن مویرگهای موجود در ریهها میگردد. هر دوی این تغییرات باعث افزایش فشار خون در عروقهای ریوی میشود که ممکن است cor pulmonale را به دنبال آورد.[1]
تشخیص
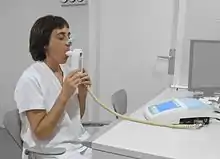
معاینه جهت تشخیص بیماری COPDباید در تمامی افراد بین سنین ۳۵ تا ۴۰ سال که دارای کوتاهی تنفس، سرفهٔ مزمن، تولید خلط یا سرماخوردگیهای مداوم در طول فصل زمستان هستند و کسانی که سابقهٔ قرار گرفتن در معرض عوامل خطر بیماری را دارند صورت گیرد.[8][9] تنفسسنجی به دنبال آن صورت میگیرد تا تشخیص تأیید شود.[8][46]
تنفسسنجی
آزمایش تنفسسنجی اندازهٔ مسدود بودن مسیر هوایی موجود را میسنجد و عموماً بعد از استفادهٔ bronchodilator به کار میرود که نوعی درمان برای باز کردن مسیرهای هوایی است.[46] دو مؤلفهٔ اصلی با این تشخیص اندازهگیری میشوند: حجم هوای تنفسی تحمیلی در یک ثانیه (FEV1) از تنفس که بیشترین میزان هوایی است که میتواند در اولین ثانیهٔ تنفس وارد ریهها گردد و ظرفیت حیاتی تحمیلی (FVC) که بیشترین میزان هوایی است که میتواند در یکنفس عمیق وارد ریهها شود.[47] معمولاً ۷۵ تا ۸۰ درصد از میزان FVC در اولین ثانیه خارج میشود[47] و FEV 1نسبت FVC کمتر از هفتاد درصد در شخصی با علائم COPD نشان میدهد که وی مبتلا به این بیماری شدهاست.[46] بر اساس این معیارها، آزمایش تنفسسنجی میتواند از قبل به تشخیص در سالمندان بینجامد.[46] معیار مؤسسهٔ ملی مزایای کلینیکی علاوه بر اینها شامل اندازهٔ FEV 1 کمتر از هشتاد درصد پیشبینی شدهاست.[9] شواهد استفاده از تنفسسنجی برای افرادی که فاقد علائم هستند در تلاش برای تشخیص زودتر شرایط نتیجه قاطعی ندارد و در نتیجه در حال حاضر توصیه نمیشود.[8][46] بیشترین میزان جریان تنفسسنجی (حداکثر سرعت نفس کشیدن)، که معمولاً در تشخیص بیماری آسم به کار میرود، برای شناسایی COPD کافی نیست.[9]
شدت
روشهای زیادی برای تعیین تأثیر COPD بر روی افراد وجود دارد.[8] پرسشنامه اصلاح شده شورای تحقیقات پزشکی انگلستان (nMRC) یا تست ارزشیابی COPD (CAT) پرسشنامههای سادهای هستند که ممکن است برای تعیین شدت علائم استفاده شوند. اعداد اختصاص داده شده به CAT بین ۰ تا ۴۰ میباشد و هرچه این عدد بزرگتر باشد، بیماری شدیدتر است.[48] تنفسسنجی ممکن است به تعیین شدت محدودیت عبور جریان هوا کمک کند.[8] این میزان معمولاً بر اساس FEV1 است و به عنوان درصد «معمولی» پیشبینیشده برای سن، جنسیت، قد و وزن فرد میباشد.[8] هر دو رهنمود آمریکایی و اروپایی توصیه میکنند که توصیههای درمانی تا حدی بر پایه FEV1 قرار بگیرد. رهنمودهای GOLD پیشنهاد میکند افراد بر اساس ارزیابی نشانهها و محدودیت عبور جریان هوا به چهار گروه تقسیم شوند.[8] کاهش وزن و ضعف عضلات و همچنین وجود بیماریهای دیگر نیز باید مد نظر قرار گیرد.[8]
تستهای دیگر
انجام رادیوگرافی قفسه سینه و شمارش کامل خون ممکن است در زمان تشخیص، احتمال ابتلا به شرایط دیگر را از میان بردارد.[49] نشانههای مخصوص در رادیوگرافی شامل گشاد شدن ششها، دیافراگم صاف، فضای خالی افزایش یافته پشت جناغ و آبکیسه میباشد، این در حالی است که میتواند بیماریهای ریوی دیگر مانند سینهپهلو، اِدِم ریه یا پنوموتوراکس را شامل نشود.[50] اسکن رزلوشن بالای توموگرافی رایانهای از سینه ممکن است پخش آمفیزم در ریه را نشان دهد و میتواند احتمال ابتلا به بیماریهای ریوی دیگر را از میان بردارد.[2] این مورد، غیر از مواقعی که عمل جراحی انجام شدهاست، به ندرت بر مدیریت بیماری تأثیر میگذارد. فشار گاز خون شریانی برای تعیین نیاز به اکسیژن استفاده میشود و برای افرادی که FEV1 آنها کمتر از ۳۵٪ پیشبینی شدهاست، افرادی که اشباع اکسیژن خون آنها کمتر از ۹۲٪ است و افرادی که علائم نارسایی احتقانی قلبی دارند توصیه میشود. در مناطقی از جهان که نقص آنتی تریپسین آلفا-۱ شایع است، باید از افراد دچار COPD (مخصوصاً افراد زیر ۴۵ سال که آمفیزم روی قسمتهای تحتانی ریههایشان اثر گذاشتهاست) آزمایش گرفته شود.[8]
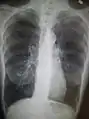 Chest X-ray demonstrating severe COPD. Note the small heart size in comparison to the lungs.
Chest X-ray demonstrating severe COPD. Note the small heart size in comparison to the lungs. A lateral chest x-ray of a person with emphysema. Note the barrel chest and flat diaphragm.
A lateral chest x-ray of a person with emphysema. Note the barrel chest and flat diaphragm.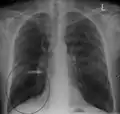 Lung bulla as seen on CXR in a person with severe COPD
Lung bulla as seen on CXR in a person with severe COPD A severe case of bullous emphysema
A severe case of bullous emphysema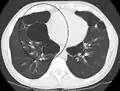 Axial CT image of the lung of a person with end-stage bullous emphysema.
Axial CT image of the lung of a person with end-stage bullous emphysema.
تشخیص افتراقی
COPD باید از دلایل دیگر تنگی نفس مانند نارسایی قلب، آمبولی ریه، سینه پهلو و پنوموتوراکس متمایز شود. اکثر افراد مبتلا به COPD بهطور اشتباه فکر میکنند که آسم دارند.[15] تفاوت بین آسم و COPD بر اساس نشانههای آن، سابقه سیگار کشیدن و اینکه محدودیت جریان هوا با گشادکننده برونش در دمسنجی برگشتپذیر است یا خیر.[51] سل نیز ممکن است با سرفه مزمن همراه باشد و باید در مناطقی که رواج دارد در نظر گرفته شود.[8] شرایط غیرمعمول که ممکن است به همین روش خود را نشان دهند شامل دیسپلازی ریوی و برونشیولیت اوبلیتران میشود.[49] برونشیت مزمن ممکن است با جریان هوای معمولی رخ دهد و در این شرایط به عنوان COPD طبقهبندی نمیشود.
پیشگیری
میتوان از طریق کاهش سیگار و بهبود کیفیت هوا از به وجود آمدن اکثر موارد COPD جلوگیری کرد.[28]واکسیناسیون آنفلوآنزا سالانه در افراد دارای COPD باعث کاهش شدت بیماری، بستری شدن و مرگ میشود.[52][53]واکسیناسیون پنوموکوک نیز ممکن است مفید باشد.[52]
ترک سیگار
دور نگه داشتن مردم از استعمال دخانیات یکی از جنبههای کلیدی جلوگیری از COPD است.[54] سیاستهای دولتها، سازمانهای بهداشت عمومی و نهادهای مخالف مصرف سیگار میتواند به وسیله بر حذر داشتن مردم در رابطه با شروع استعمال دخانیات و تشویق آنها به ترک آن باعث کاهش نرخ استعمال دخانیات شود.[55] منع استعمال دخانیات در مکانهای عمومی و محل کار اقدامات مهمی برای کاهش قرار گرفتن مردم در معرض دود سیگار است و این در حالی است که مکانهای دیگری که محدودیتهای بیشتری دارند بیشتر توصیه میشود.[28] ترک سیگار در افراد سیگاری تنها معیاری است که نشان از کاهش شدت COPD دارد.[56] این امر حتی در مراحل بعدی بیماری باعث کاهش نرخ بدتر شدن عملکرد ریه تأخیر در شروع ناتوانیهای بعدی و مرگ خواهد شد.[57] ترک سیگار با تصمیم فرد در رابطه با ترک آن شروع میشود و به عمل او برای ترک سیگار ختم میشود. معمولاً قبل از ترک همیشگی سیگار باید چند بار ترک ناموفق انجام شود.[55] ترک سیگار برای بیش از ۵ سال، در نزدیک به ۴۰٪ افراد منجر به ترک همیشگی آن میشود.[58] برخی افراد سیگاری تنها با قدرت اراده خود میتوانند برای همیشه سیگار را کنار بگذارند. به هرحال، سیگار بسیار اعتیادآور است[59] و بسیاری از افراد سیگاری به حمایت بیشتر نیاز دارند. احتمال ترک سیگار با حمایت اجتماعی، شرکت در جلسات برنامههای ترک سیگار و استفاده از داروهایی نظیر درمان جایگزینی نیکوتین، بوپروپیون و وارنسیلین بیشتر میشود.[55][58]
سلامت شغلی
اقدامات زیادی انجام شدهاست تا احتمال ابتلای کارگرانی که در صنایع پرخطر مانند معدن، ساختوساز و سنگتراشی کار میکنند به COPD کمتر شود.[28] مثالهایی از این اقدامات شامل این موارد میشود: به وجود آوردن سیاست عمومی،[28] آموزش این خطرات به کارگران و مدیران، تشویق به ترک سیگار، معاینه کارگران برای اولین نشانههای COPD، استفاده از ماسک و کنترل گردوخاک.[60][61] کنترل مؤثر گردوخاک میتواند از طریق بهبود تهویه، استفاده از اسپری آب و استفاده از روشهای معدنکاری که به وجود آمدن گردوخاک را به حداقل خود میرساند.[62] در صورتی که علائم COPD در کارگری پدید آمد، میتوان با قرار نگرفتن در معرض گردوخاک، به عنوان مثال تغییر نقش شغلی، از آسیب بیشتر به ریه جلوگیری کرد.[63]
آلودگی هوا
میتوان هوای داخل و بیرون ساختمان را بهبود بخشید، که باعث جلوگیری از COPD میشود یا از تشدید بیماری موجود جلوگیری میکند.[28] این کار میتواند توسط اقدامات سیاستگذاری عمومی، تغییر در فرهنگ زندگی و درگیر شدن شخصی صورت گیرد.[64] تعدادی از کشورهای پیشرفته از طریق وضع قوانین بهطور موفقیتآمیزی کیفیت هوا را بهبود دادهاند. . این امر منجر به بهبود عملکرد ریه افراد ساکن در این کشورها شدهاست.[28] در صورتی که در روزهایی که هوای بیرون آلودهاست افراد متبلا به COPD در خانه بمانند، نشانههای کمتری را تجربه میکنند.[4]
یکی از اقدامات اصلی کاهش قرار گرفتن در معرض دود حاصل از آشپزی و سوختهای مورد استفاده برای تولید گرما میباشد که میتواند از طریق تهویه مناسب منازل و استفاده از گاز و دودکش بهتر حاصل شود.[64] گازهای مناسب میتواند تا ۸۵٪ کیفیت هوای داخل خانه را بهبود ببخشند. استفاده از منابع انرژی جایگزین مانند پختوپز خورشیدی و گرمایش الکترونیکی همانند استفاده از سوختهایی مانند نفت سفید یا زغالسنگ به جای زیستتودهها نیز برای بهبود هوای داخل خانه مؤثر است. [28]
درمان
درمان شناخته شدهای برای COPD وجود ندارد، اما نشانههای آن قابل درمان بوده و پیشرفت آن قابل کم شدن است.[54] اهداف اصلی مدیریت شامل کاهش فاکتورهای خطر، مدیریت COPD ثابت، جلوگیری و درمان تشدید بیماری و مدیریت بیماریهای مرتبط میباشد.[4] تنها معیاری که کاهش مرگومیر را نشان دادهاست ترک سیگار و استفاده از اکسیژن اضافی است.[65] ترک سیگار خطر مرگ را تا ۱۸٪ کاهش میدهد.[3] توصیههای دیگر شامل این موارد میشود: واکسیناسیون آنفلوآنزا یک بار در سال، واکسیناسیون پنوموکوک هر پنج سال و قرار گرفتن کمتر در معرض هوای آلوده.[3] در موارد پیشرفته بیماری، مراقبت تسکینی ممکن است باعث کاهش علائم بیماری شود و مورفین احساس کوتاهی نفس را افزایش دهد.[66] ممکن است از تهویه غیرتهاجمی برای کمک به تنفس استفاده کرد.[66]
ورزش
توانبخشی ریوی یک برنامه ورزشی، مدیریت بیماری و مشورتی است که به منظور کمک به فرد تنظیم شدهاست.[67] ثابت شدهاست توانبخشی ریوی در افرادی که به تازگی در آنها بیماری شدت گرفته باعث بهبود کلی کیفیت زندگی و توانایی ورزش و کاهش مرگومیر شدهاست.[68] این برنامه همچنین حس کنترلی که فرد در برابر بیماری خود دارد و همچنین احساسات بیماران را بهبود بخشیدهاست.[69] به نظر میرسد فعالیتهای مربوط به داخل دادن هوا به ریه نقش چندانی در این موارد ندارد.[14] وزن زیاد یا کم میتواند بر نشانههای بیماری، میزان ناتوانی و تشخیص COPD تأثیر بگذارد. افرادی دچار COPD که وزن کمی دارند میتوانند به وسیله افزایش دریافتی کالری، قدرت عضلههای تنفسی خود را افزایش دهند.[4] این امر با ترکیب با ورزش منظم یا برنامه توانبخشی ریوی میتواند منجر به بهبود علائم COPD شود. تغذیه مکمل برای افراد دچار سوء تغذیه مؤثر است.[70]
گشاد کنندههای برونش
گشاد کننده برونشهای استنشاقی از درمانهای اولیه مورد استفاده هستند[3] و در کل اندکی تأثیر دارند.[71] دو نوع اصلی آن وجود دارد، بتا ۲ آگونیست و آنتی گولینرژیک؛ هر دو به صورت طولانی اثر و کوتاه اثر موجود میباشند. آنها باعث کاهش تنگی نفس، خس خس سینه و محدودیت ورزش شده و کیفیت زندگی بهبود یافته را به همراه دارند.[72] مشخص نیست آیا وضعیت پیشرفت بیماری موجود را تغییر میدهند یا خیر.[3]
در افرادی که دچار بیماری ملایم هستند، توصیه میشود عوامل زود اثر هنگام نیاز استفاده شوند.[3] در افرادی که دچار بیماری ملایم هستند، عوامل طولانی اثر توصیه میشود.[3] در صورتی که گشادکننده برونش طولانی اثر کافی نباشد، کورتیکواستروئید استنشاقی افزوده میشود.[3] در رابطه با عوامل طولانی اثر، مشخص نیست آیا تیوتروپیوم بروماید (یک آنتی کولینرژیک طولانی اثر) یا بتا آگونیست طولانی اثر (LABAs) بهتر است و ارزش دارد هر دو را امتحان کرده و از هرکدام که بهتر بود برای همیشه استفاده کرد.[73] هر دو نوع این عوامل خطر وخیمتر شدن بیماری را ۲۵–۱۵٪ کاهش دهند.[3] این در حالی است که استفاده هر دو در یک زمان مفید باشد، این فایده، در صورت وجود، تأثیر بحثبرانگیزی است.[74]
چند آگونیست بتا ۲ زود اثر از جمله سالبوتامول (Ventolin) و تربوتالین موجود است.[75] آنها علائم را برای چهار تا شش ساعت تسکین میدهند.[75] آگونیست بتا ۲ طولانی اثر مانند سالمترول در اکثر موارد به عنوان درمان نگاهدارنده استفاده میشود. بعضی افراد احساس میکنند مدارک مفید بودن آن محدود است،[76] این در حالی است که بعضی دیگر شواهد مفید بودن آن را قبول دارند.[77][78] به نظر میرسد استفاده طولانی مدت برای بیماران COPD ضرر نداشته باشد[79] اما اثراتی مانند لرزش و تپش قلب دارد.[3] هنگامی که با استروئید استنشاقی استفاده میشوند خطر سینه پهلو را افزایش میدهند.[3] این در حالی است که ممکن است استروئید و LABAs با هم اثر بهتری داشته باشند،[76] مشخص نیست این مزیت جزئی در برابر خطرات افزایش یافته به وجود آمده زیاد نباشد.[80]
دو آنتی کولینرژیک اصلی یعنی ایپراتروپیوم و تیوتروپیوم برای COPD استفاده میشود. ایپراتروپیوم یک عامل زود اثر است در حالی که تیوتروپیوم یک عامل طولانی اثر است. تیوتروپیوم با کاهش شدت گرفتن بیماری و بهبود کیفیت زندگی ارتباط دارد[74] و بهتر از ایپراتروپیوم عمل میکند.[81] تیوتروپیوم بر نرخ مرگومیر یا بستری شدن تأثیر ندارد.[82] آنتی کولینرژیکها باعث خشکی دهان و علائم مجازی اداری میشوند.[3] آنها همچنین با افزایش خطر بیماریهای قلبی و سکته مغزی میشود.[83][84]اکلیدینیوم، یک عامل طولانی اثر دیگر که در سال ۲۰۱۲ وارد بازار شد به عنوان جایگزین تیوتروپیوم مورد استفاده قرار میگیرد.[85][86]
کورتیکواستروئیدها
کورتیکواستروئیدها معمولاً به صورت استنشاقی مورد استفاده قرار میگیرند اما ممکن است به صورت قرص استفاده شوند و از تشدید بیماری جلوگیری کنند. اگرچه کورتیکواستروئیدها (ICS) برای افرادی که دچار COPD ملایم هستند فایدهای نداشتهاست، آنها تشدید بیماری افرادی که بیماری معمولی یا شدید دارند را کاهش میدهد.[87] هنگامی که ترکیب با LABA استفاده میشوند نرخ مرگومیر را بیشتر از استفاده تنها از ICS و LABA کاهش میدهند.[88] آنها به تنهایی تأثیری بر نرخ مرگومیر کلی یک ساله ندارند و با نرخ افزایش یافته سینه پهلو ارتباط دارند.[65] مشخص نیست که بر پیشرفت بیماری تأثیر دارند یا خیر.[3] درمان دراز مدت با قرصهای استروئید با اثرات فرعی قابل توجهی ارتباط دارد.[75]
درمان دیگر
استفاده دراز مدت از آنتیبیوتیکها، مخصوصاً از دسته ماکرولید مانند اریترومایسین باعث کاهش شدت بیماری در افرادی میشود که دو سال یا بیش از یک سال از این بیماری رنج میبرند.[89][90] ممکن است این روش در برخی نقاط جهان صرفه اقتصادی داشته باشد.[91] نگرانیها شامل مقاومت آنتیبیوتیکی و مشکلات شنوایی با آزیترومایسین میشود.[90] ضرر گزانتینها مانند تئوفیلین بیشتر از نفعشان است و به همین دلیل توصیه نمیشوند،[92] اما ممکن است به عنوان عامل دوم در مواردی که اقدامات دیگر کنترل نشدهاست مورد استفاده قرار بگیرد.[4] ممکن است موکولیتیکها در بعضی از افراد دارای مخاط غلیظ مفید باشد اما معمولاً مورد نیاز نیست.[52] داروی سرفه توصیه نمیشود.[75]
اکسیژن
اکسیژندرمانی در افراد دارای سطح اکسیژن پایین ثابت (فشار جزئی اکسیژن کمتر از mmHg55-50 یا اشباع اکسیژن کمتر از ۸۸٪) توصیه میشود.[75][93] این امر در این دسته افراد در صورتی که ۱۵ ساعت در روز استفاده شود خطر نارسایی قلب و مرگ را کاهش میدهد[75][93] و ممکن است توانایی افراد برای ورزش کردن را افزایش دهد.[94] ممکن است اکسیژندرمانی در افراد دارای سطح اکسیژن معمولی یا نسبتاً پایین تنگی نفس را بهبود بخشد.[95] خطر آتشسوزی در رابطه با استفاده از این روش وجود دارد و این روش برای افرادی که سیگار کشیدن را ادامه میدهند فایده چندانی ندارد.[96] در این شرایط بعضی عدم استفاده آن را توصیه میکنند.[97] بسیاری از بیماران در طول وخامت شدید بیماری به درمان با اکسیژن نیاز دارند؛ استفاده از اکسیژن با غلظت بالا بدون در نظر گرفتن اشباع اکسیژن فرد میتواند باعث بالا رفتن سطح دیاکسید کربن شده و نتیجه معکوس به همراه داشته باشد.[98][99] برای افرادی که در معرض خطر سطوح بالای دیاکسید کربن قرار دارند، اشباع اکسیژن ۹۲–۸۸٪ توصیه میشود، این در حالی است که برای افرادی که در معرض این خطر نیستند سطوح ۹۸–۹۴٪ توصیه میشود.[99]
عمل جراحی
عمل جراحی برای افرادی که بیماری آنها شدید است میتواند مفید باشد، عمل ممکن است شامل پیوند ریه یا کاهش حجم ریه شود.[3] عمل کاهش حجم ریه شامل برداشتن بخشهایی میشود که بیشترین آسیب توسط آمفیزم به آن وارد شدهاست و اجازه میدهد که بخشهای باقیمانده یعنی ریه تقریباً سالم گسترش یابد و بهتر فعالیت کند. پیوند ریه در بعضی مواقع برای موارد بسیار شدید COPD و مخصوصاً در افراد جوان صورت میگیرد.[75]
تشدید
معمولاً تشدید بیماری به وسیله افزایش استفاده از گشاد کنندههای برونش زود اثر درمان میشود.[3] این امر شامل ترکیب آگونیست بتای استنشاقی و آنتی کولینرژیک میباشد. میتوان این داروها را از طریق افشانه با دوز معین با آسم یار یا نبولایزر به فرد بیمار داد، که هردوی آنها بهطور یکسانی مؤثر میباشند.[36] افشانه کردن برای افرادی که حالشان بدتر است آسانتر میباشد.[36] کورتیکواستروئیدهای دهانی شانس بهبود را بهبود بخشیده و مدت کلی علائم را کاهش میدهند. در افرادی که بیماری در آنها تشدید شدهاست، آنتیبیوتیک نتیجه را بهبود میبخشد.[100] آنتیبیوتیکهای زیادی مورد استفاده قرار میگیرند، از جمله: آموکسیسیلین، داکسیسایکلین یا آزیترومایسین؛ مشخص نیست کدام از دیگری بهتر است.[52] مدرک مشخصی برای افرادی که بیماری آنها شدید است موجود نیست.[100] تهویه غیرتهاجمی در افرادی دارای سطوح CO2 بالا (نارسایی تنفسی نوع ۲) میباشند احتمال مرگ یا نیاز به مراقبتهای ویژه تهویه مکانیکی را کاهش میدهد.[3] علاوه بر این، ممکن است تئوفیلین در درمان افرادی که به روشهای دیگر جواب نمیدهند نقش داشته باشد.[3] کمتر از ۲۰٪ تشدید بیماری نیازمند بستری شدن در بیمارستان میباشد.[36] در افراد بدون اسیدوز از نارسایی تنفسی، مراقبت در منزل (بیمارستان در منزل) میتواند از بستری شدن او جلوگیری کند. .[36][101]
پیشآگهی
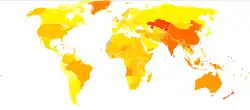
no data
≤۱۱۰
110–220
220–330
330–440
440–550
550–660
|
660–770
770–880
880–990
990–1100
1100–1350
≥۱۳۵۰
|
معمولاً COPD با گذشت زمان وخیمتر میشود و میتواند در نهایت به مرگ ختم شود. تخمین زده میشود که ۳٪ سالهای تطبیق شده با ناتوانی با COPD ارتباط دارد.[103] به دلیل بهبود هوای خانگی عمدتاً در آسیا، نسبت ناتوانی به وجود آمده بر اثر COPD در سطح جهان از سال ۱۹۹۰ تا ۲۰۱۰ کاهش داشتهاست.[103] با این وجود، تعداد کل سالهای زندگی با ناتوانی ناشی از COPD افزایش داشتهاست. .[104]
نرخی که COPD وخیم میشود با وجود فاکتورهایی که نتیجه ضعیف را پیشبینی میکنند فرق دارد، این فاکتورها شامل این موارد میشود: مسدود شدن شدید جریان هوا، توانایی اندک برای ورزش کردن، تنگی نفس، وزن بسیار کم یا بسیار زیاد، نارسایی قلبی مزمن، ادامه مصرف سیگار و تشدید شدن پیاپی.[4] نتایج دراز مدت COPD را میتوان با استفاده از اندکس BODE که بر اساس FEV1 عددی بین صفر یا ده را نشان میدهد، شاخص توده بدنی، مسافت طی شده در شش دقیقه و مقیاس تنگینفس MRC اصلاح شده تخمین زد.[105] از دست دادن قابل توجه وزن نشانه بدی است.[2] نتایج تنفسسنجی نیز پیشبینیکننده خوبی در مورد پیشرفت آتی بیماری است اما به خوبی اندکس BODE نیست.
همهگیرشناسی
از سال ۲۰۱۰ در سراسر جهان تقریباً ۳۲۹ میلیون نفر به COPD مبتلا شدهاند (۴٫۸٪ از جمعیت) و در مردان اندکی بیشتر از زنان رخ میدهد.[104] این آمار در مقایسه با ۶۴ میلیون نفری است که در سال ۲۰۰۴ به این بیماری مبتلا بودند.[106] باور میشود این افزایش در کشورهای توسعهیافته دنیا بین سالهای ۱۹۷۰ و دهه ۲۰۰۰ با میزان رو به رشد مصرف سیگار در این مناطق، جمعیت رو به رشد و جمعیت رو به پیری بر اثر مرگومیر کمتر به وجود آمده از دلایل دیگر مانند بیماریهای واگیردار بودهاست.[3] برخی از کشورهای پیشرفته شاهد میزان رو به رشدی بودهاند، این میزان در برخی دیگر ثابت و تعدادی شاهد کاهش شیوع COPD بودهاند.[3] انتظار میرود با باقیماند فاکتورهای خطر و ادامه روند پیر شدن جمعیت، ارقام جهانی به رشد خود ادامه دهند.[54] تعداد مرگومیر ناشی از COPD بین سالهای ۱۹۹۰ تا ۲۰۱۰ با کاهشی اندک، از ۳٫۱ میلیون به ۲٫۹ میلیون رسید.[107] در کل، این بیماری چهارمین عامل مرگ میباشد.[3] در بعضی از کشورها، میزان مرگومیر در مردان کاهش اما در زنان افزایش داشتهاست.[108] این امر به احتمال زیاد به این دلیل است که میزان مصرف سیگار در زنان و مردان در حال نزدیک شدن به هم میباشد.[2] COPD در افراد سالخورده شایعتر است.[1] این بیماری ۲۰۰–۳۴ نفر در هر ۱۰۰۰ فرد بالای ۶۵ سال را با توجه به جمعیت بررسی شده تحت تأثیر قرار میدهد.[1][50] در انگلیس، COPD در تقریباً ۰٫۸۴ میلیون نفر (از ۵۰ میلیون نفر) تشخیص داده شدهاست؛ به عبارت دیگر، COPD در طول زندگی یک نفر از هر ۵۹ نفر تشخیص داده شدهاست. در مناطق بسیار محروم اجتماعی و اقتصادی کشور، COPD در یک نفر از هر ۳۲ نفر تشخیص داده شدهاست، این عدد در مقایسه با یک نفر در ۹۸ نفر در مناطق ثروتمند میباشد.[109] در آمریکا، COPD در تقریباً ۶٫۳٪ از جمعیت بالغ، یعنی نزدیک به ۱۵ میلیون نفر، تشخیص داده شدهاست.[110] در صورتی که موارد تشخیص داده نشده شامل شود، ۲۵ میلیون نفر دچار COPD میباشند.[111] در سال ۲۰۱۱، تقریباً ۷۳۰۰۰۰ مورد بستری به دلیل COPD در آمریکا وجود داشت.[112]
تاریخچه

واژه «emphysema» از واژه یونانی ἐμφυσᾶν emphysan به معنای «متورم شدن» گرفته شدهاست که خود از «ἐν en» به معنای «در، درون» و «φυσᾶν physan» به معنای «نفس، جریان شدید هوا» تشکیل شدهاست.[113] واژه برونشیت مزمن در سال ۱۸۰۸ ساخته شد.[114] این در حالی است که باور میشود نخستین بار در سال ۱۹۶۵ از اصطلاح COPD استفاده شد.[115] این بیماری قبلاً با اسامی دیگری از جمله این موارد شناخته میشد: chronic obstructive bronchopulmonary disease, chronic obstructive respiratory disease, chronic airflow obstruction, chronic airflow limitation, chronic obstructive lung disease, nonspecific chronic pulmonary disease و diffuse obstructive pulmonary syndrome. اصطلاح «برونشیت مزمن» و «آمفیزم» در سال ۱۹۵۹ در ضیافت نوارتیس و در سال ۱۹۶۲ در جلسه کمیته انجمن ریه آمریکا در مورد استانداردهای تشخیصی معرفی شد.[115] توصیفات اولیه از آمفیزم محتمل شامل این موارد میشود: در سال ۱۶۷۹ توسط T.Bonnet در مورد شرایط «ریههای بزرگ» و در سال ۱۷۶۹ توسط Giovanni Morgagni در مورد ریههایی که «بادکرده مخصوصاً از هوا» بودند.[115][116] در سال ۱۷۲۱، Ruysh اولین طراحی آمفیزم را به وجود آورد.[116] تصاویری توسط Matthew Baillie در سال ۱۷۸۹ و توصیف مخرب بودن این شرایط به دنبال آنها به وجود آمدند. در سال ۱۸۱۴، Charles Badham از «نزله» برای توصیف سرفه و خلط زیاد در برونشیت مزمن استفاده کرد. رنه لاینک، پزشک مخترع گوشی پزشکی، در کتاب خود به نام «A Treatise on the Diseases of the Chest and of Mediate Auscultation» (۱۸۳۷) از واژه «emphysema» برای توصیف ریههایی که در طول کالبدشکافی و به هنگام باز کردن قفسه جمع نمیشدند استفاده کرد. او گفت که ریهها مانند ریههای معمولی جمع نمیشدند زیرا آنها پر از هوا بودند و مجاری هوا پر از مخاط بود. John Hutchinson در سال ۱۸۴۲ دستگاه تنفسسنج را اختراع کرد و با این کار اندازهگیری ظرفیت حیاتی ریهها را مقدور ساخت. با این وجود، دستگاه تنفسسنج وی میتوانست تنها حجم هوا را اندازهگیری کند نه جریان هوا را. Tiffeneau و Pinelli در سال ۱۹۴۷ اصول اندازهگیری جریان هوا را توصیف کردند.[115] در سال ۱۹۵۳، دکتر George L. Waldbott، متخصص آلرژی آمریکایی، اولین فردی بود که یک بیماری جدید به نام «سندروم تنفسی فرد مصرفکننده دخانیات» را در مجله انجمن پزشکی آمریکا، سال ۱۹۵۲ توصیف کرد. این اولین ارتباط بین مصرف تنباکو و بیماری تنفسی مزمن بود.[117] درمانهای اولیه شامل سیر، دارچین و ایپکاک میشد.[114] در طول نیمه دوم قرن بیستم درمانهای نوین به وجود آمدند. شواهد پشتیبانیکننده استفاده از استروئیدها در COPD در اواخر دهه ۱۹۵۰ منتشر شد. گشاد کنندههای برونش در دهه ۱۹۶۰ و پس از آزمایش امیدوارکننده ایزوپروترنول مورد استفاده قرار گرفتند. گشاد کنندههای برونش دیگر، مانند سالبوتامول، در دهه ۱۹۷۰ تولید شدند و استفاده از LABAsها در اواسط دهه ۱۹۹۰ شروع شد.[118]
فرهنگ و جامعه
به COPD «ریه سیگاری» گفته میشود.[119] افراد دچار آمفیزم با عنوان «سیگاریهای صورتی» یا «نوع الف» شناخته میشوند زیرا رنگ صورت آنها همواره صورتی است، سرعت تنفسشان سریع و لبهایشان چروکیده است،[120][121] افراد دچار برونشیت مزمن با عنوان «ماهی دودی آبی» یا «نوع ب» شناخته میشوند زیرا آنها به دلیل سطح پایین اکسیژن و تورم مچ پای خود معمولاً دارای پوست کبود هستند.[121][122] این واژهها دیگر قابل قبول نیستند زیرا اکثر بیماران COPD ترکیبی از هردو را دارند.[2][121] سیستمهای سلامت زیادی در شناسایی، تشخیص، مراقبت صحیح از افراد دارای COPD دچار مشکل میباشند؛ وزارت بهداشت انگلیس این مشکل را یکی از مشکلات اصلی خدمات بهداشتی ملی تشخیص دادهاست و راهبرد خاصی برای حل آن معرفی کردهاست.[123]
اقتصاد
از سال ۲۰۱۰، COPD در سرتاسر جهان ۲٫۱ ترییون دلار هزینه اقتصادی به همراه داشتهاست که نصف آن در کشورهای در حال توسعه است.[124] از این میزان، ۱٫۹ تریلیون دلار هزینههای مستقیم مانند مراقبت پزشکی است، درحالیکه ۰٫۲ تریلیون دلار هزینههای غیرمستقیم مانند از دست دادن شغل است.[125] انتظار میرود این میزان در طول ۲۰ سال آینده دو برابر شود.[124] در اروپا، ۳٪ از هزینههای مراقبت پزشکی به COPD تعلق میگیرد.[1] در آمریکا، هزینههای بیماری ۵۰ تریلیون دلار تخمین زده میشود که اغلب آن به دلیل تشدید بیماری است.[1] COPD در سال ۲۰۱۱ با هزینهای در حدود ۵٫۷ میلیارد دلار در بین گرانترین شرایط مشاهده شده در بیمارستانها قرار داشت.[112]
پژوهشها
اینفلکسیماب، یک آنتیبادی سرکوبکننده دستگاه ایمنی بدن، در بیماران COPD آزمایش شد اما اثری نداشت بلکه امکان مضر بودن آن نیز وجود داشت.[126] رفلومیلاست نرخ تشدید بیماری را کمتر کرد اما کیفیت زندگی را بهبود نمیبخشد.[3] تعدادی عامل طولانی اثر در حال تولید هستند.[3] درمان با سلولهای بنیادی مورد مطالعه قرار گرفتهاست.[127] در حالیکه این روش ضرری ندارد و آزمایش آن بر روی حیوانات نتایج خوبی به همراه داشتهاست، تا سال ۲۰۱۴، اطلاعات کمی در مورد آزمایش آن روی انسان موجود است.[128]
حیوانات دیگر
بیماری مزمن انسدادی ریه میتواند در حیوانات نیز اتفاق بیفتد و بر اثر تماس با دود سیگار باشد.[129][130] با این وجود، اکثر بیماریها ملایم هستند.[131] این بیماری در اسب با عنوان انسداد مجاری تنفسی عودکننده نیز شناخته میشود و معمولاً بر اثر واکنش آلرژیکی به کاه دارای قارچ رخ میدهد.[132] COPD معمولاً در سگهای پیر مشاهده میشود.[133]
منابع
- Vestbo, Jørgen (2013). "Definition and Overview" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 1–7. Archived from the original (PDF) on 4 اكتبر 2013. Retrieved 7 فوریه 2015. Check date values in:
|archive-date=(help) - Reilly, John J.; Silverman, Edwin K.; Shapiro, Steven D. (2011). "Chronic Obstructive Pulmonary Disease". In Longo, Dan; Fauci, Anthony; Kasper, Dennis; Hauser, Stephen; Jameson, J.; Loscalzo, Joseph. Harrison's Principles of Internal Medicine (18th ed.). McGraw Hill. pp. 2151–9. ISBN 978-0-07-174889-6.
- Decramer M, Janssens W, Miravitlles M (April 2012). "Chronic obstructive pulmonary disease". Lancet. 379 (9823): 1341–51. doi:10.1016/S0140-6736(11)60968-9. PMID 22314182.
- Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, Fukuchi Y, Jenkins C, Rodriguez-Roisin R, van Weel C, Zielinski J (September 2007). "Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary". Am. J. Respir. Crit. Care Med. 176 (6): 532–55. doi:10.1164/rccm.200703-456SO. PMID 17507545.
- Nathell L, Nathell M, Malmberg P, Larsson K (2007). "COPD diagnosis related to different guidelines and spirometry techniques". Respir. Res. 8 (1): 89. doi:10.1186/1465-9921-8-89. PMC 2217523. PMID 18053200.
- "The 10 leading causes of death in the world, 2000 and 2011". World Health Organization. July 2013. Retrieved November 29, 2013.
- Mathers CD, Loncar D (November 2006). "Projections of Global Mortality and Burden of Disease from 2002 to 2030". PLoS Med. 3 (11): e442. doi:10.1371/journal.pmed.0030442. PMC 1664601. PMID 17132052.
- Vestbo, Jørgen (2013). "Diagnosis and Assessment" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 9–17. Archived from the original (PDF) on 4 اكتبر 2013. Retrieved 7 فوریه 2015. Check date values in:
|archive-date=(help) - National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- Mahler DA (2006). "Mechanisms and measurement of dyspnea in chronic obstructive pulmonary disease". Proceedings of the American Thoracic Society. 3 (3): 234–8. doi:10.1513/pats.200509-103SF. PMID 16636091.
- "What Are the Signs and Symptoms of COPD?". National Heart, Lung, and Blood Institute. July 31, 2013. Retrieved November 29, 2013.
- Chronic obstructive pulmonary diseaseدر مدلاین پلاس
- Morrison, [edited by] Nathan E. Goldstein, R. Sean (2013). Evidence-based practice of palliative medicine. Philadelphia: Elsevier/Saunders. p. 124. ISBN 978-1-4377-3796-7.
- Holland AE, Hill CJ, Jones AY, McDonald CF (2012). Holland, Anne E, ed. "Breathing exercises for chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 10: CD008250. doi:10.1002/14651858.CD008250.pub2. PMID 23076942.
- Gruber, Phillip (November 2008). "The Acute Presentation of Chronic Obstructive Pulmonary Disease In the Emergency Department: A Challenging Oxymoron". Emergency Medicine Practice. 10 (11).
- Weitzenblum E, Chaouat A (2009). "Cor pulmonale". Chron Respir Dis. 6 (3): 177–85. doi:10.1177/1479972309104664. PMID 19643833.
- "Cor pulmonale". Professional guide to diseases (9th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2009. pp. 120–2. ISBN 978-0-7817-7899-2.
- Mandell, editors, James K. Stoller, Franklin A. Michota, Jr. , Brian F. (2009). The Cleveland Clinic Foundation intensive review of internal medicine (5th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 419. ISBN 978-0-7817-9079-6.
- Brulotte CA, Lang ES (May 2012). "Acute exacerbations of chronic obstructive pulmonary disease in the emergency department". Emerg. Med. Clin. North Am. 30 (2): 223–47, vii. doi:10.1016/j.emc.2011.10.005. PMID 22487106.
- Spiro, Stephen (2012). Clinical respiratory medicine expert consult (4th ed.). Philadelphia, PA: Saunders. p. Chapter 43. ISBN 978-1-4557-2329-4.
- World Health Organization (2008). WHO Report on the Global Tobacco Epidemic 2008: The MPOWER Package (PDF). Geneva: World Health Organization. pp. 268–309. ISBN 92-4-159628-7.
- Ward, Helen (2012). Oxford Handbook of Epidemiology for Clinicians. Oxford University Press. pp. 289–290. ISBN 978-0-19-165478-7.
- Laniado-Laborín, R (January 2009). "Smoking and chronic obstructive pulmonary disease (COPD). Parallel epidemics of the 21st century". International journal of environmental research and public health. 6 (1): 209–24. doi:10.3390/ijerph6010209. PMC 2672326. PMID 19440278.
- Rennard, Stephen (2013). Clinical management of chronic obstructive pulmonary disease (2nd ed.). New York: Informa Healthcare. p. 23. ISBN 978-0-8493-7588-0.
- Anita Sharma ; with a contribution by David Pitchforth ; forewords by Gail Richards; Barclay, Joyce (2010). COPD in primary care. Oxford: Radcliffe Pub. p. 9. ISBN 978-1-84619-316-3.
- Goldman, Lee (2012). Goldman's Cecil medicine (24th ed.). Philadelphia: Elsevier/Saunders. p. 537. ISBN 978-1-4377-1604-7.
- Kennedy SM, Chambers R, Du W, Dimich-Ward H (December 2007). "Environmental and occupational exposures: do they affect chronic obstructive pulmonary disease differently in women and men?". Proceedings of the American Thoracic Society. 4 (8): 692–4. doi:10.1513/pats.200707-094SD. PMID 18073405.
- Pirozzi C, Scholand MB (July 2012). "Smoking cessation and environmental hygiene". Med. Clin. North Am. 96 (4): 849–67. doi:10.1016/j.mcna.2012.04.014. PMID 22793948.
- Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM (September 2006). "Global burden of COPD: systematic review and meta-analysis". Eur. Respir. J. 28 (3): 523–32. doi:10.1183/09031936.06.00124605. PMID 16611654.
- Devereux, Graham (2006). "Definition, epidemiology and risk factors". BMJ. 332 (7550): 1142–4. doi:10.1136/bmj.332.7550.1142. PMC 1459603. PMID 16690673.
- Laine, Christine (2009). In the Clinic: Practical Information about Common Health Problems. ACP Press. p. 226. ISBN 978-1-934465-64-6.
- Barnes, Peter J.; Drazen, Jeffrey M.; Rennard, Stephen I.; Thomson, Neil C., eds. (2009). "Relationship between cigarette smoking and occupational exposures". Asthma and COPD: Basic Mechanisms and Clinical Management. Amsterdam: Academic. p. 464. ISBN 978-0-12-374001-4.
- Rushton, Lesley (2007). "Chronic Obstructive Pulmonary Disease and Occupational Exposure to Silica". Reviews on Environmental Health. 22 (4): 255–72. doi:10.1515/REVEH.2007.22.4.255. PMID 18351226.
- Foreman MG, Campos M, Celedón JC (July 2012). "Genes and chronic obstructive pulmonary disease". Med. Clin. North Am. 96 (4): 699–711. doi:10.1016/j.mcna.2012.02.006. PMC 3399759. PMID 22793939.
- Brode SK, Ling SC, Chapman KR (September 2012). "Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease". CMAJ. 184 (12): 1365–71. doi:10.1503/cmaj.111749. PMC 3447047. PMID 22761482.
- Vestbo, Jørgen (2013). "Management of Exacerbations" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 39–45. Archived from the original (PDF) on 4 اكتبر 2013. Retrieved 7 فوریه 2015. Check date values in:
|archive-date=(help) - Dhar, Raja (2011). Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. p. 1056. ISBN 978-93-5025-073-0.
- Palange, Paolo (2013). ERS Handbook of Respiratory Medicine. European Respiratory Society. p. 194. ISBN 978-1-84984-041-5.
- Lötvall, Jan (2011). Advances in combination therapy for asthma and COPD. Chichester, West Sussex: John Wiley & Sons. p. 251. ISBN 978-1-119-97846-6.
- Barnes, Peter (2009). Asthma and COPD: basic mechanisms and clinical management (2nd ed.). Amsterdam: Academic. p. 837. ISBN 978-0-12-374001-4.
- Hanania, Nicola (2010-12-09). COPD a Guide to Diagnosis and Clinical Management (1st ed.). Totowa, NJ: Springer Science+Business Media, LLC. p. 197. ISBN 978-1-59745-357-8.
- Beasley, V; Joshi, PV; Singanayagam, A; Molyneaux, PL; Johnston, SL; Mallia, P (2012). "Lung microbiology and exacerbations in COPD". International journal of chronic obstructive pulmonary disease. 7: 555–69. doi:10.2147/COPD.S28286. PMC 3437812. PMID 22969296.
- Murphy DMF, Fishman AP (2008). "Chapter 53". Fishman's Pulmonary Diseases and Disorders (4th ed.). McGraw-Hill. p. 913. ISBN 0-07-145739-9.
- Calverley PM, Koulouris NG (2005). "Flow limitation and dynamic hyperinflation: key concepts in modern respiratory physiology". Eur Respir J. 25 (1): 186–199. doi:10.1183/09031936.04.00113204. PMID 15640341.
- Currie, Graeme P. (2010). ABC of COPD (2nd ed.). Chichester, West Sussex, UK: Wiley-Blackwell, BMJ Books. p. 32. ISBN 978-1-4443-2948-3.
- Qaseem A, Wilt TJ, Weinberger SE, Hanania NA, Criner G, van der Molen T, Marciniuk DD, Denberg T, Schünemann H, Wedzicha W, MacDonald R, Shekelle P (August 2011). "Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society". Ann. Intern. Med. 155 (3): 179–91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710.
- Young, Vincent B. (2010). Blueprints medicine (5th ed.). Philadelphia: Wolters Kluwer Health/Lippincott William & Wilkins. p. 69. ISBN 978-0-7817-8870-0.
- "COPD Assessment Test (CAT)". American Thoracic Society. Retrieved November 29, 2013.
- National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- Torres M, Moayedi S (May 2007). "Evaluation of the acutely dyspneic elderly patient". Clin. Geriatr. Med. 23 (2): 307–25, vi. doi:10.1016/j.cger.2007.01.007. PMID 17462519.
- BTS COPD Consortium (2005). "Spirometry in practice - a practical guide to using spirometry in primary care". pp. 8–9. Archived from the original on 26 August 2014. Retrieved 25 August 2014.
- Mackay AJ, Hurst JR (July 2012). "COPD exacerbations: causes, prevention, and treatment". Med. Clin. North Am. 96 (4): 789–809. doi:10.1016/j.mcna.2012.02.008. PMID 22793945.
- Poole PJ, Chacko E, Wood-Baker RW, Cates CJ (2006). Poole, Phillippa, ed. "Influenza vaccine for patients with chronic obstructive pulmonary disease". Cochrane Database Syst Rev (1): CD002733. doi:10.1002/14651858.CD002733.pub2. PMID 16437444.
- Vestbo, Jørgen (2013). "Introduction". Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (PDF). Global Initiative for Chronic Obstructive Lung Disease. xiii–xv. Archived from the original (PDF) on 4 October 2013. Retrieved 7 February 2015.
- Policy Recommendations for Smoking Cessation and Treatment of Tobacco Dependence. World Health Organization. pp. 15–40. ISBN 978-92-4-156240-9.
- Jiménez-Ruiz CA, Fagerström KO (March 2013). "Smoking cessation treatment for COPD smokers: the role of counselling". Monaldi Arch Chest Dis. 79 (1): 33–7. PMID 23741944.
- Kumar P, Clark M (2005). Clinical Medicine (6th ed.). Elsevier Saunders. pp. 900–1. ISBN 0-7020-2763-4.
- Tønnesen P (March 2013). "Smoking cessation and COPD". Eur Respir Rev. 22 (127): 37–43. doi:10.1183/09059180.00007212. PMID 23457163.
- "Why is smoking addictive?". NHS Choices. December 29, 2011. Retrieved November 29, 2013.
- Smith, Barbara K. Timby, Nancy E. (2005). Essentials of nursing: care of adults and children. Philadelphia: Lippincott Williams & Wilkins. p. 338. ISBN 978-0-7817-5098-1.
- Rom, William N.; Markowitz, Steven B., eds. (2007). Environmental and occupational medicine (4th ed.). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. pp. 521–2. ISBN 978-0-7817-6299-1.
- "Wet cutting". Health and Safety Executive. Retrieved November 29, 2013.
- George, Ronald B. (2005). Chest medicine: essentials of pulmonary and critical care medicine (5th ed.). Philadelphia, PA: Lippincott Williams & Wilkins. p. 172. ISBN 978-0-7817-5273-2.
- Vestbo, Jørgen (2013). "Management of Stable COPD". Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (PDF). Global Initiative for Chronic Obstructive Lung Disease. pp. 31–8. Archived from the original (PDF) on 4 October 2013. Retrieved 7 February 2015.
- Drummond MB, Dasenbrook EC, Pitz MW, Murphy DJ, Fan E (November 2008). "Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis". JAMA. 300 (20): 2407–16. doi:10.1001/jama.2008.717. PMID 19033591.
- Carlucci A, Guerrieri A, Nava S (December 2012). "Palliative care in COPD patients: is it only an end-of-life issue?". Eur Respir Rev. 21 (126): 347–54. doi:10.1183/09059180.00001512. PMID 23204123.
- "COPD — Treatment". U.S. National Heart Lung and Blood Institute. Retrieved 2013-07-23.
- Puhan MA, Gimeno-Santos E, Scharplatz M, Troosters T, Walters EH, Steurer J (2011). Puhan, Milo A, ed. "Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev (10): CD005305. doi:10.1002/14651858.CD005305.pub3. PMID 21975749.
- Lacasse Y, Goldstein R, Lasserson TJ, Martin S (2006). Lacasse, Yves, ed. "Pulmonary rehabilitation for chronic obstructive pulmonary disease". Cochrane Database Syst Rev (4): CD003793. doi:10.1002/14651858.CD003793.pub2. PMID 17054186.
- Ferreira IM, Brooks D, White J, Goldstein R (2012). Ferreira, Ivone M, ed. "Nutritional supplementation for stable chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 12: CD000998. doi:10.1002/14651858.CD000998.pub3. PMID 23235577.
- van Dijk WD, van den Bemt L, van Weel C (2013). "Megatrials for bronchodilators in chronic obstructive pulmonary disease (COPD) treatment: time to reflect". J Am Board Fam Med. 26 (2): 221–4. doi:10.3122/jabfm.2013.02.110342. PMID 23471939.
- Liesker JJ, Wijkstra PJ, Ten Hacken NH, Koëter GH, Postma DS, Kerstjens HA (February 2002). "A systematic review of the effects of bronchodilators on exercise capacity in patients with COPD". Chest. 121 (2): 597–608. doi:10.1378/chest.121.2.597. PMID 11834677. Archived from the original on 28 September 2015. Retrieved 7 February 2015.
- Chong J, Karner C, Poole P (2012). Chong, Jimmy, ed. "Tiotropium versus long-acting beta-agonists for stable chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 9: CD009157. doi:10.1002/14651858.CD009157.pub2. PMID 22972134.
- Karner C, Cates CJ (2012). Karner, Charlotta, ed. "Long-acting beta(2)-agonist in addition to tiotropium versus either tiotropium or long-acting beta(2)-agonist alone for chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 4: CD008989. doi:10.1002/14651858.CD008989.pub2. PMID 22513969.
- Vestbo, Jørgen (2013). "Therapeutic Options" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 19–30. Archived from the original (PDF) on 4 اكتبر 2013. Retrieved 7 فوریه 2015. Check date values in:
|archive-date=(help) - Cave, AC.; Hurst, MM. (May 2011). "The use of long acting β₂-agonists, alone or in combination with inhaled corticosteroids, in chronic obstructive pulmonary disease (COPD): a risk-benefit analysis". Pharmacol Ther. 130 (2): 114–43. doi:10.1016/j.pharmthera.2010.12.008. PMID 21276815.
- Spencer, S; Karner, C; Cates, CJ; Evans, DJ (Dec 7, 2011). Spencer, Sally, ed. "Inhaled corticosteroids versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews (12): CD007033. doi:10.1002/14651858.CD007033.pub3. PMID 22161409.
- Wang, J; Nie, B; Xiong, W; Xu, Y (April 2012). "Effect of long-acting beta-agonists on the frequency of COPD exacerbations: a meta-analysis". Journal of clinical pharmacy and therapeutics. 37 (2): 204–11. doi:10.1111/j.1365-2710.2011.01285.x. PMID 21740451.
- Decramer ML, Hanania NA, Lötvall JO, Yawn BP (2013). "The safety of long-acting β2-agonists in the treatment of stable chronic obstructive pulmonary disease". Int J Chron Obstruct Pulmon Dis. 8: 53–64. doi:10.2147/COPD.S39018. PMC 3558319. PMID 23378756.
- Nannini, LJ; Lasserson, TJ; Poole, P (Sep 12, 2012). Nannini, Luis Javier, ed. "Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 9: CD006829. doi:10.1002/14651858.CD006829.pub2. PMID 22972099.
- Cheyne L, Irvin-Sellers MJ, White J (Sep 16, 2013). Cheyne, Leanne, ed. "Tiotropium versus ipratropium bromide for chronic obstructive pulmonary disease". Cochrane Database of Systematic Reviews. 9 (9): CD009552. doi:10.1002/14651858.CD009552.pub2. PMID 24043433.
- Karner, C; Chong, J; Poole, P (Jul 11, 2012). Karner, Charlotta, ed. "Tiotropium versus placebo for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 7: CD009285. doi:10.1002/14651858.CD009285.pub2. PMID 22786525.
- Singh S, Loke YK, Furberg CD (September 2008). "Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis". JAMA. 300 (12): 1439–50. doi:10.1001/jama.300.12.1439. PMID 18812535.
- Singh S, Loke YK, Enright P, Furberg CD (January 2013). "Pro-arrhythmic and pro-ischaemic effects of inhaled anticholinergic medications". Thorax. 68 (1): 114–6. doi:10.1136/thoraxjnl-2011-201275. PMID 22764216.
- Jones, P (Apr 2013). "Aclidinium bromide twice daily for the treatment of chronic obstructive pulmonary disease: a review". Advances in therapy. 30 (4): 354–68. doi:10.1007/s12325-013-0019-2. PMID 23553509.
- Cazzola, M; Page, CP; Matera, MG (Jun 2013). "Aclidinium bromide for the treatment of chronic obstructive pulmonary disease". Expert opinion on pharmacotherapy. 14 (9): 1205–14. doi:10.1517/14656566.2013.789021. PMID 23566013.
- Gartlehner G, Hansen RA, Carson SS, Lohr KN (2006). "Efficacy and Safety of Inhaled Corticosteroids in Patients With COPD: A Systematic Review and Meta-Analysis of Health Outcomes". Ann Fam Med. 4 (3): 253–62. doi:10.1370/afm.517. PMC 1479432. PMID 16735528.
- Shafazand S (June 2013). "ACP Journal Club. Review: inhaled medications vary substantively in their effects on mortality in COPD". Ann. Intern. Med. 158 (12): JC2. doi:10.7326/0003-4819-158-12-201306180-02002. PMID 23778926.
- Mammen MJ, Sethi S (2012). "Macrolide therapy for the prevention of acute exacerbations in chronic obstructive pulmonary disease". Pol. Arch. Med. Wewn. 122 (1–2): 54–9. PMID 22353707.
- Herath, SC; Poole, P (Nov 28, 2013). "Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD)". The Cochrane database of systematic reviews. 11: CD009764. doi:10.1002/14651858.CD009764.pub2. PMID 24288145.
- Simoens, S; Laekeman, G; Decramer, M (May 2013). "Preventing COPD exacerbations with macrolides: a review and budget impact analysis". Respiratory medicine. 107 (5): 637–48. doi:10.1016/j.rmed.2012.12.019. PMID 23352223.
- Barr RG, Rowe BH, Camargo CA (2003). Barr, R Graham, ed. "Methylxanthines for exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev (2): CD002168. doi:10.1002/14651858.CD002168. PMID 12804425.
- COPD Working, Group (2012). "Long-term oxygen therapy for patients with chronic obstructive pulmonary disease (COPD): an evidence-based analysis". Ontario health technology assessment series. 12 (7): 1–64. PMC 3384376. PMID 23074435.
- Bradley JM, O'Neill B (2005). Bradley, Judy M, ed. "Short-term ambulatory oxygen for chronic obstructive pulmonary disease". Cochrane Database Syst Rev (4): CD004356. doi:10.1002/14651858.CD004356.pub3. PMID 16235359.
- Uronis H, McCrory DC, Samsa G, Currow D, Abernethy A (2011). Abernethy, Amy, ed. "Symptomatic oxygen for non-hypoxaemic chronic obstructive pulmonary disease". Cochrane Database Syst Rev (6): CD006429. doi:10.1002/14651858.CD006429.pub2. PMID 21678356.
- Chapman, Stephen (2009). Oxford handbook of respiratory medicine (2nd ed.). Oxford: Oxford University Press. p. 707. ISBN 978-0-19-954516-2.
- Blackler, Laura (2007). Managing chronic obstructive pulmonary disease. Chichester, England: John Wiley & Sons. p. 49. ISBN 978-0-470-51798-7.
- Jindal, Surinder K (2013). Chronic Obstructive Pulmonary Disease. Jaypee Brothers Medical. p. 139. ISBN 978-93-5090-353-7.
- O'Driscoll, BR; Howard, LS; Davison, AG; British Thoracic, Society (October 2008). "BTS guideline for emergency oxygen use in adult patients". Thorax. 63 (Suppl 6): vi1–68. doi:10.1136/thx.2008.102947. PMID 18838559.
- Vollenweider DJ, Jarrett H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA (2012). Vollenweider, Daniela J, ed. "Antibiotics for exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 12: CD010257. doi:10.1002/14651858.CD010257. PMID 23235687.
- Jeppesen, E; Brurberg, KG; Vist, GE; Wedzicha, JA; Wright, JJ; Greenstone, M; Walters, JA (May 16, 2012). "Hospital at home for acute exacerbations of chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 5: CD003573. doi:10.1002/14651858.CD003573.pub2. PMID 22592692.
- "WHO Disease and injury country estimates". World Health Organization. 2009. Retrieved Nov 11, 2009.
- Murray CJ, Vos T, Lozano R, Naghavi M, Flaxman AD, Michaud C, Ezzati M, Shibuya K, Salomon JA; et al. (December 2012). "Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2197–223. doi:10.1016/S0140-6736(12)61689-4. PMID 23245608.
- Vos T, Flaxman AD, Naghavi M, Lozano R, Michaud C, Ezzati M, Shibuya K, Salomon JA, Abdalla S, Aboyans V; et al. (December 2012). "Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2163–96. doi:10.1016/S0140-6736(12)61729-2. PMID 23245607.
- Medicine, prepared by the Department of Medicine, Washington University School of (2009). The Washington manual general internal medicine subspecialty consult (2nd ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 96. ISBN 978-0-7817-9155-7.
- "Chronic obstructive pulmonary disease (COPD) Fact sheet N°315". WHO. November 2012.
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R; et al. (December 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- Rycroft CE, Heyes A, Lanza L, Becker K (2012). "Epidemiology of chronic obstructive pulmonary disease: a literature review". Int J Chron Obstruct Pulmon Dis. 7: 457–94. doi:10.2147/COPD.S32330. PMC 3422122. PMID 22927753.
- Simpson CR, Hippisley-Cox J, Sheikh A (2010). "Trends in the epidemiology of chronic obstructive pulmonary disease in England: a national study of 51 804 patients". Brit J Gen Pract. 60 (576): 483–8. doi:10.3399/bjgp10X514729. PMC 2894402. PMID 20594429.
- Centers for Disease Control and Prevention (Nov 23, 2012). "Chronic Obstructive Pulmonary Disease Among Adults — United States, 2011". Morbidity and Mortality Weekly Report. 61 (46): 938–43. PMID 23169314.
- "Morbidity & Mortality: 2009 Chart Book on Cardiovascular, Lung, and Blood Diseases" (PDF). National Heart, Lung, and Blood Institute. Archived from the original (PDF) on 19 October 2013. Retrieved 7 February 2015.
- Torio CM, Andrews RM (2006). "National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2011: Statistical Brief #160". Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. Agency for Health Care Policy and Research. PMID 24199255.
- "Emphysema". Dictionary.com. Retrieved 21 November 2013.
- Ziment, Irwin (1991). "History of the Treatment of Chronic Bronchitis". Respiration. 58 (Suppl 1): 37–42. doi:10.1159/000195969. PMID 1925077.
- Petty TL (2006). "The history of COPD". Int J Chron Obstruct Pulmon Dis. 1 (1): 3–14. doi:10.2147/copd.2006.1.1.3. PMC 2706597. PMID 18046898.
- Wright, Joanne L.; Churg, Andrew (2008). "Pathologic Features of Chronic Obstructive Pulmonary Disease: Diagnostic Criteria and Differential Diagnosis" (PDF). In Fishman, Alfred; Elias, Jack; Fishman, Jay; Grippi, Michael; Senior, Robert; Pack, Allan. Fishman's Pulmonary Diseases and Disorders (4th ed.). New York: McGraw-Hill. pp. 693–705. ISBN 978-0-07-164109-8.
- George L. Waldbott (1965). A struggle with Titans. Carlton Press. p. 6.
- Fishman AP (May 2005). "One hundred years of chronic obstructive pulmonary disease". Am. J. Respir. Crit. Care Med. 171 (9): 941–8. doi:10.1164/rccm.200412-1685OE. PMID 15849329.
- Yuh-Chin, T. Huang (2012-10-28). A clinical guide to occupational and environmental lung diseases. [New York]: Humana Press. p. 266. ISBN 978-1-62703-149-3.
- "Pink Puffer - definition of Pink Puffer in the Medical dictionary - by the Free Online Medical Dictionary, Thesaurus and Encyclopedia". Medical-dictionary.thefreedictionary.com. Retrieved 2013-07-23.
- Weinberger, Steven E. (2013-05-08). Principles of pulmonary medicine (6th ed.). Philadelphia: Elsevier/Saunders. p. 165. ISBN 978-1-62703-149-3.
- Des Jardins, Terry (2013). Clinical Manifestations & Assessment of Respiratory Disease (6th ed.). Elsevier Health Sciences. p. 176. ISBN 978-0-323-27749-5.
- An outcomes strategy for people with chronic obstructive pulmonary disease (COPD) and asthma in England (PDF). Department of Health. 18 July 2011. p. 5. Retrieved 27 November 2013.
- Lomborg, Bjørn (2013). Global problems, local solutions: costs and benefits. Cambridge University Press. p. 143. ISBN 978-1-107-03959-9.
- Bloom, D (2011). The Global Economic Burden of Noncommunicable Diseases (PDF). World Economic Forum. p. 24.
- Nici, Linda (2011). Chronic Obstructive Pulmonary Disease: Co-Morbidities and Systemic Consequences. Springer. p. 78. ISBN 978-1-60761-673-3.
- Inamdar, AC; Inamdar, AA (Oct 2013). "Mesenchymal stem cell therapy in lung disorders: pathogenesis of lung diseases and mechanism of action of mesenchymal stem cell". Experimental lung research. 39 (8): 315–27. doi:10.3109/01902148.2013.816803. PMID 23992090.
- Conese, M; Piro, D; Carbone, A; Castellani, S; Di Gioia, S (2014). "Hematopoietic and mesenchymal stem cells for the treatment of chronic respiratory diseases: role of plasticity and heterogeneity". TheScientificWorldJournal. 2014: 859817. doi:10.1155/2014/859817. PMC 3916026. PMID 24563632.
- Akers, R. Michael; Denbow, D. Michael (2008). Anatomy and Physiology of Domestic Animals. Arnes, AI: Wiley. p. 852. ISBN 978-1-118-70115-7.
- Wright, JL; Churg, A (December 2002). "Animal models of cigarette smoke-induced COPD". Chest. 122 (6 Suppl): 301S–6S. doi:10.1378/chest.122.6_suppl.301S. PMID 12475805.
- Churg, A; Wright, JL (2007). "Animal models of cigarette smoke-induced chronic obstructive lung disease". Contributions to microbiology. Contributions to Microbiology. 14: 113–25. doi:10.1159/000107058. ISBN 3-8055-8332-X. PMID 17684336.
- Marinkovic D, Aleksic-Kovacevic S, Plamenac P (2007). "Cellular basis of chronic obstructive pulmonary disease in horses". Int. Rev. Cytol. International Review of Cytology. 257: 213–47. doi:10.1016/S0074-7696(07)57006-3. ISBN 978-0-12-373701-4. PMID 17280899.
- Miller MS, Tilley LP, Smith FW (January 1989). "Cardiopulmonary disease in the geriatric dog and cat". Vet. Clin. North Am. Small Anim. Pract. 19 (1): 87–102. PMID 2646821.
مطالعات بیشتر
- "Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Updated 2013" (PDF). Global Initiative for Chronic Obstructive Lung Disease. Archived from the original (PDF) on 4 October 2013. Retrieved November 29, 2013.
- National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- Qaseem, Amir; Wilt, TJ; Weinberger, SE; Hanania, NA; Criner, G; Van Der Molen, T; Marciniuk, DD; Denberg, T; Schünemann, H; Wedzicha, W; MacDonald, R; Shekelle, P; American College Of, Physicians; American College of Chest Physicians; American Thoracic, Society; European Respiratory, Society (2011). "Diagnosis and Management of Stable Chronic Obstructive Pulmonary Disease: A Clinical Practice Guideline Update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society". Annals of Internal Medicine. 155 (3): 179–91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710.